
Біологічна та біоорганічна хімія_Мардашко О.О._ изд. 2008-342 с._ОНМедУ-2012
.pdf
|
Цитрулін |
+ NH3 |
|
||
|
|
|
Аспартат |
Оксалоацетат |
Ацетил-КоА |
|
|
|
+ АТФ |
|
|
|
Цикл |
|
|
Малат |
|
|
|
- АМФ - ПФ |
|
|
|
Карбамоїл- |
синтезу |
|
ЦТК |
Цитрат |
|
Аргініно- |
|
||||
фосфат |
сечовини |
|
|
|
|
|
сукцидат |
|
Фумарат |
|
|
|
|
|
Ізоцитрат |
||
|
|
|
|
|
|
Орнітин |
|
Аргінін |
|
Сукцинат |
|
|
|
|
Кетоглутарат |
||
|
|
|
|
||
CO2 + NH3 + 2 АТФ |
|
|
|
|
|
Глутамін |
+ NH3 |
|
Глутамат |
+ NH3 |
|
|
|
|
|
|
|
N-ацетил-
глутамат
Сечовина
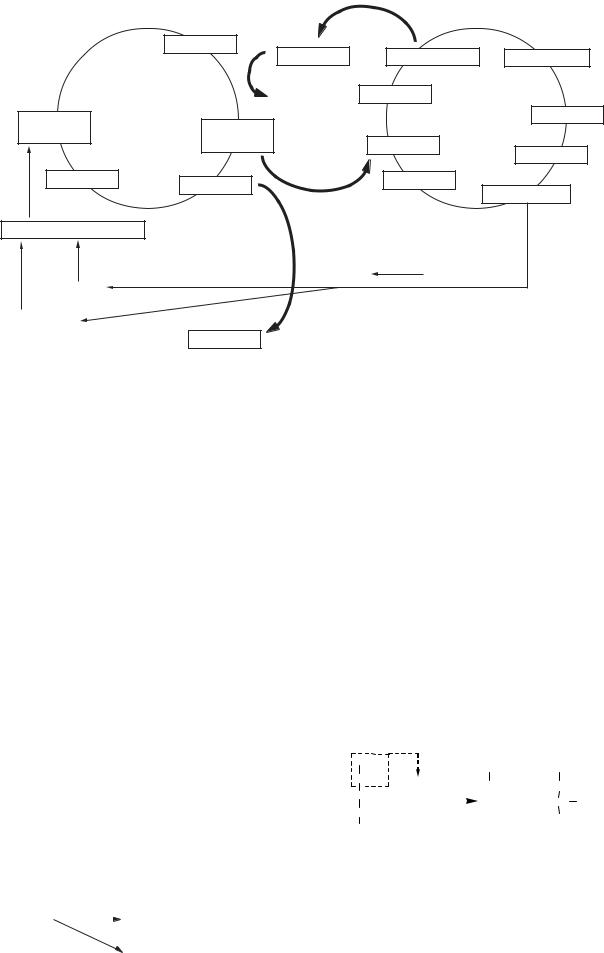
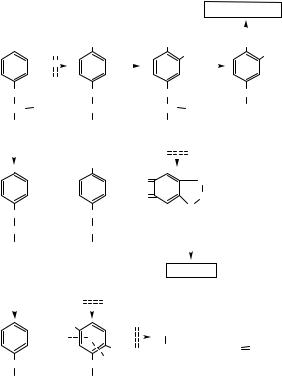
Рис. 11.3. Зв’язок циклу синтезу сечовини і циклу трикарбонових кислот
і набуті гіперамоніємії: вроджені пов’язані з вро- |
Лізин входить до складу білків, є незамінною |
|||||||||||||||||
дженими порушеннями синтезу кожного з 5 фер- |
амінокислотою (не синтезується в тканинах тва- |
|||||||||||||||||
ментів орнітинового циклу; набута гіперамоніє- |
рин і людини). Значну кількість лізину містять |
|||||||||||||||||
мія спостерігається при захворюваннях печінки |
такі білки, як протаміни й гістони, які з’єднують- |
|||||||||||||||||
внаслідок ослаблення біосинтезу сечовини у ге- |
ся з нуклеїновими кислотами й разом утворюють |
|||||||||||||||||
патоцитах. |
|
складні білки — нуклеопротеїни. |
|
|||||||||||||||
|
|
|
Особливий інтерес представляє обмін аргіні- |
|||||||||||||||
|
|
|
ну. Ця амінокислота, як і лізин, входить до скла- |
|||||||||||||||
11.4. СПЕЦІАЛІЗОВАНІ ШЛЯХИ |
ду протамінів і гістонів. При гідролізі аргініну за |
|||||||||||||||||
участю аргінази утворюються сечовина й орні- |
||||||||||||||||||
ОБМІНУ АЦИКЛІЧНИХ |
||||||||||||||||||
тин. Аргінін є субстратом для утворення оксиду |
||||||||||||||||||
І ЦИКЛІЧНИХ АМІНОКИСЛОТ. |
||||||||||||||||||
нітрогену. |
|
|
|
|
|
|
|
|
|
|||||||||
БІОСИНТЕЗ ГЛУТАТІОНУ |
До того ж аргінін разом із гліцином і метіоні- |
|||||||||||||||||
ТА КРЕАТИНУ. ЕНЗИМОПАТІЇ |
ном необхідні для біосинтезу важливої для м’язів |
|||||||||||||||||
АМІНОКИСЛОТНОГО ОБМІНУ |
сполуки — креатину. |
|
|
|
|
|
|
|||||||||||
Особливості обміну |
Обмін і біологічна роль креатинфосфату |
|||||||||||||||||
Синтез креатину перебігає в 2 етапи: |
||||||||||||||||||
діаміномонокарбонових кислот |
||||||||||||||||||
1. Перенос амідинової групи від аргініну на |
||||||||||||||||||
|
|
|
||||||||||||||||
Крім загальних шляхів обміну амінокислот |
гліцин з утворенням глікоціаміну (гуанідинаце- |
|||||||||||||||||
(дезамінування, трансамінування, декарбокси- |
тату) і орнітину. Каталізує реакцію фермент |
|||||||||||||||||
лювання), існують індивідуальні шляхи обміну |
гліцинамідинотрансфераза. Ця реакція перебігає |
|||||||||||||||||
майже всіх амінокислот. У процесі індивідуаль- |
переважно в нирках. |
|
|
|
|
|
|
|||||||||||
них перетворень амінокислот можуть утворюва- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
тися продукти реакції, що відіграють важливу |
|
NH2 |
|
|
|
|
|
NH2 |
NH2 |
|||||||||
роль в обміні речовин і у фізіологічних функціях |
|
|
|
|
|
|
||||||||||||
C |
|
|
NH |
|
NH2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
організму. До цих амінокислот належать аргінін, |
|
|
|
|
C |
|
NH |
(CH2)3 |
||||||||||
|
|
|
|
|
||||||||||||||
NH |
|
|
|
|
|
|||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
лізин, орнітин і цитрулін. |
+ |
CH2 |
|
|
|
NH |
+ |
CH NH2 |
||||||||||
|
|
|
|
|
|
|
||||||||||||
Цитрулін у складі білків не виявлений, утво- |
(CH2)3 |
|
|
|
|
|
|
|
|
|
||||||||
COOH |
|
|
CH2 |
COOH |
||||||||||||||
рюється з орнітину і є проміжним продуктом біо- |
CH |
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
COOH |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
синтезу сечовини. |
|
|
COOH |
|
|
|
|
|
|
|
|
|
||||||
Орнітин у складі білків також не виявлений. |
Аргінін |
Гліцин |
Гуанідинацетат Орнітин |
|||||||||||||||
Утворюється з аргініну в процесі біосинтезу сечо- |
2. Перенос метильної групи від активної фор- |
|||||||||||||||||
вини або біосинтезу креатину. |
||||||||||||||||||
ми метіоніну S-аденозилметіоніну на гуанідин- |
||||||||||||||||||
|
+ НОН |
|
||||||||||||||||
Аргінін |
Сечовина + Орнітин |
ацетат з утворенням креатину. Цей етап синте- |
||||||||||||||||
|
зу креатину відбувається в печінці. Гуанідин- |
|||||||||||||||||
|
+ Гліцин |
|||||||||||||||||
|
|
Гуанідинацетат + Орнітин |
ацетат із нирок течією крові переноситься в печін- |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
160
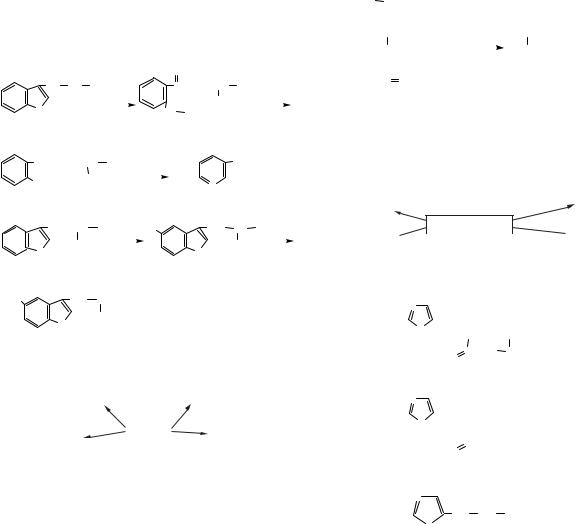

Метаболізм α -аланіну |
великої кількості пептидів, деякі з яких мають |
||||||
|
|
Білки |
|
токсичну дію. Токсичні пептиди викликають |
|||
|
|
|
зміни з боку клітин (цитоліз) і сприяють збільшен- |
||||
Глутамат |
|
|
|
|
Триптофан |
||
|
|
|
|
ню проникності капілярів. |
|||
|
|
α -Аланін |
|
|
У практичній медицині застосовують препа- |
||
Аспартат |
|
|
|
|
|
рати гідролізатів білків і окремих амінокислот, |
|
|
|
|
|
|
|
серед яких: |
|
Сечовина |
NH3 + Піруват |
Глюкоза |
Метіонін, а також гідролізати, що містять |
||||
його у великих кількостях, застосовуються як |
|||||||
|
|
|
|
|
|
ліпотропні фактори і для лікування білкової не- |
|
Гліцин |
|
|
|
|
Валін |
достатності при хронічних захворюваннях, для |
|
Серин |
|
|
|
|
Лейцин |
лікування хвороб печінки. |
|
Цистеїн |
|
Ізолейцин |
Цистеїн є замінною амінокислотою, може син- |
||||
Ацетоацетат |
Ацетил-КоА |
Жирні |
тезуватися в організмі з використанням метіоні- |
||||
ну. Цистеїн бере участь в обміні речовин криш- |
|||||||
|
|
|
|
|
кислоти |
||
|
|
|
|
|
|||
Холестерин |
|
|
|
|
Холін |
талика ока. Зміни, що відбуваються при ката- |
|
|
|
|
|
||||
|
ЦТК |
ракті, пов’язані з порушенням вмісту цистеїну в |
|||||
|
|
|
|||||
|
|
|
кришталику. Тому пропонують застосовувати |
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
цистеїн для затримки розвитку катаракти і про- |
|
Природжені порушення обміну |
яснення кришталика при початкових формах |
||||||
вікової, міопатичної, променевої та травматичної |
|||||||
окремих амінокислот |
|
катаракти. |
|||||
|
|
|
|
|
|
Широко використовуються в клініціглутамат |
|
Фенілкетонурія (фенілпіровиноградна оліго- |
і аспартат (останній у вигляді калієвих і магні- |
||||||
френія) розвивається як результат втрати здат- |
євих солей) — препарати «панангін» і «аспар- |
||||||
ності організму синтезувати фенілаланінгідрок- |
кам». |
||||||
силазу, що каталізує перетворення фенілаланіну |
У медичній практиці глутамат застосовують, |
||||||
на тирозин. Особливістю хвороби є різке уповіль- |
головним чином, при лікуванні захворювань |
||||||
нення розумового розвитку дитини. |
центральної нервової системи (нарівні з глутама- |
||||||
Алькаптонурія характеризується екскрецією з |
том також кальцію глутамат), глутамін викорис- |
||||||
сечею великих кількостей гомогентизинової кис- |
товують при кетонурії. |
||||||
лоти, окиснення якої на повітрі надає сечі темно- |
Сьогодні розробляються препарати сумішей |
||||||
го забарвлення. Хвороба пов’язана з природже- |
кристалічних амінокислот, особливо незамін- |
||||||
ною відсутністю в печінці та нирках оксидази го- |
них, які в певних співвідношеннях застосову- |
||||||
могентизинової кислоти. |
|
ються в чистому вигляді або як добавки до |
|||||
Альбінізм — природжена відсутність пігментів |
інших лікарських засобів природного походжен- |
||||||
у шкірі, волоссі та сітківці. Метаболічний дефект |
ня. |
||||||
пов’язаний з втратою меланоцитами здатності |
Препарати гідролізатів білків. Шляхом |
||||||
синтезувати тирозиназу — фермент, що каталі- |
кислотного або ферментативного гідролізу |
||||||
зує окиснення тирозину в діоксифенілаланін і ді- |
різних білків одержують препарати гідролі- |
||||||
оксифенілаланінхінон, які є попередниками мела- |
затів білків: гідролізин, гідролізат казеїну, це- |
||||||
ніну. |
|
|
|
|
|
ребролізин, амінокровін, фібриносол, аміно- |
|
Хвороба «кленового сиропу», при якій поруше- |
пептид. Це розчини амінокислот і найпрості- |
||||||
но декарбоксилювання лейцину, ізолейцину, ва- |
ших пептидів, одержувані гідролізом білків |
||||||
ліну, тобто амінокислот із розгалуженим вугле- |
тваринного або рослинного походження. Ці |
||||||
цевим ланцюгом, що призводить до нагрома- |
препарати компенсують білкове голодування |
||||||
дження в крові амінокислот і α |
-кетокислот, екс- |
організму, забезпечують рівновагу і навіть |
|||||
креції їх із сечею, що має запах кленового сиро- |
позитивний азотистий баланс у хворих після |
||||||
пу. Хвороба зустрічається рідко, виявляється в |
операцій на шлунково-кишковому тракті, при |
||||||
ранньому дитячому віці й призводить до пору- |
тяжких опіках. |
||||||
шення функції мозку і летального кінця, якщо не |
Розчини кристалічних амінокислот. Полі- |
||||||
обмежити або повністю не виключити надхо- |
амін є розчином кристалічних амінокислот, які |
||||||
дження з їжею лейцину, ізолейцину і валіну. |
під час надходження до судинного русла |
||||||
Анафілактичний шок і анафілактичні реакції |
відразу вступають у процеси синтезу. Вони |
||||||
зумовлені порушеннями обміну білків. Реакція |
позитивно впливають на білковий обмін, за- |
||||||
антиген-антитіло призводить до активації L- |
безпечують збільшення маси тіла, мають дез- |
||||||
гістидиндекарбоксилази і клітинних пептидів, |
інтоксикаційну дію (знижують вміст аміаку за |
||||||
що посилює утворення гістаміну з гістидину. У |
рахунок утворення нетоксичних метаболітів |
||||||
результаті надмірного синтезу гістаміну посилю- |
глутаміну, сечовини). Амінокислотні суміші |
||||||
ються спазми гладкої мускулатури і підвищуєть- |
протипоказані при порушенні функції нирок і |
||||||
ся проникність капілярів. |
|
печінки, дегідратації (зневодненні), шоку, гос- |
|||||
Активація клітинних пептидаз спричинює |
трих гемодинамічних порушеннях і вираженій |
||||||
посилений розпад клітинних білків і утворення |
серцевій недостатності. |
||||||
166




 Цистатіонін
Цистатіонін Цистеїн
Цистеїн

 Гістамін (метилкарнозин)
Гістамін (метилкарнозин)