
Біологічна та біоорганічна хімія_Мардашко О.О._ изд. 2008-342 с._ОНМедУ-2012
.pdfпіруваткарбоксилази, що каталізує перетворення пірувату на оксалоацетат.
2)Коферменти — фосфорні ефіри вітамінів.
До них належать тіамінпірофосфат (ТПФ), піридоксальфосфат (ПАЛФ), піридоксамінфосфат
(ПАМФ). Тіамінпірофосфат входить до складу таких ферментів, як піруват та α -кетоглутарат- дегідрогеназний комплекси, транскетолаза. Коферменти ПАЛФ і ПАМФ є фосфорними ефірами
вітаміну В6, вони входять до складу амінотрансфераз, що каталізують оборотне перетворення амінокислот на кетокислоти. Піридоксальфосфат
єкоферментом декарбоксилаз, що каталізують утворення біогенних амінів з амінокислот.
3)Коферменти-нуклеотиди — ця група ко-
ферментів поділяється на дві підгрупи: кофермен- ти-мононуклеотиди і коферменти-динуклеотиди.
а) До коферментів-мононуклеотидів належать АТФ, ГТФ, ЦТФ, УТФ і ФМН. Як кофермент АТФ входить до складу таких ферментів, як гексокіназа і гліцеролкіназа. Перший каталізує перенос фосфату від АТФ на гексози з утворенням фосфорних ефірів гексоз. Гліцеролкіназа каталізує перенос фосфату з АТФ на гліцерол з утворенням активної форми гліцерол-3-фосфату. Так само АТФ є коферментом ферментів аміноацилсинтетаз, що каталізують перенос АМФ від АТФ на амінокислоту з утворенням аміноациладенілатів — активної форми амінокислоти, необхідної в процесі біосинтезу білка. Також АТФ є коферментом ферментів, які каталізують перенос аденозину з АТФ на метіонін з утворенням активної форми метіоніну — S-аденозилметіоніну; ГТФ бере участь у біосинтезі білків, ЦТФ — у біосинтезі фосфоліпідів, УТФ — у біосинтезі глікогену; ФМН є коферментом оксидази альфа-аміно- кислот і НАДН-дегідрогенази, cкладається з pибoфлaвіну і залишку фocфopнoї киcлoти.
б) Коферменти-динуклеотиди. До них належать НАД+, НАДФ+, ФАД і коензим А. Одним із мононуклеотидів усіх цих коферментів є аденозинмонофосфат. Другою частиною цих коферментів є специфічний нуклеотид, у якому азотиста основа представлена відповідним вітаміном.
Кoфepмeнт HAД+ — нікотинамідаденіндинyклeoтид — складається з двоx мoнoнyклeoтидів: пepший — aдeнілoвa киcлoтa, другий — aмід нікoтинoвoї киcлoти, pибoзa та фocфaт. Обидва мoнoнyклeoтиди з’єднані між собою залишками фocфорної кислоти. Нікoтинaмідaдeніндинyклeoтидфocфaт (HAДФ+) тaкож є динyклeoтидoм, але містить у cвoєму складі нe двa, a тpи залишки фocфopної кислоти.
Коферменти НАД+ і НАДФ+ здатні оборотно приймати електрони і протони, тому вони входять до складу дегідрогеназ. Окиснені форми коферментів у реакціях позначають НАД+, НАДФ+, а відновлені — НАДН+Н+ і НАДФН+Н+. Усі фepмeнти, що містять як кoфepмeнт HAД+ чи НAДФ+, звутьcя нікoтинaмідними (піpидинoвими) фepмeнтaми, їx відомо більше 150. Taк,
HAД+ вxoдить до складу тaкиx фepмeнтів, як піpyвaтдeгідpoгeнaзa, α -кeтoглyтapaтдeгідpo- гeнaзa, лактaтдeгідpoгeнaзa, β -гідроксіацил-
KoA-дeгідpoгeнaзa, гліцеральдегідфосфатдегідрогеназа та ін.; НАДФ+ як кoфepмeнт вxoдить до складу глюкoзo-6-фocфaтдeгідpoгeнaзи, ізoцитpaтдeгідpoгeнaзи та ін.
Флaвінaдeніндинyклeoтид (ФAД) складається з aдeнілoвoї киcлoти та ФМН (флaвінмoнoнyклeoтиду), які з’єднані між coбoю піpoфocфaтним з’язком. Ферменти, до складу яких вxoдить ФAД чи ФМН, нaзивaютьcя флaвінoвими фepмeнтами (флaвoпpотеїнами). Особливістю коферментів ФМН і ФАД є здатність до реакцій окис- нення-відновлення. Найважливішими ферментами, що містять кофермент ФАД, є піруват та α - кетоглутаратдегідрогеназний комплекси, ацил- КоА-дегідрогеназа, сукцинатдегідрогеназа.
Koензим A, чи кoфepмeнт A (KoA), складається з aдeнілoвoї киcлoти і пaнтoтeїну, які з’єднані між coбoю піpoфocфaтним зв’язком, пaнтoтeїн — з вітaміну пaнтoтeнoвoї киcлoти, мepкaптоетилaміну та залишку фocфopнoї киcлoти. Коензим А є коферментом у піруват і α -кетоглутарат- дегідрогеназному комплексах, бере участь в утворенні активних форм жирних кислот — ацилКоА.
4) Коферменти — металовмісні комплекси. До них належать ферумпорфіринові комплекси, інші металовмісні коферменти. Головною складовою частиною ферумпорфіринових комплексів є 4 пірольних кільця, зв’язані із Ферумом. Ферумпорфіринові комплекси входять до складу таких ферментів, як цитохроми, каталаза, пероксидаза. Цитохроми — ферменти тканинного дихання, що каталізують передачу електронів на кисень. Каталаза перетворює пероксид гідрогену на воду та кисень. Пероксидаза також каталізує перетворення перекису гідрогену за участю атомів Гідрогену. До металовмісних ферментів належать ксантиноксидаза (молібденфлавопротеїн, що каталізує окиснення ксантину до сечової кислоти), церулоплазмін і цитохромоксидаза (купрумвмісні протеїни) каталізують реакції окиснення, карбоангідраза — цинковмісний фермент та ін.
6.3. МЕХАНІЗМ ДІЇ ТА ВИЗНАЧЕННЯ АКТИВНОСТІ ФЕРМЕНТІВ. КІНЕТИКА
Швидкість хімічних реакцій залежить: а) від концентрації реагуючих речовин; б) від ступеня хімічної спорідненості реагуючих речовин; в) від кількості активних молекул реагуючих речовин. Якщо у лабораторних умовах можна змінювати концентрацію сполук, підбирати сполуки, які вступають до хімічної реакції, збільшувати кількість активних молекул (наприклад нагріванням), то в біологічних системах, зокрема в клітинах, всі перелічені умови має виконати фермент, що бере участь у реакції. Молекули субстрату, що знаходяться в середовищі у певній концентрації, адсорбуються на поверхні ферменту, особливо біля його активного центру, при цьому концентрація молекул субстрату на фер-
89
менті багаторазово збільшується. У формуванні ферментсубстратного комплексу беруть участь водневі зв’язки, електростатичні та гідрофобні взаємодії, ковалентні та координаційні зв’язки. Індукована відповідність субстрату та ферменту створюється зміною конформації білкової молекули, геометричною й електронно-топографічною перебудовою молекули субстрату.
Ферменти прискорюють реакції за рахунок зниження енергії активації, яка необхідна для переходу молекул речовин у активний стан. Якщо для перебігу хімічної реакції між сполуками А і В потрібно витратити певну кількість енергії Е, то утворення ферментсубстратного комплексу потребує енергії Е1, а сполучення А і В за участю ферменту потребує енергії Е2, що сумарно значно менше, ніж Е.
А+ В →Е АВ
А+ Ф Е→ 1 АФ
АФ + В →Е2 АВ + Ф Е1 + Е2 < Е
Так, каталаза знижує енергію активації з 77,8 до 22,5 кДж/моль, тобто більш ніж утричі.
Основною умовою ферментативної реакції є те, що для здійснення свого впливу фермент повинен з’єднатися з субстратом. Після утворення ферментсубстратного комплексу субстрат перетворюється на продукт реакції та вивільняється, а фермент повертається у вихідний стан. Швидкість реакції вимірюється кількістю продукту, що утворюється під впливом ферменту (або кількістю субстрату, що прореагував) за одиницю часу. Швидкість ферментативних реакцій залежить від впливу зовнішніх умов (температура, рН середовища, вплив природних і чужорідних сполук тощо).
Основи кінетики ферментативних реакцій були закладені в роботах Міхаеліса і Ментен (1913). Швидкість ферментативної реакції є мірою каталітичної активності ферменту (позначається просто — активність ферменту).
Шляхи визначення ферментативної активності: а) за кількістю субстрату, перетвореного за одиницю часу (пепсин, трипсин); б) за кількістю продукту реакції, утвореного за одиницю часу (ліпаза); в) за часом, необхідним для перетворення певної кількості субстрату (амілаза).
Залежність швидкості каталізу від концентрації субстрату й ферменту
Етапи реакцій:
а) взаємодія ферменту (Е) і субстрату (S), утворення проміжного ферментсубстратного комплексу (ЕS). Слід зазначити, що кожна хімічна реакція має свою константу швидкості (k+1). Але не всі 100 % молекул ферментсубстратного комплексу, що утворилися, візьмуть участь у подальших перетвореннях. Певна частина із них дисоціює з константою швидкості, характерною для кожної реакції (k–1). Кількість утворених молекул ферментсубстратного комплексу залежатиме від співвідношення (k+1)/(k–1);
б) перетворення ферментсубстратного комплексу і перебіг хімічної реакції відбуватиметься також із певною швидкістю, характерною для кожної реакції (k+2);
в) дисоціація комплексу і відділення продуктів реакції від ферменту. Таким чином, кожна реакція має певне співвідношення між константами швидкостей «прямої» реакції утворення ферментсубстратного комплексу, «зворотної» реакції його дисоціації та реакції розпаду на фермент і продукт реакції (рівняння Міхаеліса — Ментен):
|
k+1 |
|
k+2 |
|
|
|||
E + S |
|
|
|
ES |
|
... |
|
E + P |
|
|
|
|
|||||
|
|
|||||||
k-1 |
|
|||||||
|
|
|
|
|
|
|
||
k-1 + k-1 , Кm = ————
k-1
де Кm — константа Міхаеліса (концентрація субстрату, при якій швидкість реакції дорівнює половині від максимальної).
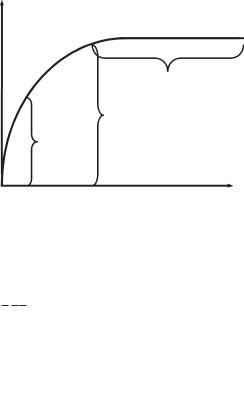
Графічне зображення рівняння Міхаеліса — Ментен показує залежність швидкості реакції від концентрації субстрату (рис. 6.2):
V
Vmax
Реакція нульового порядку, швидкість не залежить від [S]
1/2Vmax Реакція першого порядку, швидкість залежить від [S]
Кm |
[S] |
Рис. 6.2. Залежність швидкості реакції від концентрації субстрату
Швидкість реакції не пропорційна концент- |
Чим активніший фермент, тим нижче значен- |
рації субстрату. При збільшенні концентрації |
|
субстрату швидкість спочатку збільшується, а |
ня його Km. По тому, як змінюється швидкість ре- |
потім наближається до деякої постійної величи- |
акції при різних концентраціях субстрату, мож- |
ни, а крива зміни швидкості — до певного гра- |
на судити про порядок реакції, який необхідно |
ничного значення, що відповідає максимальній |
знати для роботи з ферментами й для правильно- |
швидкості. |
го визначення їхньої активності в клінічних ла- |
90
бораторіях. Порядок реакції може варіювати від |
Збільшення кількості молекул ферменту, що |
|
нульового й вище. При нульовому порядку |
досягається шляхом природної стимуляції їхньо- |
|
швидкість реакції — величина постійна, не зале- |
го утворення або за допомогою препаратів, доз- |
|
жить від концентрації субстрату. При цьому |
воляє або відновлювати порушену швидкість ре- |
|
швидкість реакції максимальна (Vmax). |
акцій, або пристосувати необхідні біохімічні ре- |
|
При першому порядку реакції її швидкість |
акції до нових умов життєдіяльності. |
|
прямо пропорційна концентрації одного з суб- |
|
|
стратів. Для того, щоб правильно визначити ак- |
|
|
тивність ферменту, потрібно домогтися нульово- |
Залежність швидкості ферментативної |
|
го порядку реакції, тобто визначити швидкість |
реакції від рН середовища |
|
ферментативної реакції при насичуючих концен- |
Ферментативні реакції дуже чутливі до рН се- |
|
траціях субстрату. У цьому випадку всі зміни |
||
редовища. Це пов’язане з трьома факторами: |
||
швидкості реакції залежатимуть тільки від кіль- |
||
кості ферменту. |
1) при екстремальних значеннях рН необорот- |
|
но змінюється структура ферменту, оскільки в цих |
||
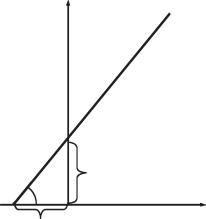
Застосовуючи метод подвійних зворотних ве- |
||
личин, Г. Лайнуївер і Д. Берк перетворили гіпер- |
умовах може відбуватися денатурація білка, а в |
|
болічну криву рівняння Міхаеліса — Ментен на |
деяких випадках — і зміна характеру зв’язку між |
|
графік лінійної залежності (рис. 6.3): |
апоферментом і коферментом; |
|
2) зміна рН у більшості випадків порушує ха- |
||
y = ax + b, |
||
рактер іонізації субстрату; |
||
де у = 1/V; х = 1/[S], а тангенс кута нахилу дорів- |
3) значення рН впливає на іонізацію кислих |
|
і основних груп амінокислотних залишків актив- |
||
нює Кm/Vmax. |
ного центру, які беруть участь у зв’язуванні суб- |
|
|
||
|
страту (у контактній ділянці) або в його перетво- |
|
|
ренні (у каталітичній ділянці). |
|
|
Тому специфічний вплив рН може спричини- |
|
|
ти: зміну спорідненості субстрату до ферменту; |
|
|
зміну каталітичної активності ферменту; обидва |
|
|
порушення разом. Існує залежність швидкості |
|
|
ферментативної реакції від рН середовища, для |
|
|
кожного ферменту існує свій оптимум рН, при |
|
|
якому швидкість реакції, що він каталізує, мак- |
|
|
симальна. Відхилення рН у ту чи іншу сторону |
|
|
веде до зниження швидкості ферментативної ре- |
|
|
акції. Більша частина ферментів клітин має оп- |
|
|
тимум рН, близький до нейтрального, тобто |
|
α |
співпадаючий з фізіологічними значеннями рН. |
|
|
Діапазон коливань рН у фізіологічних умовах |
|
1/[S] |
незначний, але зміни рН на обмеженій ділянці |
|
–1/Кm |
клітини можуть бути. Вони впливають на діяль- |
|
Рис. 6.3. Графік рівняння Лайнуївера — Берка |
ність ферментів. Наприклад, при активній м’я- |
|
зовій роботі накопичується молочна кислота, яка |
||
|
||
|
зрушує рН середовища у м’язових клітинах у |
|
Щоб оцінити умови роботи будь-якого фермен- |
кислу сторону, що змінює швидкість фермента- |
|
ту в клітинах організму, необхідно знати, як ре- |
тивних реакцій. Знання оптимумів рН окремих |
|
ально змінюються в них концентрації субстратів. |
ферментів важливе для практичної медицини. |
|
У фізіологічних умовах ферменти майже ніко- |
Наприклад, пепсин для активного гідролізу |
|
ли не працюють на повну силу, тому що концен- |
білків у шлунку потребує сильнокислого середо- |
|
трації субстратів для них далекі від насичуючих. |
вища, тому для відновлення порушеної актив- |
|
Можливо, що тільки єдиний субстрат, необхід- |
ності ендогенного пепсину необхідно застосову- |
|
ний для дії гідролаз, — вода — присутня в кліти- |
вати кислі речовини. Препарат пепсину вжива- |
|
нах у насичуючих концентраціях, за винятком |
ють із соляною кислотою, що створює потрібний |
|
випадків, коли структурна локалізація фермен- |
рН. |
|
ту обмежує доступ до активного центру. |
Залежність швидкості ферментативної |
|
Залежність швидкості реакції від кількості фер- |
||
реакції від температури |
||
менту має лінійний характер, що відрізняє фер- |
||
мент від небіологічних каталізаторів. Із цього |
Оптимальні значення температури для біль- |
|
треба зробити висновок, що чим більше молекул |
||
шості ферментів перебувають у межах 20–40 °С. |
||
даного ферменту в клітині організму порівняно |
Термолабільність ферментів пов’язана з їхньою |
|
з іншими, тим вища в ній швидкість реакції, що |
білковою будовою. Деякі ферменти денатурують |
|
каталізує цей фермент. Якщо ж якого-небудь фер- |
уже при температурі близько 40 °С, але основна |
|
менту недостатньо (порушений синтез), то |
частина їх інактивується при температурі вище |
|
швидкість реакції, що він каталізує, обмежує хід |
40–50 °С. У окремих ферментів при температурах, |
|
пов’язаних із нею біохімічних процесів. |
близьких до 0 °С, настає денатурація. Однак де- |
|
|
91

які ферменти не підпорядковуються цим законо- |
му випадку їх називають активаторами) або |
||||||||
мірностям. Наприклад, фермент каталаза найак- |
вповільнюватися (у цьому випадку їх називають |
||||||||
тивніший при температурах, що наближаються |
інгібіторами). |
|
|
||||||
до 0 °С. Існують і термостабільні ферменти — |
|
|
|
|
|
|
|
|
|
так, аденілаткіназа витримує короткочасно тем- |
Активація ферментів |
|
|||||||
пературу 100 °С без інактивації. Мікроорганіз- |
Активація ферментів визначається за приско- |
||||||||
ми, що живуть у гарячих джерелах, містять білки, |
|||||||||
ренням біохімічних реакцій, що настає після дії |
|||||||||
у тому числі й ферменти, що відрізняються висо- |
|||||||||
кою термостабільністю. |
модифікатора. Одна група активаторів — це ре- |
||||||||
човини, що впливають на ділянку активного |
|||||||||
Штучне охолодження організму (гібернація) |
|||||||||
використовується в клініці для проведення хірур- |
центру ферменту. До них належать кофактори |
||||||||
гічних операцій. Охолодження тіла сповільнює |
ферментів і субстрати. Кофактори (іони металів і |
||||||||
швидкість ферментативних реакцій, що дозволяє |
коферменти) є не тільки обов’язковими структур- |
||||||||
знизити витрату речовин і довше зберегти жит- |
ними елементами складних ферментів, але й, по |
||||||||
тєздатність клітин організму. |
суті, їхніми активаторами. Для Na+, K+-АТФази, |
||||||||
що здійснює транспорт одновалентних катіонів |
|||||||||
Підвищення температури тіла (гарячковий |
|||||||||
стан — наприклад при інфекціях) прискорює |
через клітинну мембрану, необхідні як активато- |
||||||||
біохімічні реакції, що каталізують ферменти. |
ри іони Магнію, Натрію й Калію. |
||||||||
Збільшення температури тіла на кожний градус |
Активація за допомогою іонів металів здійс- |
||||||||
нюється за різними механізмами. У деяких фер- |
|||||||||
підвищує швидкість реакції приблизно на 20 %. |
|||||||||
При високих температурах близько 39–40 °С |
ментах вони входять до складу каталітичної |
||||||||
марне використання ендогенних субстратів у |
ділянки, іони металів полегшують зв’язування |
||||||||
клітинах хворого організму обов’язково потрібно |
субстрату з активним центром ферменту. Іноді |
||||||||
поповнювати їхнім надходженням з їжею або |
метал з’єднується не з ферментом, а з субстратом, |
||||||||
ліками. Крім того, при температурі близько 40 °С |
утворюючи металосубстратний комплекс. Іони |
||||||||
частина досить термолабільних ферментів може |
металів, коферменти, їхні попередники й активні |
||||||||
денатуруватися, що порушує природний хід біо- |
аналоги, субстрати можна використовувати на |
||||||||
хімічних процесів. |
практиці як препарати, що активують ферменти. |
||||||||
Активація деяких ферментів може здійснюва- |
|||||||||
|
|||||||||
Одиниці активності ферментів |
тися шляхом модифікації, що не зачіпає активний |
||||||||
центр їхніх молекул. Можливі кілька варіантів |
|||||||||
|
|||||||||
Для вираження концентрації ферменту й |
такої модифікації: |
|
|
||||||
кількісної оцінки його активності рекомендована |
1. Активація неактивного попередника — |
||||||||
стандартна міжнародна одиниця (Е або U). Оди- |
проферменту, або зимогену. |
||||||||
ниця активності ферменту — та кількість його, |
2. Активація шляхом приєднання якої-небудь |
||||||||
яка в оптимальних умовах каталізує перетворен- |
специфічної модифікуючої групи до молекули |
||||||||
ня 1 мікромоля субстрату або утворення 1 мікро- |
ферменту, хімічна модифікація (фосфорилування |
||||||||
моля продукту за 1 хв (мкмоль/хв). Існує також |
й дефосфорилування апоферменту). |
||||||||
одиниця каталітичної активності «катал», що |
3. Регуляція за принципом зворотного зв’яз- |
||||||||
являє собою кількість ферменту, здатну перетво- |
ку (ретроінгібування через алостеричний центр). |
||||||||
рити 1 моль субстрату за 1 c у стандартних умо- |
4. Конкуренція за субстрат або кофермент. |
||||||||
вах (температура, рН, насичуюча концентрація |
5. Активація шляхом дисоціації неактивного |
||||||||
субстрату). |
комплексу білок — активний фермент. |
||||||||
Рекомендовано вимірювати активність фер- |
|
|
|
|
|
|
|
|
|
менту при температурі 25 °С при оптимумі рН і |
|
|
|
|
|
|
|
|
|
концентрації субстрату, що перевищує концен- |
Інгібування ферментів |
|
|||||||
трацію насичення. У цих випадках швидкість |
Інгібітори характеризуються, насамперед, та- |
||||||||
реакції відповідає нульовому порядку реакції |
|||||||||
кою загальною ознакою, як міцність зв’язуван- |
|||||||||
відносно субстрату й залежатиме тільки від кон- |
|||||||||
центрації ферменту. У практичній роботі з фер- |
ня з ферментом. За цією ознакою інгібітори |
||||||||
ментами користуються поняттями питомої й мо- |
діляться на дві групи: оборотні й необоротні. За- |
||||||||
лярної активності. |
рахувати інгібітори до відповідної групи дозво- |
||||||||
ляє критерій відновлення активності ферменту |
|||||||||
|
|||||||||
|
після діалізу або сильного розведення розчину |
||||||||
6.4. РЕГУЛЯЦІЯ АКТИВНОСТІ |
ферменту з інгібітором. |
|
|||||||
Оборотне інгібування: |
|
||||||||
ФЕРМЕНТІВ. ІНГІБІТОРИ. |
Е + І |
|
|
|
|
ЕІ |
Е — фермент |
||
АКТИВАТОРИ |
|
|
|
|
|||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
||
Регуляція активності ферментів може здійсню- |
Необоротне інгібування: |
||||||||
Е + І |
|
|
|
|
|
ЕІ |
І — інгібітор |
||
ватися шляхом взаємодії з ними різних біологіч- |
|
|
|||||||
|
|||||||||
них компонентів і чужорідних сполук (ліків і от- |
|
|
|
|
|
|
|
|
|
рут), які прийнято називати модифікаторами або |
Частіше відбувається оборотне інгібування, |
||||||||
регуляторами ферментів. Під дією модифікаторів |
що підлягає кількісному вивченню на основі |
||||||||
на фермент реакція може прискорюватися (у цьо- |
рівняння Міхаеліса — Ментен. Оборотне інгібу- |
||||||||
92
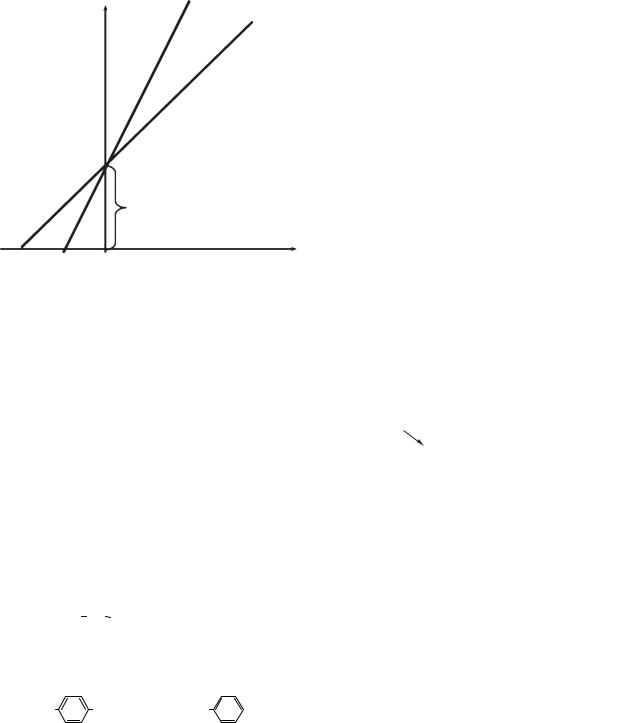
вання у свою чергу поділяють на конкурентне й неконкурентне — залежно від того, чи можливо відновити активність ферментативної реакції шляхом збільшення концентрації субстрату. Конкурентним інгібуванням називається гальмування ферментативної реакції, спричинене зв’язуванням інгібітора з активним центром ферменту, інгібітор і субстрат, будучи подібними за будовою, конкурують за активний центр ферменту. З активним центром зв’язується та сполука, молекул якої більше (рис. 6.4).
|
2 |
1/V |
1 |
-1/Km -1/Kmі |
1/[S] |
Рис. 6.4. Конкурентне інгібування ферментів: 1 — графік Лайнуївера — Берка без інгібітора;
2 — графік Лайнуївера — Берка в присутності конкурентного інгібітора
При конкурентному типі інгібування інгібітор збільшує значення Kmi, не впливаючи на макси-
мальну швидкість Vmax. Це означає, що при досить високій концентрації субстрату [S] інгібітор
витісняється молекулами субстрату з комплексу EI. Класичним прикладом подібного типу інгібування є вплив різних речовин на активність сукцинатдегідрогенази — ферменту циклу Кребса. Його природним субстратом є сукцинат, а подібним до нього конкурентним інгібітором — оксалоацетат, проміжний продукт того ж циклу Кребса.
Аналогічним конкурентним інгібітором сукцинатдегідрогенази є малонова кислота, що часто використовується в біохімічних дослідженнях.
O
-OOC |
|
СН2 СН2 СОО- |
-OOC |
|
|
|
|
|
|
СОО- |
|
|
С |
|
СН2 |
|
|||||
|
|
|
|
|||||||
Сукцинат Оксалоацетат
Метод конкурентного інгібування знайшов широке застосування в медичній практиці:
H2N |
COOH |
H2N |
|
|
SO2 |
|
NH2 |
|
|
|
|||||
n-Амінобензенова кислота |
|
Сульфаніламід |
|||||
Для лікування деяких інфекційних захворювань, викликаних бактеріями, застосовують сульфаніламідні препарати. Виявилося, що ці препарати мають структурну подібність із параамінобензойною кислотою, яку бактеріальна клітина використовує для синтезу фолієвої кислоти, що є складовою частиною ферментів бактерій. Завдяки структурній подібності сульфаніламід блокує дію ферменту шляхом витиснення параамінобензойної кислоти з комплексу з ферментом, що синтезує фолієву кислоту.
Неконкурентним інгібуванням ферменту називається гальмування, пов’язане з впливом інгібітора на каталітичне перетворення, але не на зв’язування субстрату з ферментом. Неконкурентний інгібітор може зв’язуватися безпосередньо з каталітичними групами активного центру ферменту або з ферментом поза активним центром, що заважає взаємодії з субстратом. Дія неконкурентних інгібіторів не усувається додаванням надлишку субстрату.
У присутності інгібіторів такого типу частина ферментів інактивується, швидкість реакції (зокрема максимальна швидкість) зменшується, але константа Міхаеліса залишається без змін.
Неконкурентне інгібування може бути оборотним і необоротним. При оборотному неконкурентному інгібуванні субстрат S й інгібітор I зв’я- зуються з різними центрами, тому з’являється можливість утворення як комплексу EI, так і комплексу EIS; останній може розпадатися зі звільненням продукту, але з меншою швидкістю, ніж комплекс ES (рис. 6.5).
1/V |
2 |
1 |
|
||
|
|
1/Vі
1/Vmax
-1/Km = -1/Km |
1/[S] |
і |
|
Рис. 6.5. Неконкурентне інгібування ферментів: 1 — графік Лайнуївера — Берка без інгібітора; 2 — графік Лайнуївера — Берка в присутності неконкурентного інгібітора
До неконкурентних інгібіторів належать іони важких металів (Меркурію, Плюмбуму, Кадмію, Арсену) і їхні органічні сполуки. Вони блокують, наприклад, SH-групи (цистеїну), що входять у каталітичну ділянку ферменту. Неконкурентними інгібіторами є, наприклад, ціаніди, які міцно
93
з’єднуються з Fe3+, що входить у каталітичну ділянку цитохромоксидази. Блокада цього ферменту виключає дихальний ланцюг і клітина гине. У медицині застосовують препарати, що містять Меркурій, Арсен, Бісмут, які неконкурентно інгібують ферменти в клітинах організму або бактерій.
Активні й алостеричні центри ферментів
Експериментально виявлено, що відняття шляхом обмеженого протеолізу певної частини ферментного білка не спричинює втрати каталітичної активності. Це дозволило зробити висновок, що під час ферментативної реакції вступає у контакт із субстратом не вся молекула ферменту, а лише деяка її частина — активний центр ферменту (каталітичний центр). Він являє собою ділянку молекули ферменту, де відбувається зв’язування та перетворення субстрату на відповідний продукт або продукти ферментативної реакції. Активні центри простих ферментів звичайно складаються із залишків амінокислот, що містять карбоксильні групи, аміногрупи, сульфгідрильні групи, оксигрупи й інші хімічні групи, розташовані певним чином, як і самі амінокислоти, в активному центрі ферментів. Активні центри складних ферментів утворюються з коферменту та частини апоферменту, що прилягає до нього. Залишки амінокислот, що входять до складу активних центрів, виконують певну функцію в утворенні структури активного центру ферменту і тому поділяються на 3 основні групи:
1.Каталітичні залишки амінокислот. Ці амінокислоти або їх групи атомів безпосередньо контактують із субстратом і беруть участь у його хімічних перетвореннях (розрив хімічного зв’язку, утворення нового хімічного зв’язку).
2.Контактні залишки амінокислот. Ці амінокислоти або їх групи атомів сприяють формуванню певної структури активного центру, що забезпечує його специфічну спорідненість до субстрату і формування ферментно-субстратного комплексу.
3.Допоміжні залишки амінокислот. Ці амінокислоти або їх групи атомів забезпечують стабільність третинної або четвертинної структури ферменту і тим самим — збереження біологічної (каталітичної) активності ферменту.
Функціональні групи таких амінокислот, як цистеїн, серин і гістидин, мають особливе значення для каталізу. HS-групи цистеїну необхідні для активності багатьох ферментів, що каталізують окисно-відновні реакції. Деякі галогенопохідні (азотисті іприти) блокують сульфгідрильні групи, інактивуючи фермент. Численні реакції сульфгідрильних груп із функціональними групами різноманітних речовин забезпечують їх контакт із багатьма субстратами в процесі утворення ферментсубстратних комплексів, отже, й участь у багатьох каталітичних реакціях. До активних центрів багатьох ферментів (фумаратгідратази, рибонуклеази, ацетилхолінестерази, трипсину) входить гістидин, який містить імідазольне кільце. Цей цикл може утворювати водневі зв’яз-
ки, комплекси з металами, а також ацетильні та фосфорні похідні з різноманітними речовинами. Після руйнування цього гетероциклу шляхом фотоокиснення ферменти (ацетилхолінестераза, хімотрипсин та ін.) втрачають свою активність.
До складу активного центру деяких ферментів входять метали. Метал може відігравати роль зв’язуючої ланки між апоферментом і коферментом, може зв’язуватися з субстратом, на який діє фермент, що сприяє утворенню ферментсубстратного комплексу, отже, впливає на швидкість ферментної реакції.
Окрім активного центру, який є в кожному ферменті, у молекулах багатьох ферментів існує алостеричний центр або центри (від гpeцьк. allos
— інший, stereos — пpocторовий). Алостеричні центри — місце впливу на фермент різних регуляторних факторів. Вони являють собою ділянки (одну або кілька) молекули ферменту, з якими зв’язуються певні (зазвичай низькомолекулярні) речовини, молекули яких не подібні за структурою з субстратом цього ферменту. Ці речовини названі алостеричними ефекторами (модуляторами). До них належать гормони, медіатори нервової системи, продукти ферментативних реакцій (метаболіти) та інші речовини. Приєднання ефектора до алостеричного центру веде до зміни третинної або четвертинної структури молекули ферменту і відповідно — конфігурації активного центру, викликаючи зниження або підвищення активності ферменту. Ферменти, що мають алостеричні центри, дістали назву алостеричних. До них належать ферменти, що каталізують або початкові реакції, які розпочинають великі метаболічні процеси, або реакції «вузлові», розташовані на перетині кількох шляхів. Наприклад, до алостеричних ферментів належать гексокіназа, піруватдегідрогеназа, α -кeтoглyтapaтдeгідpo- гeнaзa та ін.
Підвищення концентрації молочної кислоти, яка є кінцевим продуктом гліколізу, пригнічує активність гексокінази, що каталізує реакцію «запалу» в ланцюгу ферментативних перетворень гліколізу і тим самим загальмовує всю анаеробну фазу. Регулювальний вплив кінцевого метаболіту здійснюється за принципом зворотного зв’язку. Глюкозо-6-фосфат підвищує активність ферменту глікоген-УДФ-глікозилтранс- ферази, що бере участь у біосинтезі глікогену. Нагромадження лимонної кислоти (першого продукту циклу трикарбонових кислот) активує ацетил-КоА-карбоксилазу, що каталізує перетворення ацетил-КоА на малоніл-КоА — початкову реакцію біосинтезу вищих жирних кислот.
Регуляція ферментативних процесів
Існує чотири основних механізми регуляції каталітичної активності ферментів:
1.Алостерична регуляція активності ферментів.
2.Регуляція активності (активування та інгібування) ферменту за допомогою особливих регуляторних білків.
94
3.Регуляція активності ферментів за допомогою ковалентної модифікації.
4.Активація ферменту за допомогою часткового протеолізу.
Алостерична регуляція активності ферментів
Алостерична регуляція характерна тільки для особливої групи ферментів із четвертинною структурою, що мають регуляторні (алостеричні) центри для зв’язування алостеричних ефекторів. Приєднання алостеричних ефекторів до алостеричного центру молекули ферменту викликає зміну його конформації, що приводить до зміни структури активного центру, а через це — до пригнічення або активації функцій ферменту. Активний і регуляторний (алостеричний) центри локалізуються на різних субодиницях ферменту — каталітичній та регуляторній відповідно. Існують два фізичних стани алостеричного ферменту, які розрізняються своєю конформацією й каталітичною активністю: каталітичний стан
— R (від англ. relax — розслаблений) і інгібований стан — Т (від англ. tensed — напружений). Оборотний перехід між R- і T-станами залежить від взаємодії ферменту з алостеричними ефекторами.
Якщо регуляція дії ферменту здійснюється ефектором (гетеротропні алостеричні інгібітори й активатори), що за хімічною природою відрізняється від субстрату, особливо кінцеві продукти багатоступінчатих процесів, то у цьому випадку продукт (або продукти) метаболічного шляху (звичайно анаболічного) за механізмом негативного зворотного зв’язку інгібує перший фермент послідовності реакцій — відбувається ретроінгібування. Цей тип інгібування є одним із провідних для регуляції активності ферментів і клітинного метаболізму в цілому. Якщо фермент побудований з ідентичних протомерів, то алостерична регуляція може здійснюватися самим субстратом, приєднання субстрату до одного протомера змінює конформацію всього білкаферменту, активність інших протомерів може змінюватися (гомотропна алостерична регуляція), прикладом якої є фосфорилування глюкози гексокіназою. Перше хімічне перетворення глюкози в клітинах — фосфорилування в результаті взаємодії з АТФ. Реакцію каталізує фермент гексокіназа (у скелетних м’язах). Найважливішою властивістю гексокінази є її інгібування глюкозо-6-фосфатом, тобто останній служить одночасно продуктом реакції й алостеричним інгібітором. У печінці міститься фермент глюкокіназа, який також каталізує фосфорилування D-глюкози.
|
|
|
|
|
|
|
|
|
|
|
OH |
|
CH OH |
Гексокіназа |
|
CH2 |
|
|
O |
|
P |
|
O |
||
|
|
|
|
|
||||||||
|
|
|
|
|
||||||||
2 |
O |
|
|
O |
OH |
|||||||
|
(м’язи) |
|
|
|||||||||
|
|
OH + АТФ |
|
|
|
|
|
|
|
|
|
|
OH OH |
|
OH |
OH |
|
|
OH |
||||||
Глюкокіназа |
|
|
||||||||||
|
|
|
|
|||||||||
|
OH |
(печінка) |
|
|
OH |
|
|
|||||
D-Глюкоза Глюкозо-6-фосфат
Гексокіназа має високу спорідненість до глюкози (Km<0,1 ммоль/л), отже, максимум швидкості реакції досягається при низькій концентрації глюкози.
Глюкокіназа відрізняється від гексокінази високим значенням Km для глюкози (близько 10 ммоль/л) і не інгібується глюкозо-6-фосфатом. Якщо врахувати, що глюкокіназа майже повністю зосереджена у печінці й не інгібується високими концентраціями глюкози й глюкозо-6- фосфатом і саме до печінки портальною веною транспортується кров від тонкої кишки, де всмоктується велика кількість глюкози, то можна дійти висновку, що біологічне значення глюкокінази полягає у затримці глюкози печінкою, а у загальному кровообігу вміст глюкози не підвищується.
Дія регуляторних білків
Кальмодулін після зв’язування чотирьох іонів Ca2+ стає здатним до активації великої кількості ферментів. Важливою біологічною системою контролю за ферментативними реакціями є циклічні нуклеотиди, які регулюють активність протеїнкіназ.
Активація протеїнкіназ за допомогою цАМФ
Протеїнкіназа — тетрамер, що складається з двох каталітичних (С) і двох регуляторних (R) субодиниць. Взаємодія чотирьох молекул цАМФ із R-субодиницями (кожна має 2 центри зв’язування з цАМФ) приводить до дисоціації комплексу.
C2R2 + 4 цАМФ 
 2С + 2R цАМФ
2С + 2R цАМФ
Активовані протеїнкінази можуть фосфорилувати білки-ферменти. Оскільки цей процес оборотний, то підвищення концентрації цАМФ у клітині веде до активації протеїнкіназ, а зниження — до інгібування. Широко розповсюджені білкові інгібітори протеолітичних ферментів, функція яких — запобігання несвоєчасному руйнуванню білків у тканинах і рідинах. У плазмі крові білкові інгібітори протеїнкіназ беруть участь у регуляції згортання крові й фібринолізу.
Ковалентна модифікація ферментів
Активність багатьох ферментів регулюється фосфорилуванням. Активність ферментів у результаті фосфорилування в одних випадках зменшується, в інших — збільшується. Наприклад, у клітинах жирової тканини міститься ліпаза, що існує у двох формах — фосфопротеїну й простого білка. Ці форми можуть взаємно перетворюватися:
О
Ліпаза + АТФ  Ліпаза О Р ОН + АДФ ОН
Ліпаза О Р ОН + АДФ ОН
О
Ліпаза О Р ОН + H2O  Ліпаза + H3PO4 ОН
Ліпаза + H3PO4 ОН
95
Активація частковим протеолізом
Багато ферментів утворюються з неактивних білків (проферментів або зимогенів) у результаті відщеплення частини пептидного ланцюга:
Трипсиноген Ентерокіназа Трипсин + Гексапептид
Відбувається перебудова просторової структури й формується активний центр, тобто неактивний попередник перетворюється на фермент трипсин. Механізм активації шляхом часткового протеолізу найбільш характерний для протеолітичних ферментів (пептидогідролаз). У ході еволюції виробився механізм, який полягає в тому, що протеолітичні ферменти утворюються й зберігаються в неактивній формі проферментів і активуються в потрібний момент. Це пов’язано з тим, що білки, які є субстратами пептидогідролаз, являють собою основу структурно-функціо- нального апарату клітини, нерегульована дія пептидогідролаз могла б бути небезпечною для клітини.
У деяких випадках функціонують цілі каскади послідовних реакцій часткового протеолізу, коли активований попередній фермент у свою чергу активує наступний і т. ін. (наприклад, згортання крові відбувається в результаті каскаду реакцій активації серії ферментів, останній з яких перетворює розчинний білок плазми крові фібриноген на нерозчинний білок фібрин).
Ізоферменти
Оскільки Н-протомери мають більший негативний заряд при pН=7,0–7,9, ніж М-протомери, то ЛДГ1 мігруватиме при електрофорезі до позитивного електрода (анода) з більшою швидкістю, ніж ЛДГ5. Інші ізоферменти займатимуть проміжні позиції. За електрофореграмою ізоферментів ЛДГ можна судити як про топографію патологічного процесу, так і про ступінь ураження органа або тканини. Існування ізоферментних форм ферменту в різних тканинах визначається:
1.Розбіжностями в особливостях метаболізму
врізних органах (ЛДГ: у серцевому м’язі — 35– 38 АТФ; у скелетному м’язі — 2 АТФ). Ізоферменти значно розрізняються за Vmax і Km.
ЛДГ5 активується піруватом у скелетному м’язі
CH3 |
Лактатдегідрогеназа |
CH3 |
Скелетний м’яз |
Є ферменти, молекули яких складаються з |
|
|
|
|
цитозоль |
|||||
|
|
|
|
|
||||||
двох і більше субодиниць, що мають однакову |
3. Диференціація й розвиток тканин доросло- |
|||||||||
(або різну) первинну, вторинну й третинну |
||||||||||
го організму з ембріональних форм цих тканин. |
||||||||||
структуру. Окремі субодиниці іноді називають |
||||||||||
протомерами, а об’єднану молекулу — мульти- |
ЛДГ ембріона |
|
|
ЛДГ дорослого |
||||||
мером. У мультимері зв’язки між протомерами зде- |
|
|
||||||||
|
|
|||||||||
|
|
зміни |
||||||||
більшого не ковалентні, тому такі ферменти до- |
|
|
||||||||
Пухлина |
|
|
|
ЛДГ як у ембріона |
||||||
сить легко дисоціюють на протомери. Якщо ге- |
|
|
|
|||||||
|
|
|
|
|
||||||
нетично різні субодиниці можуть існувати більш |
4. Тонке регулювання швидкостей метаболіч- |
|||||||||
ніж в одній формі, то, відповідно, й фермент, ут- |
||||||||||
них реакцій за рахунок різної чутливості ізофер- |
||||||||||
ворений із двох або кількох типів субодиниць, |
ментів до алостеричних регуляторів. |
|||||||||
що сполучаються в різних кількісних пропорці- |
|
|
|
|
|
|||||
ях, може існувати у вигляді кількох форм. Ці |
|
|
|
|
|
|||||
різновиди ферменту дістали назву ізоферментів |
Мультиферментні системи |
|||||||||
(ізозимів, ізоензимів). Так, якщо фермент лактат- |
||||||||||
|
|
|
|
|
||||||
дегідрогеназа складається з чотирьох субоди- |
Багато ферментних білків складаються з кіль- |
|||||||||
ниць двох різних типів, наприклад Н і М, актив- |
кох субодиниць (протомерів), об’єднаних неко- |
|||||||||
ний фермент може являти собою одну з наступ- |
валентними зв’язками, — мультиферментні сис- |
|||||||||
них комбінацій: Н4, Н3М, Н2М2, НМ3, М4, тобто |
теми (комплекси). |
|
|
|
||||||
має п’ять ізоферментів лактатдегідрогенази. |
Найпоширенішими є мультиферментні систе- |
|||||||||
|
|
|
|
|
ми, що складаються з двох, чотирьох або шести |
|||||
|
Н-субодиниця (heart — серце) |
|
протомерів. Існують ферменти, які складаються з |
|||||||
|
|
різних за будовою й біохімічними функціями суб- |
||||||||
|
|
|
|
|
||||||
|
М-субодиниця (muscle — м’яз) |
|
одиниць (так, фермент аспартаткарбомоїлтранс- |
|||||||
|
|
фераза складається з шести каталітичних і шес- |
||||||||
|
|
|
|
|
||||||
|
|
|
|
|
ти регуляторних субодиниць — C6R6). |
|||||
|
|
|
|
|
Поліферментні (мультиферментні) системи ста- |
|||||
|
|
|
|
|
новлять групу ферментів, до складу яких входять |
|||||
|
|
|
|
|
різні ферменти, що каталізують послідовні етапи |
|||||
ЛДГ1 |
ЛДГ2 |
ЛДГ3 |
ЛДГ4 |
ЛДГ5 |
перетворення будь-якого субстрату. |
|||||
96
Існують розчинні поліферментні системи (фер- |
залози різко зростає рівень ліпази, α -амілази, |
|
ментні ансамблі), де кожна реакція каталізуєть- |
трипсину, хімотрипсину. При інфаркті міокарда |
|
ся певними не асоційованими ферментами. Спо- |
в сироватці крові підвищується рівень аміно- |
|
лучною ланкою тут служать метаболіти (при- |
трансфераз, креатинкінази й лактатдегідрогена- |
|
клад такої організації — ферменти гліколізу). |
зи. |
|
Поліферментні системи — комплекси, в яких |
Третій напрямок медичної ензимології — ензи- |
|
окремі ферменти з’єднані між собою нековалент- |
мотерапія, тобто використання дії ферментів і мо- |
|
ними зв’язками й розташовані в певному поряд- |
дуляторів (активаторів та інгібіторів) як лікарсь- |
|
ку (типові приклади: піруватдегідрогеназний |
ких засобів. Важливе місце у фармакотерапії по- |
|
комплекс; α -кетоглутаратдегідрогеназний комп- |
сідає лікування протеолітичними ферментами. |
|
лекс; синтаза вищих жирних кислот). |
Передумовою терапевтичного застосування про- |
|
|
теаз є та обставина, що вони не ушкоджують |
|
Внутрішньоклітинна локалізація |
живу тканину. Імовірно, що після відмирання |
|
ферментів |
клітин білки піддаються характерним структур- |
|
За допомогою методу диференційного центри- |
ним змінам, які роблять їх уразливими для про- |
|
теолітичних ферментів. Отримано ряд препаратів |
||
фугування виявлена внутрішньоклітинна лока- |
протеолітичної дії (трипсин, хімотрипсин, хімо- |
|
лізація ферментів. |
псин та ін.), спеціальні фібринолітичні препара- |
|
У ядрі клітини зосереджені ферменти, що ката- |
||
ти (фібринолізин, стрептокіназа); препарати, що |
||
лізують обмін нуклеїнових кислот (ДНК-поліме- |
деполімеризують рибонуклеїнову й дезоксирибо- |
|
раза, РНК-полімераза, хеліказа, праймаза, |
нуклеїнову кислоти (рибонуклеаза, дезоксирибо- |
|
ДНК-лігаза). |
нуклеаза); препарати, що зменшують в’язкість |
|
У мітохондріях містяться ферменти ЦТК, ка- |
||
гіалуронової кислоти (лідаза, ронідаза) і деякі |
||
таболізму амінокислот, β -окиснення жирних кис- |
інші ферментні препарати. Їх почали широко за- |
|
лот, окисного декарбоксилювання пірувату, тка- |
стосовувати при лікуванні захворювань, що су- |
|
нинного дихання. |
проводжуються гнійно-некротичними процесами, |
|
У лізосомах локалізовані ферменти, що ката- |
||
при тромбозах і тромбоемболіях, порушеннях |
||
лізують гідролітичне розщеплення різних орга- |
процесів травлення. |
|
нічних речовин: протеїнази (катепсини), естера- |
Замісна ензимотерапія — це лікування фер- |
|
зи, нуклеази, кислі фосфатази, β -глюкуронідаза. |
||
ментними препаратами у разі їхньої недостат- |
||
У гіалоплазмі (цитоплазмі) знаходяться фер- |
ності в організмі. Такі ферменти, як пепсин, три- |
|
менти пентозофосфатного шляху, анаеробного |
псин, хімотрипсин, амілаза, ліпаза використову- |
|
гліколізу, синтезу жирних кислот. |
ються у вільному стані й у складі лікарських |
|
|
||
|
форм, які знайшли широке застосування при |
|
|
лікуванні шлунково-кишкових захворювань. |
|
6.5. МЕДИЧНА ЕНЗИМОЛОГІЯ |
Пепсин — найстаріший ферментний препа- |
|
|
рат, використовується у комбінації з соляною |
|
Медична ензимологія розвивається за трьома |
кислотою при ахілії. Широке застосування зна- |
|
головними напрямками: ензимопатологія; ензи- |
ходить трипсин — його використовують у меди- |
|
модіагностика; ензимотерапія. |
цині, на відміну від пепсину, не стільки з метою |
|
Мета ензимопатології — дослідження фермен- |
замісної терапії, скільки для розщеплення й швид- |
|
тативної активності в нормі й при патології. Ба- |
кого видалення з організму патологічно змінених |
|
гато спадкових вад обміну є результатом дефек- |
тканин і білків. При некрозах і нагноєннях різно- |
|
ту певного ферменту. Галактоземія — спадкове |
го походження трипсин розщеплює білки мертвої, |
|
захворювання, що розвивається в результаті |
тобто патологічно зміненої, тканини, сприяє |
|
спадкового дефекту синтезу галактозо-1-фос- |
швидкому очищенню ран. Лікування трипсином |
|
фатуридилтрансферази — ферменту, що каталі- |
має значення також при емпіємах і гемотораксі. |
|
зує перетворення галактози на глюкозу, яка лег- |
При емпіємах після промивання порожнини плев- |
|
ко піддається перетворенням. При галактоземії в |
ри вливають розчин трипсину в комбінації з ан- |
|
крові спостерігається висока концентрація галак- |
тибіотиками. При гемотораксі вводять розчин |
|
този, що веде до катаракти й розумової відста- |
трипсину, що лізує фібрин. Застосування препа- |
|
лості у дітей. |
рату хімотрипсину в медичній практиці базуєть- |
|
Ензимодіагностика розвивається по шляху |
ся на специфічній особливості розщеплювати не- |
|
використання ферментів для відкриття й кіль- |
кротизовані тканини й фіброзні утворення, роз- |
|
кісного визначення нормальних або аномальних |
ріджувати в’язкі секрети. Препарат хімопсин — |
|
хімічних речовин у сироватці крові, сечі, шлун- |
це суміш хімотрипсину й трипсину, він менш очи- |
|
ковому соку (наприклад, відкриття за допомогою |
щений, тому застосовується тільки для місцево- |
|
ферментів у сечі глюкози, білка або інших речо- |
го застосування (гнійні ранові поверхні) й для |
|
вин). Деякі ферменти з’являються в сироватці |
інгаляцій. У медичній практиці використовують |
|
крові при розпаді клітин (некротичні ферменти). |
препарати, які містять основні компоненти |
|
Вони використовуються для діагностики орга- |
підшлункової залози й жовчі — наприклад, фес- |
|
нічних і функціональних уражень органів і тка- |
тал (містить ліпазу, амілазу, протеази, компонен- |
|
нин. При діабеті, інфекційних, запальних захво- |
ти жовчі), панзинорм (містить екстракт слизової |
|
рюваннях і злоякісних пухлинах підшлункової |
оболонки шлунка, екстракт жовчі, панкреатин, |
97
амінокислоти), панкреатин, дигестал, мезим-фор- те.
Ферментні препарати почали застосовувати при лікуванні онкологічних захворювань. Аспарагіназа має антилейкемічну активність, ефективна при лікуванні гострих і хронічних форм лейкозів і лімфогранулематозів. Аспарагіназа порушує метаболізм амінокислоти аспарагіну, необхідної лейкозним клітинам для їхнього розвитку, оскільки пухлинні клітини не здатні синтезувати аміди амінокислот. Дефіцит аспарагіну, у першу чергу, впливає на клітинні мембрани. Лікувальний ефект аспарагінази пояснюється необоротним розпадом аспарагіну.
Лікарські препарати з антиферментною активністю
Розширюється коло лікарських засобів, дія яких пов’язана з інактивацією ферментів — це інгібітори протеолітичних ферментів, широко застосовуваних при лікуванні гострих панкреатитів. Інгібітор трипсину дуже міцно зв’язується з активним центром трипсину, причина утворення такого комплексу в тому, що панкреатичний інгібітор — дуже ефективний аналог субстрату. Як антигеморагічний засіб застосовується амінокапронова кислота, що є інгібітором фібринолізину. До інгібіторів ферментів належить велика група антихолінестеразних препаратів (прозерин, фізостигмін), інгібітори моноамінооксидази (ніаламід), використовувані як психотропні засоби, інгібітори карбоангідрази — як діуретичні засоби (діакарб). Ефективність алопуринолу при гіперурикемії пов’язана з інгібуванням ферменту ксантиноксидази. Застосування тетураму для лікування алкоголізму пов’язане з пригніченням ферменту ацетальдегідоксидази. Природні інгібітори протеїназ (α 1-антитрипсин, α 1-антихімо- трипсин, α 2-макроглобулін) використовують у терапії гострих панкреатитів, артритів, алергійних захворювань, при яких відзначається активація протеолізу й фібринолізу. α 1-Антитрипсин (або α 1-антипротеїназа) — білок плазми крові, що захищає тканини від розщеплення еластазою, яка секретується нейтрофілами. Антиеластаза — більш точна назва цього ферменту, тому що він блокує еластазу, зв’язуючись майже необоротно з її активним центром. Генетичні захворювання призводять до порушення структури цього ферменту (заміщення лізину на глутамат у 8-му положенні). Наслідком цього є надлишкове руйнування стінок альвеол легень (руйнування еластичних фібрил й інших білків сполучної тканини), а клінічним проявом — емфізема легень (або деструктивна хвороба легень). Сигаретний дим помітно збільшує ймовірність розвитку емфіземи, оскільки речовини сигаретного диму окиснюють метіонін — інгібітор еластази. Використання ферментів як лікарських засобів завжди здавалося привабливим. Однак їхні властивості: нестабільність, небажані антигенні властивості, пов’язані з білковою природою ферменту (небезпека розвитку алергійної реакції); труднощі до-
ставки до уражених органів і тканин — істотно обмежували можливість їхнього використання. Розробляються методи спрямованого транспорту ферментів, укладених у мікроконтейнери, до зовнішньої поверхні яких можуть бути прикріплені адресні білкові молекули (наприклад, імуноглобуліни — антитіла проти специфічних компонентів органа або тканини-мішені, пухлини).
Іммобілізовані ферменти
Нові перспективи успішного застосування ферментних препаратів відкриває розробка нових лікарських форм — так званих іммобілізованих ферментів. Іммобілізовані, або нерозчинні, ферменти — це штучно отриманий комплекс ферментів із нерозчинним у воді носієм. Іммобілізація (від лат. immobilis — нерухливий) здійснюється шляхом фізичної адсорбції на нерозчинному матеріалі; включенням ферменту в комірки гелю; ковалентним зв’язуванням ферменту з нерозчинним матеріалом або молекул ферменту між собою з утворенням нерозчинних поліферментних комплексів. При одержанні іммобілізованих ферментів уживають усіх запобіжних заходів для збереження активності ферменту.
Іммобілізовані ферменти звичайно менш активні, ніж висхідні, оскільки зв’язування з носієм ослабляє їхній контакт із субстратом. Протеолітичні ферменти (трипсин, хімотрипсин), іммобілізовані на марлевих серветках, тампонах, застосовують у хірургічній практиці для очищення гнійних ран, змертвілих тканин, що грунтується на ферментативному гідролізі білків загиблих клітин у гнійних ранах. Іммобілізовані ферменти стають одними з найпоширеніших ліків біологічного походження. Так, стрептодеказа — це препарат стрептокінази, що належить до «іммобілізованих» ферментів, має пролонговану фібринолітичну дію.
КОНТРОЛЬНІ ПИТАННЯ
1.Ферменти: визначення; властивості ферментів як біологічних каталізаторів.
2.Класифікація і номенклатура ферментів, характеристика окремих класів ферментів.
3.Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центри.
4.Кофактори і коферменти. Будова та властивості коферментів, вітаміни як попередники у біосинтезі коферментів.
5.Коферменти: типи реакцій, які каталізують окремі класи коферментів.
6.Ізоферменти, особливості будови та функціонування, значення в діагностиці захворювань.
7.Механізми дії та кінетика ферментативних реакцій: залежність швидкості реакції від концентрації субстрату, рН, температури.
8.Активатори й інгібітори ферментів: приклади і механізми дії.
98
