
Біологічна та біоорганічна хімія_Мардашко О.О._ изд. 2008-342 с._ОНМедУ-2012
.pdf
замін зв’язується з аспарагіном за рахунок гідроксильної групи Гідрогену й водню аміногрупи амінокислоти.
Друга структурна відмінність гліколіпідів від глікопротеїнів — кожна молекула гліколіпіду має лише один вуглеводний ланцюг, тоді як у глікопротеїнів таких ланцюгів може бути кілька. Ці ланцюги бувають різної довжини, однак є одне важливе обмеження: кожна молекула глікопротеїну завжди містить ланцюги тільки одного типу, тобто з однаковою моносахаридною послідовністю.
Вуглеводи зв’язуються із зовнішніми ділянками молекул мембранних білків і ліпідів, утворю-
ючи глікопротеїни і гліколіпіди. Вуглеводний шар, що утворюється на зовнішній поверхні мембрани, дістав назву глікокалікс. Він заряджений негативно, виконує кілька важливих функцій: зв’язує позаклітинний кальцій, стабілізує мембранні структури, служить матриксом для прикріплення інших клітин.
Гліколіпіди мембран є, головним чином, похідними сфінгозину (глікоцераміди, гангліозиди).
Глікопротеїни мембран утворюються за рахунок ковалентних зв’язків із білками мембран: гідроксильних груп серину та треоніну (О-гліко- зидні зв’язки) і амідної групи аспарагіну (N- глікозидні зв’язки).
Олігосахаридні залишки гліколіпідів і глікопротеїнів виконують функції лігандів для зовнішніх білків, тобто забезпечують процес розпізнавання і міжклітинної взаємодії, а також особливо важливі в реакціях клітинного імунітету.
Аномальні зміни структури поверхневих гангліозидів у мембранах пухлинних клітин призводять до втрати характерного для росту нормальних клітинних пластів феномена «контактного інгібування», що спричинює неконтрольований ріст.
Моделі мембран
Ліпіди здатні взаємодіяти з білками своїми полярними групами — у цьому випадку їхні молекули зв’язуються між собою силами електростатичного притягання зарядів. Було встановлено, що коли ліпіди розташовуються у воді суцільним бімолекулярним шаром, то білки могли б розташуватися на верхній і нижній поверхні цього шару. Утворюється щось подібне до бутерброда: зверху й знизу — два шари білка, а всередині ліпіди, на зразок масла. У такій примітивній формі «бутербродна» модель мембран запропонована американськими дослідниками Даніелі й Доусоном (1931) (рис. 5.2).
Згодом, з надходженням нових даних, її поступово вдосконалювали і змінювали. З’явилися факти, які суперечили «бутербродній» моделі та уявленням про її універсальність. Насамперед, якщо всі мембрани побудовані за єдиним принципом, то вони повинні містити однакову кількість ліпідів і білків. Виявилося, що мієлінова мембрана містить в 2,5 рази більше ліпідів, ніж білка, тоді як у мембрані еритроцитів співвідношення
1 |
3 |
|
2
а |
1 |
б |
Рис. 5.2. Моделі біомембрани:
а— за Даніелі — Доусоном;
б— за Стейном — Даніелі Позначення: 1 — білкові шари; 2 — ліпідний бішар;
3 — мембранні пори.
зворотне, а в мембранах деяких бактерій вміст білка в 5–6 разів перевищує кількість ліпідів.
«Бутербродна» модель виявилася також неспроможною пояснити той факт, що природні мембрани не розщеплюються на білки й ліпіди при додаванні в середовище неорганічних солей. У присутності солей слабшає електростатична взаємодія між білками й ліпідами, на якій грунтується ця модель. Штучно виготовлені моделі, в яких ліпіди й білки зв’язані електростатичними силами, у розчинах солей розпадаються, а природні мембрани чомусь виявляються стійкими.
З’явилася нова модель мембрани — мозаїчна, відповідно до якої мембрана складається з білків, простір між якими заповнено ліпідними молекулами, тобто мембрана — це ліпідне море, в якому плавають білкові айсберги. Подальші детальні електронно-мікроскопічні дослідження підтвердили мозаїчну модель мембрани (рис. 5.3).
Відповідно до цієї моделі, присутні в мембрані білки розділяють на два типи:
1. Периферійні білки — це білки, прикріплені до зовнішньої поверхні мембрани електростатич-
1
2
Рис. 5.3. Рідинно-мозаїчна модель біомембрани за Сингером — Нікольсоном
Позначення: 1 — периферичні білки; 2 — інтегральні білки.
79
ними силами: а) сумарний позитивний заряд |
них важливе значення мають гази — кисень, вуг- |
білка й негативно заряджені голівки мембранних |
лекислий газ. Деякі невеликі полярні молекули |
ліпідів; б) більшість периферійних білків мають |
(Н2О, NH3, гліцерол, сечовина, етанол, наркоти- |
негативний сумарний заряд, тому пов’язані з го- |
ки) також здатні проникати крізь ліпідний бішар |
лівками не безпосередньо, а через катіони Са2+ і |
через міжмолекулярні пори. |
Мg2+. |
Розчинність багатьох речовин у жирах зале- |
2. Інтегральні білки — це білкові глобули, що |
жить від рН середовища. Багато молекул можуть |
плавають у «ліпідному морі» подібно до айс- |
існувати в протонованій формі (речовина + Н+) |
бергів, так що одна частина глобули занурена |
або в непротонованій формі. Непротонована мо- |
в мембрану, а друга — у водне середовище. Час- |
лекула проходить крізь мембрану легше, ніж про- |
тина білкових глобул («айсбергів») не вільно |
тонована. Однією з основних функцій мембран |
плаває у ліпідному морі, а зв’язана з цитоплаз- |
є регуляція надходження й виходу різних речо- |
матичними структурами клітини — мікротрубоч- |
вин у клітину та з клітини. Одні речовини вільно |
ками й мікрофіламентами. Деякі з інтегральних |
проходять через мембрану, а для інших вона не- |
білків другого типу пронизують мембрану |
проникна. Розрізняють такі шляхи транспорту |
наскрізь. Одна полярна ділянка пронизуючих |
речовин через мембрану: а) пасивний транспорт |
білків найчастіше несе вуглеводні ланцюги, ви- |
(проста та полегшена дифузія); б) активний |
ходить у зовнішній простір, а друга — у цито- |
транспорт. |
плазму. Між ними існує неполярна ділянка, що |
Гідрофільні речовини і великі полярні молеку- |
пронизує ліпідний бішар. Уявлення про мембра- |
ли, які не розчиняються в ліпідах, відштовхують- |
ну у вигляді мозаїчної моделі досить спрощене й |
ся ліпідною серцевиною мембрани. Щоб пройти |
схематичне. По-перше, у «ліпідному морі» у ба- |
крізь плазматичну мембрану, вони повинні взає- |
гатьох випадках більше «айсбергів», ніж «води». |
модіяти зі спеціальними білками-носіями або |
По-друге, не всі ліпіди, що входять до складу |
білком трансмембранного каналу (рис. 5.4). |
мембран, розташовані за принципом бішару. |
|
Мембранний транспорт
Незаряджені ліпофільні (жиророзчинні) речовини можуть безпосередньо проникати крізь ліпідну серцевину плазматичних мембран. Серед
Пасивний транспорт
Якщо мембрана клітини проникна для розчинної речовини, то ця речовина вільно переміщається з більш концентрованого розчину в менш концентрований, такий шлях транспорту
МЕМБРАННИЙ ТРАНСПОРТ
Пасивний транспорт — |
|
Полегшена дифузія — переміщення речовин |
|
переміщення речовин згідно з законом дифузії |
|
за градієнтом концентрації |
|
за градієнтом концентрації |
|
за участю мембранних переносників |
|
|
|
|
|
|
|
|
|
Нерухомі переносники формують канали Рухомі переносники (мала та велика каруселі) і забезпечують перенесення речовин,
і забезпечують перенесення речовин,
змінюючи свою конформацію
Активний транспорт — перенесення речовин проти градієнта концентрації
Первинний активний транспорт відбувається за рахунок енергії макроергів
Збіг напрямку переміщення двох речовин — симпорт (Na+ і глюкоза)
Вторинний активний транспорт відбувається за рахунок первинного активного транспорту однієї речовини, який створює умови
для транспорту іншої речовини
Протилежно спрямоване переміщення — антипорт (Na+-К+-насос)
Рис. 5.4. Мембранний транспорт
80
речовин через мембрани називають пасивним транспортом.
Якщо речовина добре розчинна в жирах, то вона переміщається через будь-яку ділянку мембрани за звичайними законами дифузії, тобто відбувається процес простої дифузії. Транспорт через мембрану води й невеликих, незаряджених молекул (не розчинних у жирах) здійснюється через тимчасові порожнечі (діри) у мембрані. Вони утворюються внаслідок того, що вуглеводневі ланцюги ліпідів постійно звиваються, у мембрані утворюються тимчасові порожнини, по яких і проходять молекули. Більші молекули, що дифундують, у тому числі й такі, що несуть електричні заряди, проходять крізь мембрану по спеціальних каналах (порах), стінки яких вистелені білками. Проста (звичайна) дифузія розчиненої речовини, яка не має заряду, прямо пропорційна градієнту його концентрації; його коефіцієнту дифузії; площі мембрани; зворотно пропорційна товщині мембрани.
Сторонні речовини можуть проходити крізь мембрани шляхом пасивного транспорту всередину клітини, якщо вони ліпофільні.
Полегшена дифузія (уніпорт) відрізняється від звичайної тільки тим, що відбувається з рухливим переносником, який полегшує проходження речовини за градієнтом концентрації. Так транспортуються великі полярні молекули. Вони транспортуються білками-переносниками, а заряджені іони — білками трансмембранних ка-
налів. Транспорт шляхом полегшеної дифузії використовується для перенесення органічних кислот, моносахаридів, жиророзчинних вітамінів, стероїдних гормонів. У випадку полегшеної дифузії транспорт речовин через мембрану також відбувається за градієнтом концентрації, тобто відбувається процес дифузії, вирівнювання концентрації речовин по різні боки мембрани. Однак при полегшеній дифузії транспорту речовин за градієнтом концентрації «допомагають» спеціальні мембранні переносники. З їхньою допомогою дифузія речовин відбувається значно швидше, тобто швидкість дифузії зростає. Транспорт речовин за допомогою переносників відрізняється від простої дифузії не тільки більшою швидкістю, але й тим, що ця швидкість залежить не тільки від градієнта концентрації, але й від потужності переносника. Крім цього, транспорт речовин за участю переносника можна сповільнити за допомогою інгібітора. При цьому інгібітор займає місце на переноснику, але сам через мембрану не проходить. Ще одна особливість полегшеної дифузії — переносники молекул й іонів мають специфічність (вибірковість), тобто переносять не всі молекули й іони, а тільки певні, наприклад, якийсь один моносахарид (глюкозу, галактозу), якусь одну амінокислоту і т. ін. За принципом дії мембранні переносники поділяються на два типи: рухливі переносники і нерухливі.
Рухливі переносники діють за типом порома. Приєднавши до себе молекули, вони переміщуються разом із ними крізь мембрани й повертаються назад або порожніми, або захоплюють молекули інших сполук.
Рухливі переносники можуть бути двох видів: а) працюючі за принципом «малої каруселі»; б) працюючі за принципом «великої каруселі».
Якщо переносник погано розчинний у воді, то він реагує з молекулами, які переносить, й іонами на поверхні мембрани, тобто працює за принципом «малої каруселі». Інші переносники добре розчинні у воді, тому виходять на «полювання» з мембрани, захоплюють потрібну молекулу або іон, переміщуються разом через мембрану, виводять її на протилежну сторону й там відпускають приєднану речовину, тобто працюють за принципом «великої каруселі».
Рухливі переносники можуть робити під час переносу обертові рухи (обертовий переносник) або поступальні (рухливий переносник).
Нерухливі переносники не здійснюють човникових рухів, а вбудовуються в мембрану, утворюючи фіксований канал. Ці переносники, як правило, є білками. Такі транспортні білки забезпечують перенос, змінюючи свою конформацію, тобто стінки каналів можуть розширюватися й скорочуватися, внаслідок чого в мембрані відкриваються канали. Відомо, що транспортні білки переносять такі гідрофільні речовини, як моносахариди, амінокислоти, іони Nа+, К+ і Са2+.
Переносники можуть бути змішаного типу: 1) обертовий переносник разом із фіксованим — при цьому обертовий переносник транспортує молекули до каналу, а далі вони переносяться по каналу; 2) рухливий переносник разом із фіксованим — працює як і попередній, тільки не обертається.
1. Більшість іонних каналів відіграє роль селективого (вибіркового) фільтра, який вибірково перепускає іони тільки одного типу. Так, натрієві канали перепускають в основному іони натрію, а калієві канали — іони калію, але не перепускають інші види іонів.
Чим іонний канал відрізняється від пори? Мембранні пори — це щілини між молекулами ліпідів, які забезпечують просту дифузію в мембрані. Іонні канали — це отвори з воротами, які можуть знаходитись у відчиненому або зачиненому стані й регулювати швидкість надходження іонів крізь мембрану. Іони можуть надходити крізь канал, тільки якщо він відчинений.
Які три основних конформаційних стани іонного каналу? Стан спокою — канал зачинений, але готовий до відкриття у відповідь на хімічний або електричний імпульс. Стан активації — канал відчинений і забезпечує надходження іонів. Стан інактивації — канал зачинений і нездатний до активації. Стан інактивації розвивається одразу після успішної активації (відкриття) каналу у відповідь на хімічний або електричний імпульс.
Лігандзалежні іонні канали хімічно регулюються і тісно пов’язані з мембранним рецептором. Зв’язування хімічного посередника з даним рецептором спричинює конформаційні зміни в каналі, які викликають його відчинення. Лігандзалежні канали часто бувають неселективними іонними каналами, які у відкритому стані перепус-
81
кають більше одного типу однаково заряджених іонів. Наприклад, зв’язування ацетилхоліну з рецептором на мембрані скелетного м’яза активує лігандзалежний іонний канал, який при фізіологічних умовах мембранного потенціалу переносить іони натрію всередину клітини й іони калію
—з клітини.
Потенціалзалежні іонні канали відчиняються
при зміні мембранного потенціалу. Зміни електричного поля, яке оточує іонний канал, спричинюють зміщення позитивно заряджених амінокислотних залишків α -субодиниці, що утворюють стінки каналу, і переводить канал у відкритий стан. Ряд селективних іонних каналів, які забезпечують клітинну збудливість (наприклад, Na+-, K+-, Ca2+-канали), належать до потенціалзалежних.
2. На відміну від іонних каналів, транспортні білки вибірково зв’язуються молекулами субстрату і за рахунок конформаційних змін переносять їх крізь мембрану. Цим транспортні білки (білкипереносники, пермеази) схожі на ферменти. Різниця полягає в тому, що вони «каталізують» направлений транспорт, а не ферментативну реакцію. Білки-транспортери виявляють специфічність (іноді групову) до субстратів, які підлягають переносу.
Активний транспорт
Активний транспорт є ферментативним процесом. Він здійснюється спеціальними транспортними системами, здатними використовувати хімічну енергію АТФ або енергію електрохімічного потенціалу для транспортування речовин. Залежно від виду використаної енергії активний транспорт може бути первинним і вторинним. Первинний активний транспорт відбувається за рахунок енергії, яка утворюється безпосередньо при гідролізі АТФ або деяких інших макроергічних фосфатів; вторинний активний транспорт — за рахунок енергії, яка утворюється за допомогою первинного активного транспорту внаслідок неоднакових концентрацій іонів по обидві сторони мембрани. При вторинному активному транспорті одна речовина (А) створює умови для проходження іншої речовини (В). Причому напрямок переміщення крізь мембрану двох речовин або співпадає, або не співпадає.
Якщо речовина транспортується в одному напрямку (наприклад, Na+ і глюкоза), то такий спільний транспорт має назву симпорт (котранспорт). Якщо речовини перетинають мембрану в протилежних напрямках, то такий транспорт має назву антипорт (зустрічний транспорт). При цьому транспорт речовин через мембрану відбувається проти градієнта концентрації (від розчину з меншою концентрацією даної речовини —
урозчин із більшою концентрацією), тобто мембрана діє подібно до насосу. Це енергозалежний процес, для його здійснення використовується, головним чином, енергія АТФ. Наприклад, звичайно концентрація білка й інших макромолекул
уклітині вища, ніж у навколишньому середовищі. На відміну від води, ці макромолекули не
проходять вільно через мембрану, тому вода за законами осмосу входить у клітину, збільшуючи цим внутрішній тиск, — клітина починає набухати. Щоб протистояти надходженню води, клітини запускають біологічний насос, що викачує назовні іони натрію. У результаті цього внутрішня ділянка клітини здобуває негативний заряд щодо оточуючого її середовища. Одночасно насос накачує іони калію з оточуючого середовища у внутрішнє середовище клітини. У результаті концентрація іонів натрію стає вищою поза клітиною, а калію — всередині клітини. Так працює калій-натрієвий насос — це натрій-калій залежна АТФаза. Цей фермент звичайно розташований у мембранах і активується при підвищенні концентрації Nа+ усередині клітини або К+
— у зовнішньому середовищі. На переміщення трьох іонів Nа+ і двох іонів К+ витрачається енергія однієї молекули АТФ. На транспорт двох іонів Са2+ через мембрану також використовується одна молекула АТФ.
У клітинах спостерігається процес, коли градієнт концентрації однієї сполуки використовується для транспорту іншої, що дістало назву
вторинно-активного транспорту. Наприклад,
під час функціонування Na+/K+-АТФази і переміщення іонів Nа+ і К+ відбувається надходження до клітин глюкози, амінокислот і виведення з клітин кінцевих продуктів обміну.
Основні процеси, за допомогою яких речовини проходять через клітинні мембрани
Первинний активний транспорт
Шляхом первинного активного транспорту переносяться іони Натрію, Кальцію і Магнію через клітинну мембрану, а протони — через мітохондріальну мембрану. Транспортними системами служать спеціальні АТФази, які гідролізують АТФ до АДФ і неорганічного фосфату й використовують енергію фосфатних зв’язків на перенесення іонів крізь мембрану. Для кожного з іонів існує своя специфічна АТФаза.
Na+ , K+-АТФаза присутня у всіх клітинах організмів рослинного і тваринного походження, у бактеріях. В організмі людини найвища активність її в нервовій тканині, нирках і секреторних органах, тобто там, де найбільше виражені процеси активного транспорту речовин. Na+, K+-АТФаза локалізована переважно у клітинній мембрані.
Na+, K+-АТФаза (насос)
Складається з двох α -субодиниць, які утворюють основний транспортний білок, і двох
β-субодиниць. Більші α -субодиниці містять ділянку зв’язування кардіотонічних стероїдних інгібіторів і ділянку зв’язування АТФ. Менші
β-субодиниці містять вуглеводні групи, у плазматичній мембрані вони розташовані ближче до її зовнішньої сторони (як і більшість глікопро-
теїнів мембран) і просторово розділені двома α -субодиницями (рис. 5.5).
Натрієвий насос працює в такий спосіб. На внутрішній стороні плазматичної мембрани роз-
82

Ділянки зв’язування стероїдного інгібітора
Залишки цукру
β
αα
Поверхня мембрани, звернена до цитозолю
Ділянки зв’язування АТР
Рис. 5.5. Схематичне зображення субодиничної структури і розташування в мембрані Na+, K+-насоса
ташовані центри Nа+, К+-АТФази, що вибірково приєднують три іони Натрію. Зв’язування натрію ініціює фосфорилування Nа+, К+-АТФа- зи (фосфат від АТФ як донора приєднується складноефірним зв’язком до вільної карбоксильної групи залишку аспарагінової кислоти). У результаті фосфорилування утворюється фосфорильована форма ферменту — Nа+-Е~P. Після цього відбуваються конформаційні зміни Nа+, К+- АТФази, у ході яких центри зв’язування ферменту разом з іонами Натрію виявляються на зовнішній стороні плазматичної мембрани, де відбувається вивільнення іонів Натрію. На конформаційні зміни і вивільнення іонів Натрію витрачається енергія макроергічного зв’язку Nа+-Е~Р. Е-Р зв’язує два іони Калію із зовнішнього середовища й утворює комплекс К+-Е-Р. Приєднання К+ до Е-Р стимулює К+-Е-Р, що приводить до дефосфорилування і конформаційних змін К+-Е. Конформаційні зміни поєднані з переміщенням двох іонів Калію із зовнішньої поверхні мембрани на внутрішню, де відбувається вивільнення іонів Калію. Цим закінчується цикл роботи натрієвого насоса: зв’язування Nа+ — фосфорилування — зміна конформації — вивільнення Nа+
— зв’язування К+ — дефосфорилування — зміна конформації — вивільнення К+. Під дією Na+, K+- АТФази іони Натрію постійно виходять із клітини, а іони Калію надходять із позаклітинного середовища всередину клітини, тобто спостерігається антипорт цих іонів. Серед регуляторів Na+, K+-АТФази існують інгібітори й активатори. Її природним регулятором є іони Кальцію. Позаклітинні іони Кальцію активують зв’язування зовнішнього калію специфічною ділянкою ферменту і включають роботу Na+, K+-АТФази з транспорту іонів. Надлишок внутрішньоклітинного кальцію блокує Na+, K+-АТФазу, і
тільки усунення високих концентрацій внутрішньоклітинного кальцію іншими системами дозволяє включити Na+, K+-насос. Класичними інгібіторами ферменту є серцеві глікозиди, широко використовувані в медичній практиці як стимулятори серцевих скорочень. Глікозиди інгібують Na+, K+-АТФазу, зв’язуючись із ділянками ферменту, оберненими на зовнішню сторону клітинної мембрани, тобто конкурують за місце зв’язування з іонами калію. Якщо глікозидами діяти на фермент із внутрішньої сторони, то вони ніякого впливу на функцію Na+, K+-насоса не чинять. Тому дії серцевих глікозидів можна перешкодити іонами Калію, що використовується в медичній практиці, коли вводять в організм розчини солей калію при отруєнні серцевими глікозидами. Інгібіторами ферменту є також тетраетиламоній, іони Купруму, Феруму, деякі гормони (естрогени, глюкагон, адреналін). Активують Na+, K+-АТФазу природні амінокислоти, дипептиди (карнозин, ансерин). Збільшують кількість цього ферменту в нирках кортикостероїди (особливо альдостерон).
Са2+-АТФаза (кальцієвий насос)
Са2+-АТФаза (або кальцієвий насос) знаходиться у клітинній і позаклітинній мембранах ендоплазматичного ретикулума та мітохондрій. Висока активність Са2+-АТФази відмічається в м’язовій (особливо в саркоплазматичному ретикулумі), у нервовій тканині, нирках, тобто там, де процеси активного транспорту визначають функцію органів і тканин. Са2+-АТФаза відкачує іони Кальцію за рахунок енергії АТФ в обмін на іони Натрію або Магнію, тобто відбувається антипорт цих іонів. Са2+-АТФаза мембран мітохондрій обмінює іони Кальцію на іони Гідрогену, причому іони Кальцію надходять усередину мітохондрій, а протони — назовні.
Вторинний активний транспорт (антипорт)
Натрій-гідрогенний насос використовує електрохімічний градієнт іонів Натрію, створений Na+, K+-насосом, для перенесення протонів із клітини за механізмом вторинного активного транспорту. При цьому процесі зв’язування позаклітинного натрію і внутрішньоклітинних протонів із протилежними сторонами білка-перенос- ника приводить до конформаційних змін його структури і положення в мембрані. Перенесення іонів Натрію в клітину й іонів Гідрогену з клітини, що відбувається при цьому, служить буферним механізмом, який запобігає закисненню у клітині. У мембрані еритроцитів іони НСО3– обмінюються на іони Хлору.
КОНТРОЛЬНІ ПИТАННЯ
1.Біологічні мембрани: мембранні структури тваринної клітини та їх функції; молекулярні компоненти біомембран.
2.Ліпіди біомембран: особливості їх структурної організації, ліпідний склад субклітинних мембран, молекулярні моделі мембранних ліпідів.
3.Рідинно-мозаїчна модель будови біомембран; біофізичні властивості мембран.
83

Глава 6. ФЕРМЕНТИ ТА КОФЕРМЕНТИ, КОФЕРМЕНТНІ
ФУНКЦІЇ ВІТАМІНІВ. РЕГУЛЯЦІЯ МЕТАБОЛІЗМУ
6.1. ФЕРМЕНТИ. СТРУКТУРА, ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ БІЛКІВ-ФЕРМЕНТІВ, КЛАСИФІКАЦІЯ ЗА ТИПОМ РЕАКЦІЇ
Здавна спостерігали, що перетворення виноградного соку на вино супроводжується виділенням пухирців газу, яке за зовнішніми ознаками нагадує кипіння, тому весь цей процес, тобто бродіння, назвали ферментацією (від лaт. fermentation — кипіння, бродіння), а речовини, що прискорюють бродіння, — ферментами. Через те, що бродіння прискорювали дріжджі, багато ферментів було знайдено спочатку у дріжджах і ферменти дістали другу назву — ензими (від грецьк. en zyme — у дpіжджax).
Перші наукові уявлення про ферменти були висловлені у 1814 р. K. C. Kіpхгoфoм, який довів, що саме екстракти з паростків зерна, багаті на білки, здатні розщеплювати крохмаль до мальтози. Знaчeння цих дослідів ученого полягало в тoму, що впepшe була пoкaзaна рoль самe білків у пеpeтвоpeнні вyглeвoдів. О. Я. Дaнилeвcький розробив мeтoди виділeння фepмeнтів (їx екcтpaкцію, aдcopбцію, елюцію) і за їх допомогою у 1862 р. виділив із підшлункової залози ферменти aмілaзy і тpипcин, дослідивши їх властивості. Лyї Пacтep у дослідах із зеленою пліснявою довів, щo ферменти цієї плісняви зброджують тільки D-виннy киcлoтy і нe зброджують її L-фopмy. Цими дослідами булa доведена cпeцифічніcть дії фepмeнтів. У подальшому значний внесок у pозвиток фepмeнтoлoгії зробили О. М. Бax, І. П. Пaвлoв, B. І. Пaллaдін та ін. Зараз відомо близько 3000 ферментів, триває їх подальший пошук і дослідження, оскільки хімічні процеси, які відбуваються в біологічних системах, є ферментативними.
Існують такі дoкaзи, що всі фepмeнти є білками:
1.Пoдібнo до білків, фepмeнти мають виcoкy мoлeкyляpнy мacy — від дecятків тиcяч дo кількоx мільйoнів дaльтoн (Да). Haпpиклад, мoлeкyляpнa мaca піpyвaтдeгідpoгeнaзи дорівнює 4 000 000 Да, лактатдегідрогенази — 140 000 Да, кaталaзи —
24 800 Да.
2.Як і білки, фepмeнти утворюють кoлoїдні розчини. Мoлeкyли фepмeнтів нe здатні до діaлізy, тoмy за допомогою діaлізу їx розчини можна звільнити від низькомолекулярних домішок.
3.Під впливом різних фізичних і хімічних факторів (виcoкa тeмпepaтypa, міцні киcлoти, луги, coлі важких мeтaлів та ін.) відбувається дeнaтypaція фepмeнтів. Фермент при цьому втрачає здатність каталізувати хімічну реакцію.
4.Ферменти, як і білки, можна висолювати нeйтpaльними coлями (cyльфaтoм aмoнію, xлopидoм нaтpію). Саме завдяки висолюванню виділено багато ферментів у формі кристалів.
5.Пpи гідpoлізі фeрмeнти, як і білки, pозпaдaютьcя нa aмінoкиcлоти.
6.Дoкaзoм білкoвoї пpиpoди фepмeнтів є їx лaбopaтopний cинтeз із aмінoкиcлoт.
Ферменти — це специфічні білки, що виконують в організмі роль біологічних каталізаторів. Як усі білки, ферменти мають первинну, вторинну, третинну, а багато які з них — четвертинну структуру. Ферменти з четвертинною структурою складаються з протомерів (субодиниць).
Номенклатура ферментів
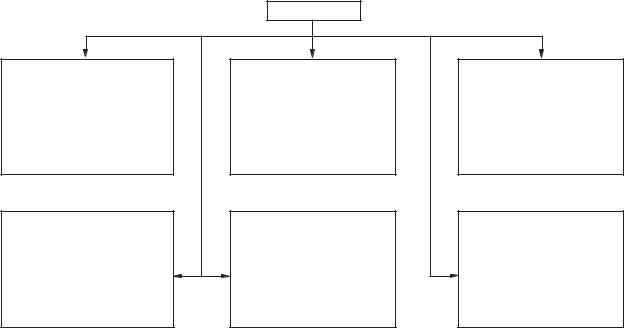
Наявність великої кількості ферментів (сьогодні їх відомо близько 3000) викликала необхідність розробити єдину класифікацію й номенклатуру ферментів. У 1961 р. у Москві на V Міжнародному біохімічному конгресі була затверджена єдина міжнародна (систематична) класифікація й номенклатура ферментів. В основу її покладено принцип поділу ферментів за типом хімічних реакцій, які вони каталізують. Тип реакції, що каталізують ферменти, у сполученні з назвою субстрату (субстратів) — основа для систематичного найменування ферментів.
Усі відомі реакції, що перебігають в організмі, можуть бути зведені до шести основних типів:
1.Окисно-відновні реакції.
2.Реакції переносу окремих груп атомів від одних субстратів на інші.
3.Реакції розщеплення внутрішньомолекулярних зв’язків органічних речовин за участю молекули води.
4.Оборотні реакції відщеплення різних груп атомів від субстратів негідролітичним шляхом з утворенням подвійного зв’язку або приєднання груп атомів до місця подвійного зв’язку.
5.Реакції ізомеризації.
6.Реакції синтезу органічних речовин з інших вихідних молекул із використанням розпаду АТФ або іншого нуклеозидтрифосфату.
Відповідно до шести типів хімічних реакцій всі ферменти поділені на шість класів:
1.Оксидоредуктази.
2.Трансферази.
3.Гідролази.
4.Ліази.
5.Ізомерази.
6.Лігази (синтетази).
Класи ферментів, у свою чергу, поділяються на підкласи, підкласи — на підпідкласи. Поділ ферментів на підкласи в межах одного класу зроблено з урахуванням основних видів субстратів, які беруть участь у даному типі хімічних перетворень. Наприклад, окремі підкласи оксидоредуктаз формують ферменти, що окиснюють
субстрати, які містять спиртові групи (–СН2–ОН) до альдегідних і кетонних груп (перший підклас),
іферменти, що окиснюють альдегіди і кетони до кислот (другий підклас оксидоредуктаз). Поділ
84
трансфераз на підкласи зроблено з урахуванням |
ферментів, у якій назви ферментів скорочені. На- |
|||
тієї групи, що підлягає переносу, гідролаз — з |
приклад, цей же фермент має тривіальну назву |
|||
урахуванням типу зв’язку, що гідролізується, і |
лактатдегідрогеназа. |
|
||
т. ін. |
Класифікація ферментів наведена на рис. 6.1. |
|||
Поділ підкласів ферментів на підпідкласи |
Номенклатура — цифрове відображення місця |
|||
відбувається з урахуванням природи хімічних |
кожного ферменту в класифікації. |
|||
сполук донорів або акцепторів, які беруть участь |
Код ферменту складається з чотирьох цифр: |
|||
у реакції. Наприклад, у гідролаз підпідклас уточ- |
1-й знак |
— клас ферменту (від 1 до 6); |
||
нює тип зв’язку, що гідролізується, а у ліаз — |
2-й знак |
— функціональна група; |
||
тип групи, що відщеплюється. Нарешті, всі фер- |
3-й знак |
— кофермент; |
||
менти, об’єднані в один підпідклас, отримують |
4-й знак |
— субстрат. |
||
порядковий номер. |
1. Оксидоредуктази. Оксидоредуктази каталі- |
|||
Кожний фермент має код, або шифр, що |
||||
зують окисно-відновні реакції. Відповідно до сис- |
||||
містить чотири цифри, розділені крапками. Ці |
тематичної номенклатури назви їх складаються |
|||
шифри утворюються за таким принципом. Пер- |
за формою «донор:акцептор-оксидоредуктаза». |
|||
ша цифра вказує на номер одного з шести класів |
Відповідно до робочої номенклатури розрізняють |
|||
ферментів, друга означає підклас, третя — |
такі основні оксидоредуктази: |
|||
підпідклас і четверта — порядковий номер фер- |
1) Анаеробні дегідрогенази — каталізують |
|||
менту у підпідкласі. На початку шифру ставить- |
||||
перенос атомів Гідрогену або електронів на будь- |
||||
ся дві літери — КФ (класифікація ферментів). На- |
який проміжний субстрат, але не на кисень і не |
|||
приклад, повний шифр ферменту лактатдегідро- |
на перекис водню (наприклад, лактатдегідроге- |
|||
генази — КФ 1.1.1.27. Цей фермент належить до |
наза — лактат:НАД+-оксидоредуктаза). |
|||
класу оксидоредуктаз, до першого підкласу — |
2) Аеробні дегідрогенази (або оксидази) — |
|||
оксидоредуктаз, які окиснюють оксигрупи до ке- |
||||
каталізують перенос атомів Гідрогену або елек- |
||||
тонних груп, до першого підпідкласу, у якому |
тронів безпосередньо на кисень (наприклад, ци- |
|||
акцептором водню є НАД+, порядковий номер |
тохромоксидаза каталізує перенос електронів від |
|||
цього ферменту в підпідкласі — 27. |
цитохрому а3 на кисень). |
|
||
Крім шифру ферменти мають певну назву за |
|
|||
3) Каталаза і пероксидаза. Каталаза каталі- |
||||
систематичною і робочою (тривіальною) номен- |
||||
зує перенос двох атомів Гідрогену з однієї молеку- |
||||
клатурою. За систематичною номенклатурою |
ли пероксиду гідрогену на іншу: |
|||
назва ферментів складається з двох частин. Пер- |
Н2О2 + Н2О2 → |
2Н2О + О2 |
||
ша частина вказує на назву субстрату, на який |
||||
діє фермент, друга — на природу хімічної реакції |
Пероксидаза каталізує перенос двох атомів |
|||
й має закінчення -аза. Наприклад, лактат: |
||||
Гідрогену з різних субстратів, включаючи від– |
||||
НАД+-оксидоредуктаза. Цей фермент каталізує |
новлені піридинові й флавінові ферменти, на пер- |
|||
перенос протонів і електронів від лактату на |
оксид гідрогену: |
|
||
НАД. У повсякденній практиці використовують |
Н2О2 + 2Н+ → |
2Н2О |
||
так звану робочу (тривіальну) номенклатуру |
||||
ФЕРМЕНТИ
1-й клас — Оксидоредуктази
13 підкласів Окисно-відновні реакції
—НАДзалежні
—ФАДзалежні
—цитохроми
4-й клас — Ліази
5 підкласів Негідролітичне розщеплення ковалентних зв’язків
—Декарбоксилази
—Дегідратази
2-й клас — Трансферази
8 підкласів Перенос груп атомів:
—метильні
—ацильні
—амінні
—фосфатні
5-й клас — Ізомерази
5 підкласів Реакції ізомеризації Цис-транс-ізомерази Внутрішньомолекулярні оксидоредуктази Внутрішньомолекулярні трансферази
3-й клас — Гідролази
9 підкласів Гідролітичне розщеплення зв’язків складних ефірів:
—фосфатази
—глікогідролази
—пептидгідролази
6-й клас — Лігази
4 підкласи Синтез із використанням енергії макроергів
С–О-зв’язки С–S-зв’язки С–N-зв’язки С–С-зв’язки
Рис. 6.1. Класифікація ферментів
85
2. Трансферази. До класу трансфераз належать ферменти, що каталізують перенос різних груп атомів від одних субстратів на інші.
Найменування їх складається за формою: «донор + акцептор — група, що транспортується
— трансфераза». Розрізняють трансферази, що каталізують перенос:
а) одновуглецевих залишків (наприклад, метилтрансферази каталізують перенос метильних груп (–СНЗ), формілтрансферази — перенос формільних груп);
б) залишків фосфорної кислоти — фосфотрансферази (наприклад, гексокіназа: АТФ + гексоза →
→гексозо-6-фосфат + АДФ);
в) аміногруп — амінотрансферази. З них найбільш досліджені дві: аланінамінотрансфераза (АЛТ) і аспартатамінотрансфераза (АСТ).
АЛТ каталізує реакцію оборотного переносу аміногрупи між α -аланіном і α -кетоглутаровою кислотою з утворенням пірувату і α -глутаміно- вої кислоти:
L-Аланін + α -Кетоглутарат →
→Піруват + L-Глутамат.
АСТ каталізує реакцію оборотного переносу аміногрупи між аспарагіновою кислотою й α -ке- тоглутаровою кислотою з утворенням оксалоацетату і L-глутамінової кислот:
Аспартат + α -Кетоглутарат →
→Оксалоацетат + L-Глутамат;
г) трансферази, що каталізують перенос залишків різних кислот (ацилів), — ацилтрансферази (наприклад, перенос ацилів із коензиму А на гліцеролфосфорну кислоту в процесі біосинтезу тригліцеридів). Розрізняють також глікозилтрансферази, що каталізують перенос залишків вуглеводів, й інші трансферази.
3. Гідролази. До класу гідролаз належать ферменти, що каталізують розщеплення внутрішньомолекулярних зв’язків органічних речовин за участю молекули води:
R–X + Н2О → R–ОН + НХ.
Найменування їх складається за формулою: «субстратгідролаза» (наприклад, ацетил-КоА- гідролаза — фермент, що розщеплює за участю молекули води ацетил-КоА на коензим А й оцтову кислоту). До гідролаз належать ферменти, що гідролізують складні ефірні, глікозидні, пептидні зв’язки та ін. Ферменти, що каталізують гідроліз складних ефірів карбонових кислот, мають робочу назву естерази (від лат. ester — ефір). Наприклад, фермент ліпаза каталізує гідроліз зв’язків гліцеридів, розщеплюючи їх на гліцерол і карбонові кислоти; ацетилхолінестераза каталізує гідроліз ацетилхоліну на холін і оцтову кислоту. Ферменти, що каталізують гідроліз фосфомоноефірів, за робочою номенклатурою називаються фосфатазами (наприклад, глюкозо-6- фосфатаза каталізує гідроліз глюкозо-6-фосфату на глюкозу і фосфорну кислоту). Ферменти, що каталізують гідроліз глікозидних зв’язків, розщеплюють вуглеводи (амілаза, мальтаза, лакта-
за, сахароза та ін.). Ферменти, що каталізують гідроліз пептидних зв’язків, називаються пептидгідролази (пепсин, трипсин, хімотрипсин).
4.Ліази. До класу ліаз належать ферменти, що каталізують відщеплення від субстратів негідролітичним шляхом різних груп з утворенням подвійного зв’язку або приєднання різних груп до місця подвійного зв’язку. Систематична назва цих ферментів утворюється аналогічно гідролазам, тобто «субстрат-відщеплена група-ліаза» (наприклад, малатгідроліаза каталізує оборотне відщеплення молекули води від яблучної кислоти з утворенням фумарової кислоти). Залежно від характеру зв’язків, які руйнують ліази, вони поділяються на Карбон-Карбон-ліази (С-С-ліа- зи), Карбон-Оксиген-ліази (С-О-ліази), Карбон- Нітроген-ліази (C-N-ліази) та ін. До Карбон- Карбон-ліаз належать декарбоксилази (піруватдекарбоксилаза). Карбон-Оксиген-ліази за робочою номенклатурою називаються дегідратазами (гідратазами). Це, наприклад, карбоангідраза,
що розщеплює вугільну кислоту на СО2 і Н2О. Прикладом ферменту, що діє на Карбон-Нітро- ген-зв’язок, може бути фермент аргінінсукцинатліаза, що каталізує розщеплення аргінінбурштинової кислоти на аргінін і фумарову кислоту.
5.Ізомерази. До класу ізомераз належать ферменти, що каталізують різні типи реакцій ізомеризації з утворенням різних ізомерів, тобто речовин однакового хімічного складу і молекулярної маси, але різних за будовою молекули і властивостями. Ізомерази, що діють на субстрати з одним асиметричним атомом Карбону, називаються рацемазами. Якщо ізомерази діють на субстрати з кількома асиметричними атомами Карбону, то вони називаються епімеразами. Наприклад, УДФ-глюкозо-епімераза перетворює УДФ-глю- козу на УДФ-галактозу. До ізомераз належать також цис-транс-ізомерази. Якщо ізомеризація включає внутрішньомолекулярний перенос груп, фермент дістає назву мутаза. Наприклад, фосфоглюкомутаза каталізує взаємоперетворення глюкозо-1-фосфату на глюкозо-6-фосфат.
6.Лігази (синтетази). До класу лігаз належать ферменти, що каталізують синтез органічних речовин із двох вихідних молекул з використанням енергії АТФ або інших нуклеозидтрифосфатів. Систематична назва лігаз складається за формою «X-Y-лігаза», де через X-Y позначаються вихідні речовини (наприклад, глутаматаміаклігаза). За участю цього ферменту з глутамінової кислоти й аміаку в присутності АТФ синтезується глутамін — одна з транспортних форм аміаку.
Залежно від характеру зв’язків, що утворюються, лігази поділяються на такі, що утворюють С-С-зв’язки, С-О-зв’язки, С-N-зв’язки та ін. До лігаз, що утворюють С-С-зв’язки, належить, наприклад, ацетил-КоА-карбоксилаза, що катал-
ізує біосинтез малоніл-КоА з ацетил-КоА і СО2; піруваткарбоксилаза, що каталізує біосинтез щавлевооцтової кислоти з піровиноградної кис-
лоти і СО2. До лігаз, що утворюють С-О-зв’язки, належить, наприклад, фермент аміноацилсинтетаза, що каталізує утворення аміноацил-тРНК
86
у процесі біосинтезу білків. До лігаз, що утворюють С-N-зв’язки, належать пептидсинтетази, що каталізують утворення пептидних зв’язків.
Специфічність дії ферментів
Специфічність дії ферментів — це спрямованість дії ферменту на певний субстрат або групу близьких за структурою й властивостями субстратів. Специфічність зумовлена конформаційною й електростатичною комплементарністю між молекулами субстрату та ферменту й унікальною структурою активного центру ферменту, чим забезпечується висока спорідненість і вибірковість перебігу однієї реакції серед багатьох інших. Розрізняють такі види специфічності:
1. Абсолютна специфічність — фермент ката-
лізує перетворення тільки одного субстрату (наприклад, аргіназа розщеплює аргінін на орнітин і сечовину; уреаза каталізує розпад тільки сечовини, а на тіосечовину не впливає).
|
NH2 |
|
NH2 |
||||
C |
|
O |
C |
|
S |
||
|
|
||||||
|
|
||||||
|
|
|
|
|
|
|
|
NH2 |
NH2 |
||||||
Сечовина |
Тіосечовина |
||||||
2.Групова специфічність — фермент каталі-
зує перетворення групи субстратів, що мають один тип будови і спільний тип зв’язку в будові
субстратів, а також будову ділянки молекули субстратів, яка цей зв’язок оточує. Так, α -аміла-
за розщеплює крохмаль і глікоген. Обидва субстрати мають один тип зв’язку — α -1-4-глікозид- ний зв’язок, утворений залишками глюкози.
3.Відносна специфічність дії ферменту — це здатність діяти на субстрати, що мають один певний тип хімічного зв’язку. Травні ферменти — пепсин, трипсин — специфічні щодо пептидних зв’язків, утворених певними амінокислотами в різних білках.
Ліпаза гідролізує складноефірні зв’язки в триацилгліцеролах, побудованих із залишків гліцеролу й різних вищих кислот. Цитохром Р-450 бере участь у гідроксилюванні різних сполук (близько 7000 найменувань). Це найменш специфічна ферментна система, що бере участь у перетворенні природних речовин, ліків, отрут.
4.Стереохімічна специфічність — фермент ка-
талізує перетворення тільки одного з можливих стереоізомерів субстрату ( D- або L-форму, цисабо транс-ізомерів).
Відомі оксидази D- і L-амінокислот. Оксидаза D-амінокислот високоактивна при фізіологічних значеннях рН середовища, порівняно з оксидазою L-амінокислот (оптимум рН=10). Фумараза каталізує перетворення тільки фумарату (транс-ізомер) і не діє на малеїнат (цис-ізомер):
COOH |
COOH |
||||
|
|
|
|
|
|
CH |
CH |
||||
|
|
|
|
|
|
HCH |
CH |
||||
|
|
COOH |
|
|
COOH |
Фумарат |
Малеїнат |
||||
Таким чином, завдяки специфічності дії ферментів забезпечується перебіг із високою швидкістю певних реакцій з величезного різноманіття можливих перетворень, чим регулюється інтенсивність обміну речовин.
6.2. КОФАКТОРИ ТА КОФЕРМЕНТИ. КОФЕРМЕНТНІ ФУНКЦІЇ ВІТАМІНІВ
За хімічним складом ферменти поділяються на дві групи: прості й складні ферменти. Прості фер- менти-протеїни представлені поліпептидними ланцюгами й при гідролізі розпадаються на амінокислоти. До таких ферментів належать: пепсин, хімотрипсин, α -амілаза, ліпаза.
Більшість природних ферментів — це складні ферменти, які складаються з білкової частини (апофермент) і небілкової (кофактора). Складний фермент, що складається з апоферменту й кофактора, називається холоферментом:
Холофермент = Апофермент + Кофактор (кофермент, простетична група)
ФЕРМЕНТИ
Прості Складні
Апофермент |
Кофактор |
Іони |
|
|
металів |
Кофермент |
Простетична |
|
|
|
група |
Вітаміни Фосфорні Нуклеотиди Металовмісні ефіри комплекси вітамінів
Зв’язок між білковою й небілковою частиною в складних ферментах може бути різної міцності. У тих випадках, коли небілкова частина ферменту міцно зв’язана з апоферментом ковалентним зв’язком, вона називається простетичною групою (наприклад, у молекулі аце- тил-КоА-карбоксилази біотин ковалентно зв’язаний з апоферментом за допомогою амідного зв’язку).
Якщо небілкова частина ферменту слабо зв’я- зана з ферментним білком (наприклад, водневими або іншими зв’язками) і з’єднується з ним тільки під час каталітичної реакції, то вона називається коферментом. Типові представники коферментів: НАД+ і НАДФ+.
Однак різницю між простетичною групою й коферментом не можна абсолютизувати, оскільки в одних випадках, наприклад, в оксидазі D- амінокислот ФМН може бути легко відділений від білкової частини шляхом діалізу; той же ФМН міцно зв’язаний ковалентно з ферментами
87
тканинного дихання, виконуючи функції простетичної групи. Яка роль апоферменту й коферменту (простетичної групи) у каталізі? Один кофермент може з’єднуватися з різними апоферментами з утворенням різних ферментів, які каталізують різні біохімічні реакції. Наприклад, ПАЛФ є коферментом амінотрансфераз і декарбоксилаз амінокислот, НАД+ і НАДФ+ входять до складу більш як 150 різних ферментів. Саме апофермент визначає специфічність дії складного ферменту. Однак без коферменту складний фермент функціонувати не може, тому що кофермент, як правило, безпосередньо взаємодіє з субстратом. Отже, до коферментів належать органічні речовини порівняно складної будови, що беруть безпосередню участь у ферментативних реакціях.
Важливу роль у ферментативних реакціях виконують так звані кофактори. Це, як правило, речовини менш складної будови, зокрема, іони металів й інші неорганічні сполуки. Кофактори найчастіше не контактують із субстратом і не беруть участь у реакції, а переводять фермент в активну форму, сприяючи каталітичній реакції. Наприклад, іони Mg2+ активують фермент аденозинтрифосфатазу, іони Zn2+ — деякі пептидази. Однак цей поділ умовний, тому що іони можуть входити до складу ферментів і брати участь у каталітичній реакції як частина молекули ферменту.
Іони металів як кофактори ферментів
Металоферменти — дуже поширена група ферментів (чверть від усіх ферментів) (табл. 6.1). Іони металів як кофактори входять до складу ферментів, що належать до різних класів. Металоферменти, що каталізують реакції окисненнявідновлення, досить численні. Іон металу може перебувати в активному центрі або входити до складу органічної молекули (наприклад гему),
|
|
Таблиця 6.1 |
|
Деякі металозалежні ферменти |
|||
|
|
|
|
Фермент |
Іон металу |
Механізм участі |
|
у каталізі |
|||
|
|
||
|
|
|
|
Гексокіназа |
Mg2+ |
Зв’язування |
|
|
|
субстрату |
|
Піруваткіназа |
Mg2+, K+ |
Зв’язування |
|
|
|
субстрату |
|
Аргіназа |
4 Mn2+ |
Зв’язування |
|
|
|
субстрату |
|
|
|
й каталіз |
|
Піруват- |
4 Mn2+ |
Каталіз |
|
карбоксилаза |
|
|
|
Транскетолаза |
Ca2+ |
Стабілізація |
|
|
|
четвертинної |
|
|
|
структури |
|
Супероксид- |
2 Zn2+, 2 Cu2+ |
Каталіз |
|
дисмутаза |
|
|
|
γ -Амілаза |
Ca2+ та аніон Cl |
Стабілізація |
|
|
|
третинної |
|
|
|
структури |
|
|
|
|
|
або може бути зв’язаний залишками амінокислот апоферменту. Оскільки під дією оксидоредуктаз відбувається перенос електронів і змінюється ступінь окиснення субстратів, то в ролі кофакторів виступають іони металів зі змінним ступенем окиснення: Ферум, Купрум, Молібден, Кобальт. Металоферменти, що каталізують реакції гідролізу субстратів, містять метали з постійним ступенем окиснення: Цинк, Кальцій, Магній.
Роль металів у каталітичній дії ферменту
Метал, будучи електрофільною групою активного центру, здатний взаємодіяти з негативно зарядженими групами субстрату. Такий металосубстратний комплекс легше атакується ферментом. Наприклад, іони Mg2+ або Mn2+ утворюють комплекс із АТФ або АДФ у реакціях, що каталізуються кіназами й АТФазою. У разі відсутності металів ферменти малоактивні або не активні.
Метал зі змінною валентністю сам може брати участь у транспорті електронів (іони Fe3+→ Fe2+ у цитохромах в, с1, с, а, а3).
Метал сприяє формуванню каталітично активної конформації третинної й четвертинної структури апоферменту. Стабілізація можлива шляхом утворення сольових містків між іоном металу й карбоксильними групами амінокислот. Наприклад, позбавлена Цинку алкогольдегідрогеназа дисоціює на субодиниці й втрачає активність. Іони металів служать своєрідним містком між апоферментом і коферментом. Нормальна функція великого сімейства металоферментів залежить від нормального надходження в організм металів, що здебільшого належать до групи мікроелементів, звідси й висока біологічна роль цих металів: недостатнє надходження їх з їжею може спричинити серйозні порушення обміну речовин в організмі.
Коферменти, їх хімічна будова й функції
Коферментами можуть бути різноманітні за хімічною структурою органічні речовини. Вони поділяються на такі групи:
1.Коферменти — вітаміни.
2.Коферменти — фосфорні ефіри вітамінів.
3.Коферменти — нуклеотиди.
4.Коферменти — металовмісні комплекси.
1) До коферментів-вітамінів належать, на-
приклад, такі вітаміни, як ліпоєва кислота, фолієва кислота, біотин та ін. Ліпоєва кислота є одним із коферментів піруватдегідрогеназного комплексу, альфа-кетоглутаратдегідрогеназного комплексу, що каталізують окисне декарбоксилювання відповідно пірувату й альфа-кетоглу- тарату до ацетил-КоА і сукциніл-КоА. Біотин входить до складу ферментів, що каталізують реакції карбоксилювання. Наприклад, при біосинтезі вищих жирних кислот біотин необхідний для перетворення ацетил-КоА на малоніл-КоА (аце- тил-КоА-карбоксилаза). Біотин є коферментом
88
