
- •Микробный метаболизм
- •Источники элементов, используемые для приготовления питательных сред
- •Основные физиологические функции важнейших элементов
- •Источники углерода и азота
- •Температура насыщенного пара при различных давлениях
- •Стерилизация фильтрованием
- •Асбестовые фильтры
- •Химическая природа некоторых «сахаров», применяемых в среде Гисса
- •Рекомендуемая литература
24
В настоящее время известно много способов их стерилизации, которые разделяют на две основные группы: термическую и холодную стерилизацию.
Из термических способов наиболее широко используются стерилизация насыщенным паром под давлением (автоклавирование), стерилизация текучим паром, тиндализация и кипячение.
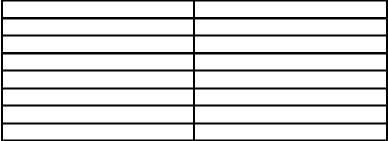
Стерилизация насыщенным паром под давлением –– один из наиболее эффективных методов, основанный на прогревании субстрата насыщенным паром в автоклавах –– аппаратах, работающих под давлением выше атмосферного, так как с повышением давления пара повышается и его температура (табл.3).
Таблица 3
Температура насыщенного пара при различных давлениях
Избыточное давление, атм |
Температура, оС |
0,5 |
112 |
0,6 |
114 |
0,7 |
116 |
0,8 |
117 |
1,0 |
121 |
1,5 |
127 |
2,0 |
134 |
Совместное действие высокой температуры и пара обеспечивает надежность стерилизации: при автоклавировании погибают и вегетативные клетки, и споры микроорганизмов.
Среды, предназначенные для стерилизации в автоклаве, наливают не выше половины высоты сосуда, сосуд закрывают ватно-марлевой пробкой или резиновой пробкой, которую завальцовывают.
Температура и длительность автоклавирования определяются прежде всего составом питательной среды. Обычно стерилизация проводится при температуре 121оС в течение 15 минут. Тем не менее необходимо помнить, что такая стерилизация не всегда является безвредной для питательной среды: длительное автоклавирование при повышенном давлении часто приводит к гидролизу в ее составе некоторых питательных компонентов.
Питательные среды, в составе которых имеются термолабильные вещества, стерилизуют при более низких температурах и давлении –– 112оС (т.е. 0,5 атм) в течение 15 мин. При таком режиме стерилизуют, например, среды, содержащие углеводы, пивное сусло, некоторые витамины, молоко, желатин.
При выборе режима стерилизации необходимо учитывать не только состав среды, но и уровень ее кислотности или щелочности –– рН. В случае кислой реакции или повышенной щелочности могут подвергаться гидролизу полимерные компоненты среды. Так, при стерилизации в автоклаве среды, содержащей желатин, при рН ниже 6,0 происходит пептонизация желатина, в результате чего среда не затвердевает даже при охлаждении. При рН ниже 5,0 частично гидролизуется и агар-агар, утрачивая свойство образовывать плотный гель. В процессе стерилизации среды, имеющей щелочную реакцию, карамелизуются углеводы, выпадают в осадок соли некоторых металлов.
Чтобы избежать подобных явлений, желательно стерилизовать среды при нейтральном значении рН, а после автоклавирования подкислить или подщелочить их с помощью стерильных растворов кислот или щелочей соответственно. Кроме того, некоторые компоненты среды стерилизуют при таком значении рН и таком режиме, при которых они практически не изменяются, а затем их добавляют стерильно в среды в нужном количестве.
На всех этапах процесса стерилизации необходимо вести контроль за режимом по таким критериям, как давление и температура. Для наблюдения за давлением в автоклаве пользуются манометрами, которые периодически проходят поверку.
Для контроля за температурой пользуются химическими термотестами, которые представляют собой вещества, изменяющие свой цвет и(или) физическое состояние после воздействия определенной температуры. Запаянные ампулы с порошком, смешанным с краской,
25
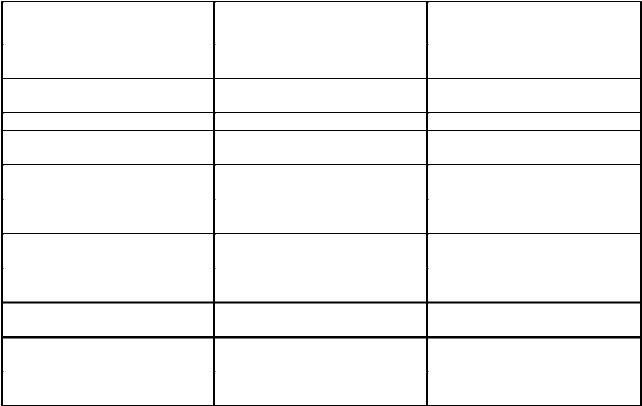
или вещества, плавящиеся только при определенной температуре, помещают в стерилизационную камеру вместе с питательными средами, подлежащими стерилизации. При достижении в камере определенной температуры порошок плавится, образуя сплав, окрашенный в цвет добавленной краски, или плавящиеся вещества приобретают иное состояние –– из кристаллического, переходят в аморфное со спонтанным изменением окраски, или только плавятся (табл.4).
|
|
Таблица 4 |
|
|
|
Наименование |
Температурный параметр, |
Цвет расплавленного |
|
подлежащий контролю, оС |
индикаторного вещества |
Резорцин, фуксин кислый |
110 + 2 |
Фиолетовый |
|
|
или темно-красный |
Бензойная кислота, |
120 + 2 |
Фиолетовый |
Фуксин кислый |
|
или темно-красный |
Бензамид, фуксин кислый |
124 + 3 |
Фиолетовый |
Сукцинамид, фуксин кислый |
124 + 2 |
Фиолетовый |
|
|
или темно-вишневый |
Никотинамид, фуксин кислый |
132 + 2 |
Фиолетовый |
|
|
или темно-вишневый |
Мочевина, фуксин кислый |
132 + 2 |
Фиолетовый |
|
|
или темно-вишневый |
Левомицетин, фуксин кислый |
160 + 2 |
Темно-красный |
|
– 10 |
или фиолетовый |
Лактоза, фуксин кислый |
170 + 3 |
Темно-коричневый |
|
|
или темно-фиолетовый |
Тиомочевина |
180 + 2 |
Желтый или желто-зеленый |
|
– 10 |
|
Гидрохинон |
180 + 2 |
Серый с фиолетовым оттенком |
|
– 10 |
|
Кислота винная |
180 + 2 |
Светло-коричневый |
|
– 10 |
или коричневый |
Более надежным методом контроля эффективности стерилизации является применение биоиндикаторов. Для проведения такого контроля в стерилизационную камеру, одновременно со средами, подлежащими стерилизации, помещают биотесты –– пробирки с полосками марли или фильтровальной бумаги, зараженные микроорганизмами с известной устойчивостью к температурным воздействиям. Обычно для этой цели используют бактерии рода Bacillus –– B. subtilis или B.stearothermophilus. После окончания стерилизации биотесты направляют в лабораторию, где пробирку с биотестом заливают сахарным бульоном и посевы инкубируют 48 ч при 37оС. При наличии визуального роста готовят мазки для идентификации культуры.
Для контроля стерильности питательные среды после стерилизации помещают в термостат при 37оС на 5 сут. Жидкие среды должны оставаться прозрачными, а на поверхности и в толще агаризованных сред не должны появляться признаки роста. Кроме контроля стерильности, производят химический контроль готовых сред, для чего в нескольких образцах каждой серии определяют рН, количество общего и аминного азота, хлоридов и др.
Кроме того, каждая среда должна пройти биологический контроль. Для этого несколько образцов среды засевают лабораторной культурой того микроорганизма, для которого приготовлена среда, и изучают характер его роста. Только после всех видов контроля среды можно использовать по назначению.
