
- •Под редакцией профессора э. В. Недашковского
- •Отв. Редактор - проф. Э.Недашковский
- •Оглавление
- •Раздел 1. Вопросы общей анестезиологии
- •Раздел 2. Вопросы частной анестезиологии
- •Раздел 3. Регионарная анестезия, лечение боли
- •Раздел 4. Вопросы интенсивной терапии
- •Раздел 5. Общая информация
- •Раздел 6. Актуальные аспекты респираторной терапии
- •Раздел 1. Вопросы общей анестезиологии
- •Медикаментозное лечение интраоперационной ишемии миокарда
- •Принципы риска и безопасность
- •Раздел 1. Смерть младенца вследствие трудных родов
- •Раздел 2. Проблема оказания помощи
- •Участие ррак в переносе сигнальной информации и апоптозе
- •Ингибиторы ренин-ангиотензиновой системы и анестезия
- •Методы определения глубины анестезии
- •Анализ электроэнцефалограммы
- •Гипертрофическая обструктивная кардиомиопатия
- •Гемодинамические цели при митральной регургитации
- •163061, Архангельск, пр. Троицкий, 51, каб.330.
- •Одиночные или множественные подергивания?
- •Роль послеоперационной анальгезии при амбулаторных хирургических вмешательствах
- •Литература
- •Лечение хронических болевых синдромов детского возраста
- •Лекарства и плацента
- •Физиологические изменения фармакологии при беременности Сердечно-сосудистая система
- •2. Факторы, влияющие на плацентарный транспорт
- •2.1 Маточные факторы
- •2.2 Плацентарные факторы
- •2.3 Факторы плода
- •3. Анестезиологические препараты и трансплацентарный транспорт
- •3.1 Внутривенные препараты
- •3.2 Закись азота и галогенные анестетики
- •3.3 Миорелаксанты
- •3.4 Опиоиды ,
- •3.5 Местные анестетики и регионарная анестезия
- •Применение ларингеальной маски в акушерстве
- •Анестезиологический осмотр в акушерстве
- •24 Часов
- •I. Нужна ли госпитализация?
- •II. Тяжелые ожоги: что должно быть сделано до перевода в ожоговый центр?
- •1) Как поступить: охлаждать ожоги или согревать пациента?
- •2) Подготовка к дальнейшему лечению
- •3) Количество и состав сред инфузионной терапии
- •4) Анальгезия и седация '
- •5) Респираторная поддержка
- •6) Особые случаи
- •1. Мониторный контроль состояния кардио-респираторной системы и жидкостных секторов организма
- •1. Патогенез
- •1.1. Методика дилюционной тромбоцитопении и коагулопатии
- •1.2. Диссеминированное внутрисосудистое свертывание (двс)
- •1.3. Гипотермия
- •2.1. Профилактические компоненты терапии
- •2.2. Можем ли мы полагаться на клинические данные?
- •2.3. Можем ли мы полагаться на данные исследований гемостаза?
- •2.4. Дополнительные подходы
- •Вопрос 1: как пользоваться компасом в лесу информации?
- •Вопрос 3: насколько интересно название статьи? кто авторы? насколько различается профиль ваших лечебных учреждений?
- •Вопрос 4: четко ли изложены выводы работы в тезисах статьи?
- •Вопрос 5: надежда и вера: где гипотеза?
- •Вопрос 6: какие методы используются для сбора данных? насколько подробно они описаны?
- •Вопрос 7: как представлены средние величины?
- •Вопрос 8: были ли представлены наиболее важные клинические параметры и исходы?
- •Вопрос 9: достоверны ли результаты статистически? насколько они важны с клинической точки зрения?
- •Вопрос 10: верю ли я результатам прочитанной работы?
2.2. Можем ли мы полагаться на клинические данные?
В литературе приводится масса удивительно разноречивых сведений по частоте развития микрососудистых кровотечений, которые обозначаются как «патологическое хирургическое кровотечение». Клинически оценить микрососудистое кровотечение очень трудно. Но никто не должен быть уверен до начала лечения, что оно прекратится самостоятельно.
2.3. Можем ли мы полагаться на данные исследований гемостаза?
Следует обратить внимание на два момента. Во-первых, лабораторные тесты требуют времени. Отсроченно полученные результаты могут стать серьезной проблемой даже при простых исследованиях, таких как протромбиновое время (ПТВ) и активированное частично тромбопластиновое время (АЧТВ). Во-вторых, прогнозируемые показатели этих тестов не так уж хорошо знакомы. Существует ли статистически установленная взаимосвязь между микрососудистым кровотечением и достаточностью этих лабораторных тестов? Кровотечение из микрососудов возникает при различных показателях количества тромбоцитов, ПТВ, АЧТВ и фибриногена (5,15). В большинстве современных руководств критическими показателями хирургического кровотечения являются ПТВ и АЧТВ, превышающие норму в 1,5 раза после трансфузии СЗП и количество тромбоцитов ниже 50 г/л (у нейрохирургических пациентов - ниже 100 г/л) после трансфузии ТК (16,17). Различные показатели ПТВ и АЧТВ в зависимости от типов анализаторов и используемых реагентов могут повлиять на принятие терапевтического решения при хирургическом кровотечении (18).
2.4. Дополнительные подходы
Практически должно приниматься во внимание только подсчет замещаемого объема, клинические наблюдения и их данные и, если возможно, тесты коагуляции. Если есть значительные нарушения в результатах лабораторных тестов при отсутствии клинических проявлений кровотечения, необходимо использовать СЗП и ТК до появления последних. Если после замещения одного объема кровотечение усиленно продолжается, то обязательно следует назначать СЗП и ТК. Обычно количество тромбоцитов подсчитывается быстро, что делает возможным быстро принять решение о трансфузии ТК, в то время как СЗП должна назначаться, опережая получение данных лабораторного исследования свертывающей системы. При плановых хирургических вмешательствах свежезамороженная плазма может быть использована в первую очередь при массивной кровопотере, а ТК назначается только после теста количества тромбоцитов (19). СЗП используется в первую очередь в качестве объема экстренного возмещения (19).
Заключение
Необходимо более точное определение МГТ для уяснения клинических рекомендаций по коррекции нарушений гемостаза и их профилактики. Коагулопатии вследствие МГТ развиваются по многим причинам. Гипотермия и ДВС при травме часто приводят к микрососудистым кровотечениям, в то время как дилюционная коагулопатия в основном развивается при плановой хирургии. Неоспоримым положением терапии нарушений гемостаза является восстановление тканевой оксигенации и коррекция гипотермии, а использование компонентов донорской крови противоречиво. При травме кровотечение обусловлено тромбоцитопенией, которая в первую очередь должна компенсироваться, а при плановых хирургических вмешательствах необходимо возмещать дилюционный дефицит факторов свёртывания. Однако из-за разнообразия терапии последнего дать удовлетворительные рекомендации по использованию каких либо компонентов крови в каждом конкретном случае очень трудно.
Литература
1. Reed RL, Ciavarella D, Heimbach DM et a/. Prophylactic platelet administration during massive transfusion. A prospective, randomized, double blind clinical study. Ann Surg 1986; 203:40-8.
2. Murray DJ, Pennell BJ, Weinstein SL, Olson JD. Packed red cells in acute blood loss: dilutional coagulopathy as a cause of surgical bleeding. AnesthAnalg 1995; 80:336-42.
3. Miller RD, Robbins TO, Tong MJ, Barton SL Coagulation defects associated with massive blood transfusion. Ann Surg 1971; 174: 794-801.
4. - Myllyla G. New transfusion practice and haemostasis. Ada Anaesthesiol Scand 1988; 32:76-80.
5. Murray DJ, Olson J, Strauss R, Tinker JH. Coagulation changes during packed red cell replacement of major blood loss. ,,,. Anesthesiology 1988; 69:839-45.
6. Hiippala ST, Myllyla GJ, Vahtera EM. Hemostatic factors and replacement of major blood loss with plasma-poor red cell concentrates. Anesth Analg 1995; 81:360-5.
7. Counts RB, Haisch TL, Mawell NG, Heimbach DM, Carrico CJ. Hemostasis in massively transfused trauma patients. Ann Surg 1979; 190:91-9.
8. Mannucci PM, Federici AB, Sirchia G. Hemostasis testing during massive blood replacement. A study of 172 cases. Vox Sang 1982; 42:113-23.
9. Schmied H, Kurz A, Sessler DI, Kozek S, Reiter A. Mild hypothermia increases blood loss and transfusion requirements during total hip arthroplasty. Lancet 1996; 347:289-92.
10. Cosgriff N, Moore ЕЕ, Sauaia A et al. Predicting life-threatening coagulopathy in the massively transfused trauma patient: hypothermia and addoses revisited. J Trauma 1997; 42:857-61.
11. Reed RL, Johnson TD, Hudson JD, Fischer RP. The disparity between hypothermic coagulopathy and clotting studies. J Trauma 1992; 33: 465-70.
12. Treib J, Haass A, Pindur G. Coagulation disorders caused by hydroxyethyl starch. Thromb Haemost 1997; 78:974-83.
13. Quaknine-Orlando B, Samama CM, Riou В et al. Role of the hematocrit in a rabbit model of arterial thrombosis and bleeding. Anesthesiology 1999; 90:1454-61.
14. Erber WN, Tan J, Grey D, Lown ЗА. Use of unrefrigerated fresh whole blood in massive transfusion. Med J Aust 1996; 165: 11-3.
15. Ciavarella D, Reed RL, Counts RB et al. Clotting factor levels and the risk of diffuse microvascular bleeding in the massively transfused patient. BrJ Haematol 1987; 67:365-68.
16. British Committee for Standards in Haematology. Guidelines for platelet transfusion. Transfusion Medicine 1992; 2:311-8.
17. Practice Guidelines for Blood Component Therapy. A Report by the American Society of Anesthesiologists Task Force on Blood Component Therapy. Anesthesiology 1996; 84:732-47.
18. Murray D, Pennell B, Olson J. Variability of prothrombin time and activated partial thromboplastin time in the diagnosis of increased surgical bleeding. Transfusion 1999; 39:56-62.
19. Hiippala S. Replacement of massive blood loss. Vox Sang 1998; 2:399-407.
ГРИБКОВАЯ ИНФЕКЦИЯ В ОТДЕЛЕНИИ ИНТЕНСИВНОЙ ТЕРАПИИ (ОПТ)
Н. Фарбегас, А. Торрес (Барселона, Испания)
Эпидемиология
Частота возникновения грибковой инфекции растет по всему миру, особенно среди критических больных с отсутствием нейтропении. Национальная Программа по Надзору за Нозокомиальной Инфекцией (НПННИ) предоставила сведения, что за период 80-90-х годов частота возникновения грибковой инфекции увеличилась примерно в 2 раза и самый большой ее прирост отмечается среди хирургических пациентов (1). В 1990 году на 1000 выписанных пациентов с ожогами и травмами частота возникновения грибковой инфекции составляла 16,1, кардиологических больных - 10,1 и 7,3 на 1000 пациентов хирургического профиля. Абсолютное большинство в спектре грибковой инфекции (78%) приходится на грибки различных штаммов рода Candida.
Драматический рост кандидозной инфекции за последнее десятилетие напрямую связан с частой колонизацией госпитализированных пациентов. По данным нескольких исследований примерно 64% пациентов колонизируются грибками рода Candida в отделениях интенсивной терапии (2).
Candida albicans - часто присутствует в составе нормальной микрофлоры желудочно-кишечного тракта и гортаноглотки. Примерно от 10 до 40% здоровых людей являются носителями дрожжевых грибков в глотке и кишечнике в небольшой концентрации 103 ;.,гк/мл (грибковых колоний) в слюне или в 1 грамме фекалий. При смене хозяина (носителя) рост С.albicans может значительно усилиться. Подобной колонизации сопутствуют такие факторы, как госпитализация, диабет, тепловая травма и иммунодефицитное состояние. Использование мощной антибиотикотерапии нарушает состав нормальной микрофлоры кишечника и создает благоприятные условия для дрожжевой пролиферации. У относительно здоровых пациентов это не приводит к генерализации инфекции, однако для критических больных это становится жизненно опасным. Подобная кандидозная колонизация является вероятно необходимым фактором инвазии инфекции (2,3)-; у пациентов с нейтропенией и гематологическими заболеваниями длительнотекущая и высокой плотности колонизация может привести к кандидемии.
Становясь инвазивной инфекцией грибки Candida обычно пенетрируют через слизистую кишечной стенки и проникают в кровоток. Множество факторов, свойственных для пациентов ОИТ, нарушают интегративную функцию слизистой ЖКТ. Разнообразная эндогенная флора вместе с Candida устремляются в кровоток (транслокация кишечной флоры). Однако подобный выброс инфекции, как сообщалось, повышает вероятность ее «горизонтальной трансмиссии» (3).
В Европейском Международном Исследовании Превалирования Инфекции в ОИТ (ЕИ-ПИИТ) собраны данные по исследованию 10038 пациентов 1417 ОИТ из 14 стран Европы в один день 1992 года. Среди 44,8% пациентов, которым проводилась интенсивная терапия инфекции, у 17,1% присутствовали грибки (в основном штаммы рода Candida}. Грибки заняли пятое место среди наиболее распространенных возбудителей после Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa и coagulase-negative Staphyloccocci. Более 50% пациентов, у которых грибковая инфекция была изолированной, получали противогрибковые препараты, так как даже изолированная инфекция является клинически очень опасной (4).
В недавнем мультицентровом исследовании хирургических и терапевтических пациентов ОИТ диагноз инвазивного кандидоза с учетом узких критериев был поставлен лишь у 2% пациентов (2).
Грибковая инфекция влечет за собой самую высокую летальность среди всех инфекций крови. Казалось бы, Candida albicans стоит на первом месте среди патогенов, но в последнее время наблюдается значительный сдвиг в сторону таких штаммов Candida, как C.tropicalis, cruse/, glabrata и parapsilosis.
Нозокомиальный аспергиллез в последнее время также стал частой причиной тяжелых заболеваний легких, кожи и центральной нервной системы, которые встречаются у пациентов с иммунодефицитными состояниями, такими как гематологические опухоли, РДСВ или тяжелые опухоли, пациенты после трансплантации органов или получающие кортикостероиды. Такую инфекцию при жизни очень трудно диагносцировать. Инфекция Aspergillus представляет собой экзогенно приобретаемую флору (ингаляционное вдыхание спор). Нозокомиальный аспергиллез обычно присущ в среде строительства дорог, зданий с загрязненной вентиляционной системой или при употреблении в пищу немытых растений. Большинство инфекций обусловлены A.fumigatus, хотя и другие штаммы, например A.flavus также способны вызвать заболевание. Пациенты также могут быть содружественны с этими микроорганизмами (колонизированы) и не проявлять симптоматики заболевания. Обычно дыхательные пути реципиентов легких колонизированы с Aspergillus, но чаще всего это состояние преходяще и не вызывает инфицирования. Cahill и сотр. (5) выделили Aspergillus из дыхательных путей у 69 из 151 (46%) реципиента. Пострадавшие от утопления подвержены риску развития колонизации/инфекции Aspergillus нижних дыхательных путей. Во время несчастного случая пострадавшие могут приобрести споры Aspergillus, которые находятся на поверхности воды (6). '*
Другие патогены: Fusarium, являющийся причиной тяжелейшей болезни с высокой летальностью; Criptococcus, Trichosporon beigelii, Penicillinum и Мисог - все они являются патогенами, которые в основном поражают пациентов с иммунодефицитными состояниями или нейтропенией. При непроведении лечения таких инфекций пациенты погибают. Pneumocystis carinii также не попадает в разряд грибов, согласно классификации. В 1980-х годах этот возбудитель очень часто являлся причиной развития тяжелого РДСВ (7). Ипользование профилактических мероприятий в середине 1990-х годов (курс котри-максазола) и высоко активной антиретровирусной терапии (ВААРТ) с использованием ингибиторов протеаз позволило снизить заболеваемость и смертность пациентов с РДСВ. Сегодня наиболее частой причиной дыхательной недостаточности с РДСВ является бактериальная пневмония (8).
К другим грибкам, которые иногда являются причиной инфекции, относят дрожжи Malassezia furfur и штаммы Rhodotorula, обычно встречающиеся при катетеризационном инфицировании. ,
Криптококкоз: Менингит - главное проявление криптококкоза. Легочной бластоми-коз является причиной острого или хронического воспалительного процесса в легких. Гистоплазмоз и Кокцидиоидомикоз являются двумя наиболее устойчивыми микозами.
В таблице 1 представлены наиболее важные высоко инвазивные грибковые инфекции у пациентов с иммунодефицитными состояними.
Диагноз
Нередко установка диагноза затруднительна. При аутопсии наиболее частыми невыставленными диагнозами являлись тампонада сердца и грибковая инфекция с полиорганной недостаточностью (10). Грибковая инфекция легких была обнаружена во всех случаях. Клинические проявления такого поражения неспецифичны и для верификации диагноза необходима комбинация клинических данных с микробиологическим, гистологическим, радиологическим и серологическим подтверждением.
Таблица 1: Наиболее важные высоко инвазивные грибковые инфекции у пациентов с иммунодефицитными состояними (модифицировано из Denning et all. (9)).
Штаммы Candida
Штаммы Aspergillus
Виды пациентов
Больные после операции в ОИТ
Нейтропения
Парентеральное питание
Ожоги
Новорожденные
Кортикостероидная терапия
Массивная внутривенная терапия
Нейтропения
Трансплантация органов
Кортикостероидная терапия
Ожоги
Хронический гранулематоз
ХОЗЛ
Вариант заражения
Эндогенно
Нозокомиально через руки Сосудистый доступ
Ингаляционно Нозокомиально
Преимущественно поражаемые органы
Почки
Печень и селезенка
Эндофтальм
Эндокардит
Менингит
ЖКТ
Кости (в поздние сроки)
Легкие
Головной мозг Пазухи носа Кожа Кости
Гистологическое исследование достаточно часто используется для доказательства глубоко внедрившейся грибковой инфекции, но является инвазивным методом. В таблице 2 приведен алгоритм диагностики и лечения Candida и Aspergillus инфекции.
Диагноз кандидемии определяется как изолированный при наличии любых штаммов этого рода грибков, обнаруженных хотя бы в одной культуральной пробе крови. Термин «диссеминированный кандидоз» обозначает инфекцию Candida многих неконтактирующих органов и подразумевает распространение патогена через кровь. При этом в 80% случаев наблюдается лихорадка, а в 50% - лейкоцитоз. При отсутствии таких клинических проявлений кандидоза, как кандидозный эндофтальмит, или гистологического подтверждения диагноз устанавливается в основном на положительных результатах культу-ральных проб крови. Однако, возможно наличие системной инфекции и при негативном результате проб крови. Кандидемия - термин, в основном обозначающий гематогенное распространение инфекции, и пациенты с кандидемией могут иметь или уже не иметь диссеминированной инфекции. Положительные пробы крови наблюдаются лишь у 50% пациентов с инвазивным микозом (2).
Кандидозный эндофтальмит чаще возникает у пациентов с отсутствием нейтропении, так как для образования характерного хлопчато-бумажного экссудата вокруг хрусталика необходимо достаточное количество нейтрофилов (11).
Четкая идентификация диагноза при проведении культуральных проб может занять от нескольких дней до нескольких недель. У пациентов с инвазивным кандидозом, поражающим несколько органов, повторные пробы крови часто оказываются стерильными.
Материалом для забора проб из дыхательных путей является мокрота, но для пациен-. тов с иммунодефицитным состоянием предпочтительнее выполнять бронхо-альвеолярный лаваж (БАЛ).
Изолированное выделение штаммов Candida из дыхательных путей может быть расценено, как колонизация дыхательных путей и, в основном, не имеет клинических последствий до тех пор, пока не появится клиническая симптоматика. При использовании оро-фарингеальных противогрибковых аппликаций и смене эндотрахеальной трубки обычно пробы аспиратов дыхательных путей в поиске дрожжевых культур становятся негативными (6).
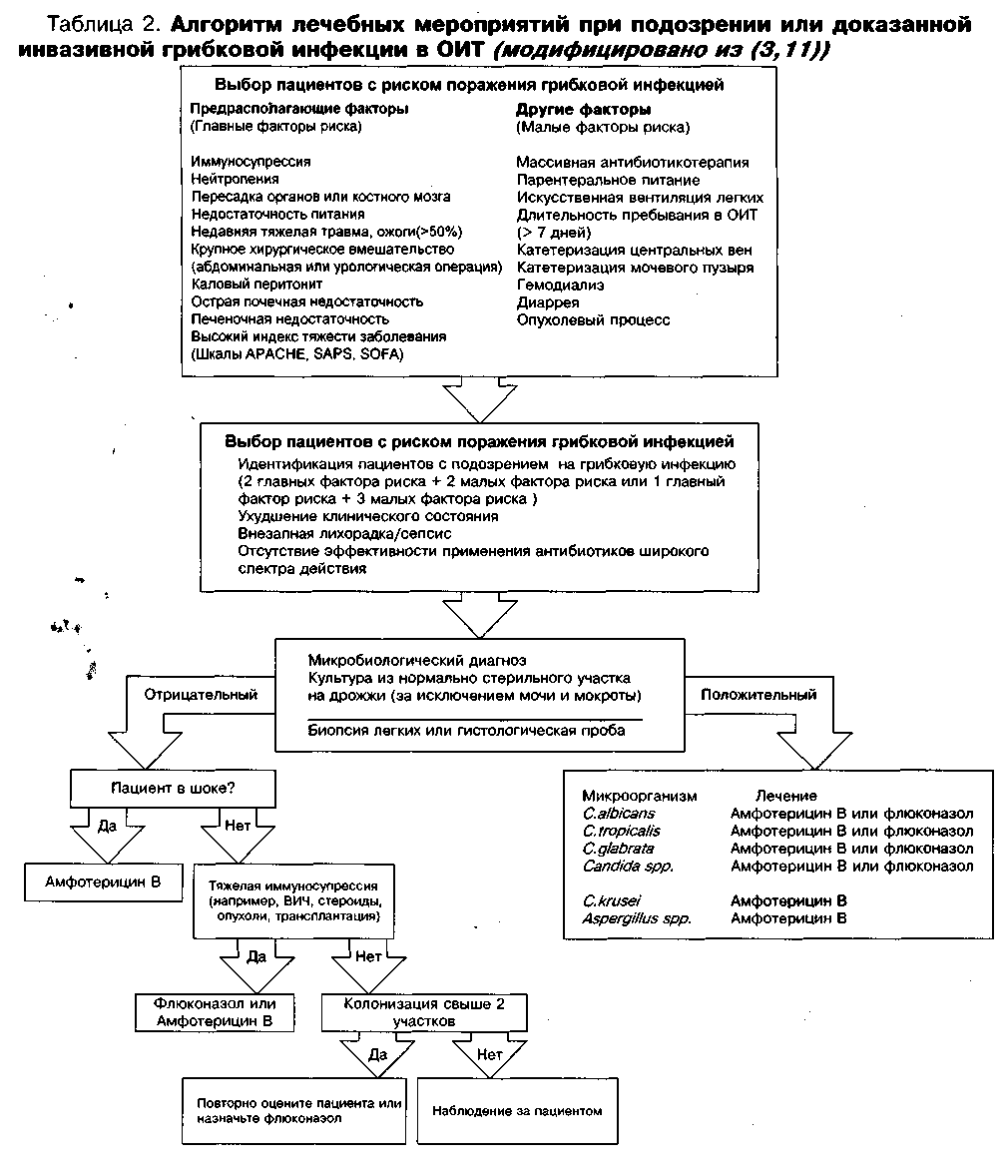
При исследовании биоптатов легких у 40% умерших в ОИТ пациентов, не имевших нейтропении, была обнаружена Candida, но лишь у 8% из них диагноз был поставлен при жизни. Колонизирована была исключительно Candida, несмотря на то, что биопсия выполнялась в различных участках легких. Присутствие же Candida в пробах из дыхательного тракта, не зависимо от количества культуральных проб, не являлось хорошим маркером в диагностике кандидозной пневмонии (12).
Aspergillus редко изолируется. Заболевание легких обычно бывает многоочаговым и прогрессирует до уплотнения сегмента или даже доли легкого. Грибки стремятся проникнуть сквозь стенки сосудов, вызывая тромбозы и соответствующие сосудам зоны инфарктов. Сосудистая инвазия четко проявляется при радиографическом исследовании в виде очагов с центральным некротическим изменением легочной ткани и характерным , ' геморрагическим ободком, которые легко распознаются на компьютерной томограмме (КТ). Если болезнь представляет собой ограниченный процесс, то оперативное вмешательство может стать радикальным методом лечения (6).
Мы исследовали всю последовательную эволюцию легочных инфильтратов после ор-тотопической тересадки печени в течение 4-месячного периода, используя такие методы исследования, как фибробронхоскопия с БАЛ и щеточным забором проб. Существенно значимым результатом оказалось присутствие изолированных колоний штаммов Candida при имеющихся положительных культуральных пробах или гистологическом подтверждении кандидозной пневмонии. По количеству колоний штаммов Aspergillus выставить диагноз было нельзя. В 29 эпизодах (48% пациентов) пневмония оказалась ИВЛ ассоции-- рованной (47%). Pneumocystis carinii была также частой (35%), а другие грибки - относительно редкой причиной пневмонии, в том числе и штаммы Aspergillus, которые были »Д* изолированы в 19% случаев (13). Эти данные подтверждают скорее колонизацию, а не инфекцию, и могут быть применительны и другим локализациям, например, в мочевом пузыре. Для отделений интенсивной терапии Candida albicans наиболее часто присутствует в виде одиночного патогена в моче и в более чем в половине случаев изолирована. Грибковая инфекция мочевыводящих путей является следствием использования мочевых катетеров, но чаще всего она не сопровождается клиническими изменениями и подтверждается только фунгиурией (14).
Уже разработаны серологические и молекулярные методики определения Candida, но пока еще нет количественных показателей нормы (3).
Серологическая диагностика. Антитела к Candida и Aspergillus обнаруживают как у здоровых, так и у инфицированных и колонизированных пациентов, и это не указывает на наличие серьезной инфекции. Более того, такие антитела могут быть не обнаружены у пациентов с иммунодефицитными состояними и слабым иммунным ответом на раннем этапе инфицирования.
Подъем титра антигенов - не всегда обязательный маркер инфекции. Candida и Aspergillus антигены были обнаружены как в крови, так и в моче и смывах при БАЛ.
Тест герметичной трубки представляет собой быстрый и недорогой тест, который дает в результате отличие Candida albicans от других штаммов этого рода грибков. В 90% и более Candida albicans изолируется через 3 часа инкубации в трубке при 37°С.
Молекулярные методики: они чувствительны в отношении C.albicans, A.fumigatus, Pneumocystis carinii.
Факторы риска и летальность
В таблице 2 приведены факторы риска развития грибковой инфекции. Согласно данным анализа множественной логистической регрессии, нейтропения, длительная катетеризация центральных вен, кандидозная колонизация, массивная антибиотикотерапия и гемодиализ являются независимыми факторами риска диссеминации кандидоза (3). Интенсивность кандидозной колонизации, на которую указывает соотношение числа некро-
вяных колонизированных Candida участков к общему числу проб, была больше у пациентов, у которых позже инфекция развилась (15). При диссеминации процесса грибковой инфекции летальность является самой высокой среди всех инфекционных агентов в ОИТ. Причинами этому являются тяжесть заболевания, сопуствующая патология, трудности ранней диагностики и ограниченная по эффективности терапия (16). Общие показатели летальности колеблются в пределах от 25% до 60% в зависимости от вида исследований и исследуемой популяции. Общая летальность критических больных с кандидемией без нейтропении составила 56% (17). Частота составила 1 пациент на 500 поступавших в ОИТ. При наличии кандидемии оценка по APACHE ll>20 баллов соответствовала большей летальности. Проведение «раннего» лечение (<48 часов от начала кандидемии) повышало вероятность выживания.
Штаммы Aspergillus являются второй наиболее частой группой грибковых патогенов, преимущественно поражающих легкие, и приводящих к летальности, достигающей 100%. С Aspergillus связывают более 13% всех летальных исходов после трансплантаций. Заболевание становится инвазивным у пациентов, которые в течение первых 6 месяцев после трансплантации стали колонизированы A.Fumigatus (5).
Лечение ' .
Профилактика: системные профилактические мероприятия не рекомендуются пациентам общего хирургического профиля. В некоторых центрах трансплантации печени противогрибковая профилактика проводится. Флюконазол профилактически эффективен у реципиентов костного мозга и у раковых больных с нейтропенией (3).
Высокий уровень летальности при кандидемии, трудности в прогнозировании диссеминации кандидоза при отсутствии лечения или при назначении системно менее токсичного противогрибкового препарата флюконазола - все это приводит к неизбежному возникновению эпизодов кандидемии, требующей эффективного лечения (18). ,
Таблица 3. Показания для проведения эмпирической противогрибковой терапии (адаптировано из Рекомендаций рабочей группы Британского Общества Антимикробной Химиотерапии)
• Клинически нестабильные недоношенные новорожденные с кандидурией или поражением кожи, колонизированной Candida
• Пациенты высокого риска с кандидурией и тяжелым клиническим состоянием
• Пациенты группы риска с хотя бы одной Сзяо'/Ь'з-положительной культуральной пробой крови
• Выделение Candida с любого стерильного участка (за исключением мочи) '
• Микроскопическое подтверждение присутствия дрожжей в стерильной пробе
• Пациенты группы риска с гистологическим подтверждением наличия дрожжей или мицелия в пробах тканей
Амфотерицин В. Используется при системной грибковой инфекции в течение не ме-iee 30 дней. Этот полиеновый препарат обладает очень широким противогрибковым ;пектром активности. Рекомендуемые дозы: 0,3-0,7 мг/кг/день в течение от 7-10 дней до \ недель. Наблюдались токсические осложнения в виде лихорадки, озноба, тошноты, )воты, гипотензии и поражения канальцевого эпителия почек. Токсичность может быть ;нижена предварительным назначением натрий-содержащих препаратов (инфузия 500 лл физиологического раствора) или пентоксифиллина.
Липосомальные препараты Амфотерииина В обладают таким же спектром противогрибковой активности, но менее токсичны и могут назначаться в больших дозах. В настоящее время используется три препарата этой серии.
Abelcet® (комплекс амфотерицина с крупными липидами, ABLC), структура которого представляет собой коллоидную ленту. Препарат быстро выводится через печень и селезенку, так как имеет высокую молекулярную массу (11000 нм), поэтому в крови его концентрация низка.
AmBisome® (однослойный липосомальный амфотерицин В, LAMB), представляет собой мелкие липосомальные сферы диаметром 80 нм. Это позволяет препарату находиться в крови в большой концентрации, избегая тотального фагоцитарного захвата его макрофагами.
AmphociB) (коллоидно дисперсный амфотерицин В, ABCD) состоит из коллоидных дисперсных дисков. Для него характерна меньшая пиковая концентрация в крови, чем у амфотерицина В, но значительно дольше период полураспада.
Флюконазол: Противогрибковый триазол флюконазола все шире используется при лечении кандидемии. Механизм действия основан на блокировании биосинтеза стерола за счет ингибиции фермента цитохрома Р450 грибков. Обладает высокой биодоступностью и не зависит от кислотности желудочного сока. Возможно внутривенное применение. Предпочтителен при патогенной Candida albicans. Однако флюконазол неактивен в отношение нитчатых грибков и мало эффективен в отношение Candida cruse/. Рекомендуемые дозы широко варьируют в зависимости от страны, в которой используется препарат. Отмечено развитие невосприимчивости Candida albicans и Candida glabrata при длительном использовании препарата. Обычной дозой в странах Европы считается 400 мг в день, и при кандидемии терапия продолжается в течение 10-14 дней. Vincent и соавт. (3) рекомендуют терапию флюконазолом начинать с 600-800 мг/день внутривенно в течение 3 дней с последующим переходом на пероральный прием препарата по 400 мг/день или продолжение в/в инфузий в такой же дозе.
Флюцитозин используется при тяжелой гематогенной инфекции в комбинации с ам-фотерицином В или флюконазолом. Уровень его концентрации в крови должен монито-рироваться, так как имеются сообщения о его миелотоксичности. Флюцитозин должен назначаться при тяжелых инфекциях, вызванных C.lusitania или С.glabrata (11).
Сопротивляемость
В большинстве случаев кандидемия вызывается С.albicans, но при профилактической терапии флюконазолом часто наблюдается \\e-albicans кандидозная инфекция. Это имеет важное значение, так как штаммы Candida не albicans вида становятся невосприимчивы к терапии противогрибковыми препаратами, содержащими азоловую группу. В таблице 4 представлено несколько стратегических предложений по предотвращению развития сопротивляемости грибковой инфекции.
Перспективы
Повышение частоты возникновения системной грибковой инфекции, в основном Candida, не только у пациентов с иммунодефицитными состояними, но и у всех пациентов в ОИТ, а также рост заболеваемости и смертности убеждают в соблюдении осторожности с этими патогенами, особенно учитывая развитие сопротивляемости инфекции к азол-содержащим лекарственным препаратам, которые стали широко использоваться. Трудности при диагностике диссеминированного кандидоза требуют тщательной идентификации пациентов с высоким риском развития инфекции и раннего использования профилактического лечения. С.albicans может являться причиной нозокомиальной инфекции. Универсальные профилактические противоинфекционные мероприятия, например, мытье рук, позволяют снизить вероятность возникновения нозокомиального инфицирования (21).
Таблица 4. Рекомендации по преодолению сопротивляемости грибков
(адаптировано из Alexander и соавт.(20))
Стратегия
Улучшение иммунитета"
Соответствующие дозы и длительность терапии
Лекарственная профилактика
Повышение активности и доставки лекарственных препаратов
Хирургия
Комбинированная терапия Поиск лекарственных препаратов Фунгицидные средства
Способ
Цитокины
Клинические исследования
Исследования в группах пациентов с высоким риском
Липидные формы,
поиск новых форм
Радиологическая диагностика
Амфотерицин В, флюцитозин, азолы
Новые агенты
Липидные структуры и другие агенты
Возникновение одного или более случаев аспергиллеза в ОИТ должно немедленно возбудить поиск инфекции в вентиляционной системе и других потенциально возможных источниках спор этого патогена (21).
Тщательный контроль за проведением культуральных проб у пациентов с высоким риском развития грибковой инфекции способствует ранней диагностике грибковой инфекции (22). Роль противогрибковой профилактической терапии у пациентов в ОИТ без нейтропении остается вопросом споров.
Литература
1. Beck-Sague С, Jarvis WR. Secular trends in the epidemiology ofnosocomial fungal infections in the United States 1980-1990. J Infect Dis 1993;167:1247-1251
2. MG Petri, J Koning., HP Moecke et al. Epidemiology of invasive mycosis in ICU patients: a prospective multicenter study in 435 non-neutropenic patients. Intens Care Med 1997;23:317-25
3. JL Vincent, E Anaissie, H Bruining et al. Epidemiology, diagnosis and treatment of systemic Candida infection in surgical patients under intensive care. Intens Care Med 1998;24:206-216
4. Vincent JL, Bihari DJ, Suter PM et al. The prevalence ofnosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study. EPIC International Advisory Committee. JAMA 1995;274:639-644
5. Cahill BC, Hibbs JR, Savik К et al. Aspergillus airway colonization and invasive disease after lung transplantation. Chest 1997;112:1160-4
6. L Silvestri, D.Mur Laffon, A.Gullo Antifungals agents In: Infection Control in the Intensive Care Unit. Eds. HKF van Saene, L Silvestri, M.A. de la Cat. Springer. Milano. 1998;50-76
7. A Torres, M EI-Ebiary, R Marrades et al. Aetiology and prognostic factors of patients with AIDS presenting life-threatening acute respiratory failure. EurRespirJ 1995;8:1922-8
8. С Alves, JM Nicolas, JM Miro eta/. Reappraisal or the etiology and prognostic factors of life-threatening acute respiratory failure in HIV-Infected patients in the HAART era. E Respir J (in press)
9. Denning DW. Epidemiology and pathogenesis of systemic fungal infections in the immunocompromised host. J Antimicrob Chemother 1991;28:1-16
10. J Roosen, E Frans, A Wilmer et al. Comparison of premortem clinical diagnoses in critically ill patients and sub subsequent autopsy findings. Mayo Clin Proc 2000;75:562-7
11. Pittet D, Anaissie E, Solomkin JS. When to start antifungal therapy in the non-neutropenic critically ill? In: Year Book of Intensive Care and Emergency Medicine. De. JL Vincent. Springer. Berlin. 1996;567-77
12. M EI-Ebiary, A Torres, N Fabregas et al. Significance of the isolation of Candida species from respiratory samples in critically ill, non-neutropenic patients. An immediate postmortem study Am J Respir Crit Care Med 1997; 156:583-90
13. A Torres, S Ewig, J Insausti, et al. Etiology and microbial patterns of pulmonary infiltrates in patients with orthotopic liver transplantation. Chest 2000; 117:494-502
14. MJ Richards, JR Edwards, DH Culver et al. Nosocomial infections in medical intensive care units in the United States. Crit Care Med 1999;27:887-92
15. Pittet D, Monod M, Suter PM et al. Candida colonisation and subsequent infections in critically ill surgical patients. Ann Surg 1994; 220:75 1-8
16. Pittet D, Li N, Woo/son RF et al. Microbiological factors influencing the outcome ofnosocomial bloodstream infections: a 6-year validated, population based model. Clin Infect Dis 1997;24:1068-78.
17. Nolla-Salas J, Sitges-Serra A, Leon-Gil С et al. Candidemia in non-neutropenic critically ill patients: analysis of prognostic factors and assessment of systemic antifungal therapy. Study Group of Fungal Infection in the ICU. Intens Care Med 1997;23:23-30
18. Edwards JE Jr. Invasive Candida infections -evolution of a fungal pathogen. N EnglJ Med 1991;324:1060-2
19. British Society for Antimicrobial Chemotherapy Working Party. Management of deep Candida infection in surgical and intensive care unit patients. Intens Care Med 1994;20:522-8
20. Alexander BD, Perfect JR. Antifungal resistance trends towards the year 2000. Implications for therapy and new approaches. Drugs 1997;54:657-78
21. Rogers TR. Nosocomial fungal infections in intensive care unit patients. In: Infection Control in the Intensive Care Unit. Eds. HKFvan Saene, L Silvestri, M.A. de la Cal. Springer. Milano. 1998;144-51
22. PA Lipsett. Fungal infections in critically patients. In: Year Book of Intensive Care and Emergency Medicine. De. JL Vincent. Springer. Behin.2000; 135-43
УВАЖАЕМЫЕ ЧИТАТЕЛИ!
Издательством Северного государственного медицинского университета
выпущена в свет книга «Профессора СГМУ в 2000 году» Автор Г.С. Щуров
Эта книга уникальна. Ничего подобного ранее не выпускалось не только в Архангельске, но и в России в целом. В прекрасно изданном, «одетом» в суперобложку шестисотстраничном томе показаны семейные традиции, учебная деятельность, а также научные, культурные, спортивные интересы 66 профессоров, которые работали в СГМУ в 2000 году, описан процесс формирования их личности. Здесь есть также краткие сообщения обо всех 80 профессорах, которые когда-либо работали в вузе в период с 1932
года.
Книга привлекает к себе внимание и тем, что создана человеком, который знал и знает практически всех, о ком идет в ней речь. Написанная с уважением и любовью, она читается «на одном дыхании» не только «героями повествования», но и их учениками, сегодняшними студентами университета. Издание богато иллюстрировано, здесь использованы 619 фотографий. В основном это интереснейшие снимки из домашних архивов,
которые до того нигде не публиковались. Книга «Профессора СГМУ в 2000 году» посвящена 70-летию вуза, которое будет отмечаться в Архангельске в конце следующего года. Сейчас профессор Щуров заканчивает работу над еще одним юбилейным изданием, посвященным истории АГМИ—АГМА—СГМУ.
Издательский центр СГМУ принимает заказы на эту книгу, готов рассмотреть Ваши пожелания и предложения
по адресу:
163061, Архангельск, пр. Троицкий, 51, каб. 330.
Телефоны для справок (8182) 20-61-90, 64-03-42
E-mail: pub@asma.ru
ИНФУЗИОННАЯ ТЕРАПИЯ ОЖОГОВЫХ ПАЦИЕНТОВ
Анна Дж. Сутклифф ( Бирмингем, Великобритания)
Введение
Выживаемость при ожоговой травме повышается (1), но до сих пор остается серьезной проблемой (2). Даже сейчас реанимационные показатели иногда оставляют желать лучшего (3).
В 1981 году Pruitt написал «Целью инфузионной терапии ожоговых пациентов является поддержание функций витальных органов при внезапно возникших или отсроченных физиологических потерях жидкости. Объем, которого следует придерживаться при этом, зависит от тяжести травмы, возраста, физиологического состояния, сопутствующих повреждений, и истинный объем жидкости при проведении терапии подбирается индивидуально, в зависимости от реакции организма на травму и лечение» (4). Слова этого автора остаются верными и сегодня. С тех пор, когда они были написаны, были разработаны новые искусственные коллоиды и альтернативные методы мониторинга. К сожалению, консенсуса в вопросе, какие жидкости должны использоваться и как должен монитори-роваться их терапевтический эффект, до сих пор не достигнуто.
Исторические перспективы
В течение последних 50 лет используется много формул для расчета инфузионной терапии ожоговых пациентов. Наиболее широко применяется Паркландская формула, предложенная Baxter и Shire в конце 60-х годов (6). Согласно этой формулы используются только кристаллоиды в течение первых 24 часов. Она очень популярна в Северной Америке. В Европе используют формулу, включающую как кристаллоиды, так и коллоиды. Коллоиды используются в течение первых 24 часов после получения ожоговой травмы до настоящего времени.
Формулы стали разрабатывать потому, что объем и скорость потерь жидкости при ожоговой травме стали прогнозируемыми. Чем больше предлагалось формул, тем менее сложным становился клинический мониторинг. Для проведения адекватных реанимационных мероприятий обычно было достаточно таких показателей, как частота пульса, кровяное давление, гематокрит, диурез и иногда центральное венозное давление. В 1973 году был впервые описан комплекс гемодинамических (6) нарушений и изменения транспорта кислорода (7), которые развиваются при ожоговой травме. В раннем постожоговом периоде сердечный выброс и ударный объем снижаются, а частота сердечных сокращений и системное сосудистое сопротивление повышаются. Эти изменения указывают на наличие гиповолемии при условии нормальной функции сердца. Спустя примерно 48 часов сердечный выброс повышается выше нормы, а системное сосудистое сопротивление падает ниже нормы. Такие изменения могут быть следствием различных механизмов, наиболее значимым из которых является нейрогуморальный ответ на ожоговую травму. В раннем ожоговом периоде доставка кислорода снижается, а потребление и экстракция его тканями увеличивается. Спустя 48 часов потребление кислорода начинает расти в соответствие с увеличением сердечного выброса. Быстрый летальный исход при ожоговой травме связан с прогрессивным падением сердечного выброса и ударного объема.
Гемодинамические нарушения и изменения транспорта кислорода и сейчас трактуются подобным образом, хотя у исследователей есть дополнительные взгляды на те различия, которые сравнивают у выживающих и погибающих ожоговых пациентов (3). Их немного (8), но не по всем показателям (9). Анестезиологи ожоговых отделений считают, что функция миокарда угнетается сразу после получения ожога и это сочетается с развивающейся гиповолемией, которая способствует раннему падению сердечного выброса.
Ожоговая травма влечет за собой развитие системного воспалительного ответа с повышением капиллярной проницаемости (КП) как в раневых, так и неповрежденных тканях. Увеличенная КП сохраняется в течение 48 часов в обожженных тканях, а в неповрежденных в течение 24 часов нормализуется (8).
Ключевые положения 2001 года
• Для проведения реанимационных мероприятий ожоговым пациентам продолжает использоваться формула инфузионной терапии
• Рекомендуемый мониторинг часто бывает ограничен оценкой витальных функций и диурезом, хотя в последнее время появилось много сообщений об использовании флотирующего катетера в легочной артерии (ФКЛА), который повышает адекватность заместительной инфузионной терапии
• До сих пор не ясно, отличаются ли исходы ожоговой травмы при лечении ее в течение первых 24 часов только кристаллоидами или сочетанием последних с коллоидами
• Гипертонический раствор хлорида натрия и/или синтетические коллоиды теоретически имеют преимущества, но пока нет клинических доказательств улучшения результатов лечения ими ожоговых пациентов по сравнению с кристаллоидами
Эти важные положения должны более широко обсуждаться, чтобы выработать необходимые четкие рекомендации по рациональному подходу в заместительной инфузионной терапии ожоговых пациентов.
Формулы инфузионной терапии ожоговых пациентов: состоятельны ли они для 21 века?
Большинство протоколов заместительной инфузионной тактики основаны на формулах, которые учитывают вес пациента и процент ожоговой поверхности (исключая эритему). Обычно объем вводимой жидкости соответствует величине ее потерь. В течение первых 8 часов после получения ожоговой травмы это самое важное, в последующие 16 часов значение этого принципа уменьшается. Обязательно идет отсчет времени с момента получения ожога и если введение жидкости начинается отсроченно, то необходимый объем ее, рассчитанный на первые 8 часов, достигается увеличением скорости ин-фузии. Это имеет 2 нюанса. Во-первых, пока пациент не будет госпитализирован в специализированный ожоговый центр, его ранней терапией занимается неспециалист. Во-вторых, чаще всего расчетные объемы инфузии больше, чем назначаемые неспециалистами в лечении ожогов. Ошибка в оценке веса пациента или площади ожоговой поверхности приводит к недостаточному или избыточному объему инфузии.
Перед транспортировкой пациента в специализированное отделение процент поверхности небольших ожогов переоценивается в рассчете на то, что размеры ожога увеличиваются. Обычно назначаемые объемы инфузии неточны в пересчете на площадь ожоговой поверхности. Примерно половина пациентов получает более 125% расчетного объема жидкости, а в нескольких случаях отмечен ее избыток вплоть до 20-кратного превышения. Так как большинство ожогов небольшие, то дополнительный инфузионный объем не приводит к избыточной нагрузке. Однако в дальнейшем 21% пациентов получает менее 75% расчетного объема (4). Недостаточная по объему инфузия встречается чаще у пациентов с обширными ожогами и представляет несомненную значимость, так как такие пациенты имеют самый высокий риск развития полиорганной недостаточности (ПОН). Процент летальности и вероятность развития ПОН пропорционально увеличиваются с возрастом и размерами ожога (10). В Великобритании обширные ожоги являются относительно редкой травмой.
Качество лечебной тактики неожоговой травмы улучшилось за счет повышения безопасности проведения необходимой адекватной инфузионной терапии. Ее объем монито
рируется различными инвазивными и неинвазивными способами. Терапия ожогов может стать более качественной, если врачи будут уметь точно оценивать размеры ожога, в первую очередь, это относится к лечению обширных ожогов, когда требуется инфузион-ная терапия. Путем более интенсивного мониторинга, применяя методики, используемые при неожоговой травме (11), мы можем снизить относительную неточность расчетов в имеющихся формулах.
Как должен мониторироваться объем инфузии ожоговых пациентов?
По сравнению с показателями 20-летней давности состояние фатальной ожоговой травмы изменилось. Сегодня ингаляционное поражение и легочная патология стали частыми причинами смерти пациентов (2). Пациентам с ожогом дыхательных путей требуется назначение большего объема инфузии, также как и при лечении поражений электрическим током или неожоговой травмы, которые являются причинами развития кровотечений. В разрез с традиционными представлениями (12) потребность в жидкости при неосложненной крупной ожоговой травме непредсказуема (13). Более того, витальные функции и диурез неадекватно оцениваются и измеряются при адекватно проводимой терапии (9). Постепенно рекомендуемое использование ФКЛА становится рутинным (9,13).
Практические врачи полагают, что инвазивные методики мониторинга увеличивают количество осложнений. В частности, подразумевают катетеризационный сепсис у ожоговых пациентов, особенно, если катетер установлен через обожженные ткани, которые через несколько дней инфицируются. В раннем полеожоговом периоде, однако, обожженные ткани остаются стерильными. Риск инфицирования не должен быть противопоказанием к использованию инвазивного мониторинга и инфузионной терапии.
Для оценки волемии и состояния микроциркуляции предлагается использование методики транспульмонального разведения с помощью катетера с двумя индикаторами (14). Методика измеряет внутригрудной объем крови, который коррелирует с величиной сердечного выброса. По этой методике обычно получают завышенный объем необходимой инфузии, чем прогнозируемый по формуле Паркланда. Методика подразумевает использование двух фиброоптических термисторных катетеров, устанавливаемых в центральную вену и артерию, что сохраняет риск развития инфицирования.
Что лучше включать в инфузионную терапию: кристаллоиды или коллоиды?
Количество публикаций по сравнению использования изотонических кристаллоидов в комбинации с коллоидами в терапии ожоговой травмы очень велико, чтобы сделать единое заключение. Однако, если размер ожоговой поверхности установлен точно, а расчет инфузионной программы адекватен и подкреплен соответствующим надежным мониторингом, то выбор инфузионного раствора имеет незначительное влияние на исход заболевания. Тем не менее, всегда присутствует ощущение, что некоторые инфузионные среды лучше других. В частности, большинство вводимых внутривенно жидкостей покидают сосудистое русло вследствие повышенной капиллярной проницаемости в интер-стиций, усиливая его отек. Избыточная отечность тканей может увеличить риск легочных осложнений, нарушить состоятельность энтерального питания и тканевого кровотока конечностей, ухудшает состояние требующих подсушивания поверхностных ожоговых тканей. И наконец, выбор инфузионных растворов не должен опираться только на результаты исследований летальности и исходов.
Какие растворы должны использоваться для инфузионной терапии ожоговых пациентов?
Гипертонический раствор хлорида натрия (ГРХН) - наиболее привлекательная альтернатива изотоническим кристаллоидам, так как трансфузируемый объем теоретически
меньше. В проспективном исследовании по сравнению использования ГРНХ и раствора лактата Рингера (ЛР) в течение первых 24 часов после получения ожоговой травмы не выявило явных преимуществ какого либо раствора (15). Некоторые показатели учитывались плохо. .Во-первых, конечным пунктом выбора при мониторировании инфузионной терапии являлись диурез и дефицит буферных оснований. Если осмолярность плазмы была выше 340 мОсм/кг, то использовали ЛР вместо ГРНХ. Если имелись «клинические показания», в основе которых лежали размер ожоговой поверхности, возраст пациента и наличие ингаляционного поражения, устанавливался ФКЛА. Во всей популяции исследования не было обнаружено отличий по увеличению веса (то есть, отека) и общему объему необходимой инфузии. Однако в группе с использованием ГРНХ оказалось возможным применение больших объемов энтерального питания, учитывая потенциально лучшую защиту функции кишечника. У пациентов с ФКЛА в течение первых 24 часов давление заклинивания легочной артерии (ДЗЛК) было ниже в группе пациентов с инфузией ГРНХ при более низких показателях сердечного индекса и более высоких показателях системного сосудистого сопротивления. В этой группе результаты были неистинными, так как пациентам в инфузию включалась свежезамороженная плазма с целью поддержания уровня альбумина плазмы выше 2 г/л. А в группе с инфузией ЛР пациентам потребовалось примерно в два раза больше коллоидов. Хотя это отличие незначительно статистически, тем не менее его не следует игнорировать из-за влияния альбумина на кол-лоидно-онкотическое давление. Несмотря на то, что применение ГРНХ не обнаружило преимуществ перед ЛР, коллоиды назначались, но не все пациенты мониторировались «адекватно», поэтому интерпретировать результаты этого исследования трудно. Этот пример приведен для того, чтобы представить, как сложно определить идеальность замещающей инфузионной терапии.
В серии публикаций ретроспективных исследований отмечается опасность применения ГРНХ (16). В них ЛР назначался в соответствие с формулой Паркланда, а объем ГРНХ рассчитывался по уровню натрия в плазме. Коллоиды дополнительно не назначались, а диурез не использовался в качестве метода мониторинга инфузионной заместительной терапии. В последующие 24 часа назначались альбумин и гипотонические кристаллоиды. В группе пациентов с инфузией ГРНХ обнаружено 4-х кратное увеличение частоты развития острой почечной недостаточности и двукратное превышение показателя летальности по сравнению с группой пациентов, получавших ЛР. Существует множество объяснений этих результатов, поэтому использование ГРНХ в первые 24 часа после ожога остается спорным. Однако во многих реанимационных ожоговых центрах в течение первых 8 часов после ожога используют ГРНХ и объясняют это отсутствием повышения показателей летальности или возникновения почечной недостаточности.
Теоретически обосновать преимущества применения того или иного раствора без проспективного рандомизированного контрольного исследования очень сложно. Подбирать адекватную инфузионную терапию следует очень тщательно, оценивая исходы заболевания и сравнивая истинную летальность с прогнозируемой.
Несколько проще обстоит дело с выбором коллоидов. Согласно сообщению группы Corchrane назначение альбумина для инфузионной терапии ожогов не имеет преимуществ перед синтетическими коллоидами и даже повышает показатели летальности (17). К такому жесткому выводу они пришли потому, что это обзор включал все многообразие типов исследований. Во многих исследованиях отмечается, что альбумин не используется в клинической практике. Дело в том, что альбумин даже от одной фирмы-производителя может вызывать различные сердечно-сосудистые нарушения (18). Об этом стали сообщать, так как альбумин до недавних пор являлся золотым стандартом по сравнению с другими используемыми коллоидами.
В настоящее время широко пересматривается отношение к растворам альбумина как коллоиду, который влияет на сердечно-сосудистую систему. Главным аргументом против использования альбумина являются недостаточный гемодинамический эффект в течение первых 24 часов после ожога и высокая стоимость. Практически все синтетические кол-
лоиды сравнивали с альбумином в плане инфузионной терапии ожоговых пациентов. Гидроксиэтилкрахмал (ГЭК) превосходит альбумин по гемодинамическому эффекту (19). Хотя средний молекулярный вес ГЭК теоретически идеален для лечения ожогов, его растворы содержат молекулы с различным молекулярным весом. Более мелкие из них не дают гемодинамического эффекта, а более крупные приводят к нарушениям коагуляции. В исследованиях на животных была доказана идеальность и превосходство ГЭК со средним весом над применением альбумина в лечении ожоговой травмы (20). Это подтверждено тем, что средняя фракция ГЭК не только остается в сосудистом русле, но и закрывает поры капилляров, что восстанавливает микрососудистый кровоток. Таким образом, следует полагать, что средние фракции ГЭК способны не только снизить потребность в жидкости при инфузионной терапии ожоговых пациентов, но и уменьшить тяжесть отека интерстициальных тканей. Однако не следует забывать главное правило: теоретические сведения не всегда совпадают с клиническими результатами. ,
••»,
Заключение ' . , 8
Идеального раствора для проведения инфузионной заместительной терапии ожоговых пациентов пока не найдено. Опытные врачи с успехом используют то, что есть сейчас. В настоящее время точная оценка размеров ожога и тщательный подсчет необходимого объема инфузионных растворов находятся в тесной связи с мониторингом сердечного индекса, наполненности сосудов и тканевой оксигенации, что позволяет точно контролировать назначения инфузионной программы и прогнозировать наличие реальных возможностей улучшения исходов ожоговой травмы. Формулы для подсчета необходимого объема жидкости для инфузии являются лишь первым шагом в лечении ожоговых пациентов. „ . .:. -„ «
Ключевым элементом терапии ожоговых пациентов является индивидуальность. Нужна чуткая интуиция при проведении возмещения дефицита жидкости таким пациентам. А обычные расчеты инфузионной терапии для неожоговых пациентов, вероятно, могут вполне быть применимы и для пациентов с ожоговой травмой.
Литература >
1. Ryan CM et a/. Objective estimates of the probability of death from bum injuries. New England J. ofMdine 1998; 338:362-6
2. Schiller WR, Bay RC, McLachlan JG et a/. American Journal of Surgery; 1995:170:696-700 ^,
3. Collis N, Smith G, Fenton OM. A three year retrospective study. Burns 1999; 25:345-51 r~
4. Pruitt BA. Fluid resuscitation for the extensively burned patient. Journal of Trauma 1981; 21: S690-2
5. Holm С Resuscitation in shock associated with burns. Tradition or evidence-based medicine? Resuscitation 2000, 44:157-64
6. Shoemaker WC, Vladeck BC, Bassin R et al. Bum pathophysiology in man. 1. Sequential haemodynamic alterations. Journal of Surgical Research 1973; 14:64 - 73
7. Vladeck BC, Bassin R, Kim SI et al. Burn pathophysiology in man. 11. Sequential oxygen transport and acid-base alterations. Journal of Surgical Research 1973; 14:74 - 9
8. MacLennan N, Heimbach DM, Cullen BF. Anesthesia for major thermal injury. Anesthesiology 1998; 89:749 -- 70
9. Dries DJ, Waxman K. Adequate resuscitation of bum patients may not be measured by urine output and vital signs. Critical Care Medicine 1991; 19:327 - 9
10. Saffle JR, Sullivan JJ, Tuohig GM et al. Multiple organ failure in patients with thermal injury. Critical Care Medicine 1993; 21: 1673 - 83
11. Abou-Khalil B, Scalea TM, Trooskin SZ et al. Critical Care Medicine 1994; 22:633-9
12. Mansfield MD. Resuscitation and monitoring. Balliere's Clinical Anaesthesiology 1997; 11(3): 369-84
13. Gueugniaud P- Y, Bertin-Maghit M. Burn therapy. Current Opinion in Anaesthesiology 1995; 8:187 — 92
14. Holm C, Melcer B, Horbrand F et at. Intrathoracic blood volume as an end point in resuscitation of the severely burned: an observational study of 24 patients. Journal of Trauma 2000; 48: 728 - 34 . ,
15. Gunn ML, HansbroughJF, Davis JW. Journal of Trauma 1989; 29:1261 - 7
16. Huang PP, Stuck/ FS, Dimick AR et al. Annals of Surgery 1995; 221:543 - 57
17. Cochrane Injuries Group Albumin Reviewers. Human albumin administration in critically ill patients: systematic review of randomized controlled trials. British Medical Journal 1998; 317:235 -40
18. Heringlake M, Bruckner S, Schmucker P. Intensive Care Medicine 2000; 26:1011
19. Waxman K, Ho/ness R, Tominaga G et al. Hemodynamic and oxygen transport effects of pentastarch in burn resuscitation. Annals of Surgery 1989; 209:341 - 5
20. Brazeal BA, Honeycutt D, Traber LD et al. Pentafraction for superior resuscitation of the ovine thermal burn. Critical Care Medicine 1995; 23:332-9
ПОСЛЕДНИЕ ДОСТИЖЕНИЯ В ЭТИОЛОГИИ, ДИАГНОСТИКЕ И ЛЕЧЕНИИ ВЕНОЗНОГО ТРОМБОЭМБОЛИЗМА
П, де Мерлуш, Ф.Бхлен (Женеве, Швейцария)
Резюме
Тромбоз глубоких вен (ТГВ) и эмболия легочной артерии (ЭЛА) - достаточно часто встречающиеся клинические проблемы. Оба этих состояния объединяются в одно заболевание - венозный тромбоэмболизм (ВТ), диагностика и лечение которого в течение последних 30 лет прогрессивно улучшается. Новые тесты, такие, как исследование D-димеров и компрессионная ультрасонография нижних конечностей, являются сейчас методами выбора при скрининге ТВГ и ЭЛА. ВТ не является случайным и если он развивается, то необходимо провести исследование в плане возможности исходной тромбофи-лии, хотя это весьма специфично, но может помочь в коррекции лечения и диагностике заболевания пациента и/или семейной патологии. Профилактические или лечебные мероприятия целиком зависят от результатов лабораторных тестов. Кратко затронув тему гемостаза, в нашем обзоре мы попытаемся привлечь внимание анестезиологов к некоторым очень важным концепциям.
Введение
В последнее время диагностика и лечение ВТ изменились коренным образом. Диагностика ТВГ и ЭЛА стала менее инвазивна, проще и безопаснее. В то же время нам стали понятнее многие нарушения свертывания, связанные с ТГВ, и мы можем подходить к лечению пациентов индивидуально. Мы впервые описываем стратегию диагностики ТГВ, обращая внимание на роль D-димеров в большей степени, чем на патологические нарушения гемостаза при ТГВ. Наконец, мы обсудим, насколько выраженные изменения свертывающей системы могут повлиять на процесс лечения. В данной статье нам не удастся уделить внимания новым доступным лекарственным препаратам, которые предотвращают развитие или используются для лечения ТГВ.
Роль D-димеров в диагностике ТГВ
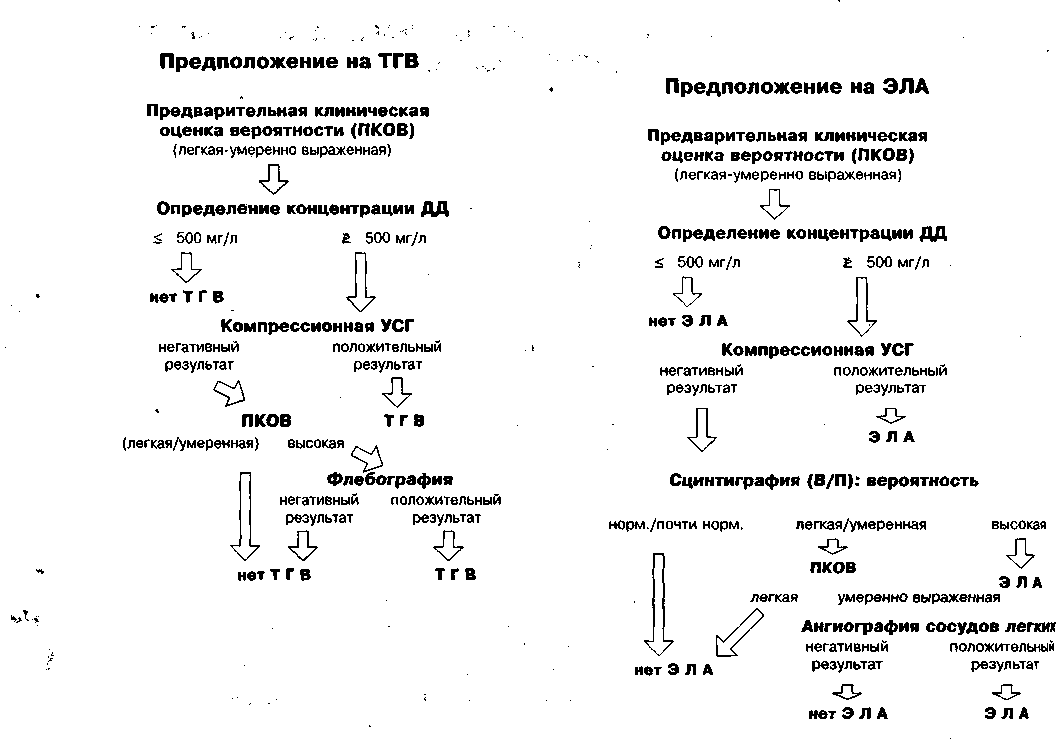
При диагностике ТГВ невозможно обойтись без достаточного минимума лабораторных тестов, так как только клинической оценки этого состояния недостаточно. Более того, для постановки диагноза ТГВ и ЭЛА или его исключения необходима совокупность методов исследования, таких как ультрасонография вен нижних конечностей (УСГ), флебография, оценка вентиляционно-перфузионного соотношения (В/П) легких, компьютерная томография и ангиография. В силу того, что частота ТГВ и ЭЛА в течение последних десяти лет благодаря качественной диагностике постоянно снижалась и составила по последним данным менее 20%, потребовался простой скрининг, чтобы исключить такой диагноз, как ВТ. В амбулаторной практике при наличии симптоматики частично можно использовать исследования концентрации продуктов деградации связанного фибрина и D-димеров (ДД) для уточнения диагноза. Определение концентрации ДД - высоко чувствительный метод, позволяющий исключить диагноз ВТ при снижении количества этих продуктов ниже прогностического уровня. Достоверность этого лабораторного теста по данным многих исследований составляет 98% (1). Анализ концентрации ДД ограниченно специфичен из-за того, что некоторые состояния, такие как хирургическое вмешательства, раковый, инфекционный и воспалительный процессы сопряжены с образованием фибрина и его деградацией. Менее показателен этот тест у пациентов пожилого и старческого возраста. Доступность, простота выполнения и низкие экономические расходы позволяют этому методу стать основным при подозрении на диагноз ВТ (2). Такой простой подход в диагностике, сокращающий инвазивность исследований, представлен на рисунке 1.
13 Зак. 1581
![]()


Финляндия эксклюзивный дистрибьютор торговых марок Blease, Nellcor, Puritan Bennett, предлагает
известные своей надежностью и высоким качеством пульсоксиметры для любых
клинических условий и пульсоксиметрические датчики Nellcor для мониторов
разных производителей, аппараты ИВЛ всемирно
известной марки Puritan Bennett, анестезиологическое
оборудование фирмы Blease, Великобритания
Аппараты ИВЛ Серии 700
Вентиляция по объему и по давлению
PS вентиляция, элементы респираторной механики
Полностью русифицированная версия
Срок автономной работы от внутреннего аккумулятора 2,5 часа
Самодиагностика неисправностей
Собственный поршневой привод «без трения»
обеспечивает пневмосистему аппарата сжатым воздухом.
Высокочувствительный потоковый триггер
Настройка ускорения потока для вентиляции по давлению
В1*Я*«
• Выпускается в 2-х, 3-х и 4-х газовом варианте
• Испарители по выбору (фторотан, изофлуран, энфлуран, севофлуран)
• Широкий выбор пневматических и электронных вентиляторов, включая вентиляторы с цветным графическим дисплеем, SIMV, Pressure Support, встроенной спирометрией
• 2 л абсорбер PEEP клапаном и переключением для работы по полузакрытом, полуоткрытом и закрытом контурам в режиме ручной вентиляции
• Датчик потока с регистрацией малых потоков (LOW FLOW)
• Может комплектоваться кислородно-приводным анестезиологическим отсосом, систем эвакуации отработанных газов и др. аксессуарами
Аппараты ИВЛ Серии 800
• Вентиляция от новорожденных до взрослых пациентов
• Цветной интерактивный дисплей
• Компактная сверхнадежная пневматика и двухпроцессорная электроника обеспечивают точную и чувствительную ИВЛ в максимально широком диапазоне режимов вентиляции
• Новые настройки вентиляции (ускорение потока, чувствительность отсоединения, чувствительность выдоха и др.) обеспечивают лучшую синхронизацию системы пациент-вентилятор
• Интуитивно понятное управление вентиляцией с помощью «touch - screen» дисплея и цифрового переключателя Nellcor
• Система управления и анализа тревог SmartAlert указывает уровень важности каждой тревоги, возможную причину возникновения
и рекомендации по ее устранению, а также фиксирует в журнале тревог в памяти респиратора
Polyomed OY Ltd
Kauppakartanonkatu 7A34, 00930 Helsinki, Finland; tel: +385 9 3444 066, fax: +385 9 3444 067
E-mail: oolvomed@kolumbus.fi
Москва тел/факс: 200-69-16; 797-91-18 С.-Петербург тел/факс: (812) 557 7287; 592 7809 E-mail:aino-ofRce@sovlntel.rii E-mail: pcb00627@admiral.ru

|Щ ДЭ»зЯ» Ж*^Ж
Рисунок 1. Алгоритм диагностики ТГВ и ЭЛА. В обеих ситуациях компрессионная ультрасоно-графия проводится после определения концентрации ДД. Предварительное клиническое обследование имеет важное значение. Могут быть предложены и другие алгоритмы диагностики (3). Если определение концентрации ДД выполняется на первом этапе, то это исследование должно иметь высокую степень чувствительности, близкую к 100%. Если ДД используются на последующих этапах (комбинация ДД с другими диагностическими процедурами), то допускается несколько меньшая чувствительность методики. Результаты исследования ДД трудно сравнивать, так как фрагменты, составляющие ДД, гетерогенны, а антитела имеют различную специфичность, и также перед проведением теста используются различные калибраторы и форматы доступа (4).
Комбинация клинического обследования, определения концентрации ДД и компрессионной ультрасонографии позволяет неинвазивно диагносцировать ВТ у амбулаторных больных с подозрением на это заболевание. Диагностика ВТ на уровне стационара требует доработки алгоритма.
Патофизиология ВТ и концепция тромбофилии
Сейчас стали более понятными механизмы ВТ, а концепция тромбофилии появилась совсем недавно. Это «наследственная или приобретенная патология механизмов гемостаза, предрасполагающая к образованию тромбозов» (5). Рассматривая ВТ с лабораторных позиций, основными отклонениями являются V фактор Лейдена, мутация протромбина G20210A, антитромбин, протеин С, протеин S и наличие антифосфолипидных антител. Учитывая, что такие тесты могут быть выполнены в специализированных лабораториях, необходим тщательный отбор пациентов с подозрением на тромбофилию. Для
подтверждения диагноза тесты можно повторить и провести семейное исследование наследственного нарушения.
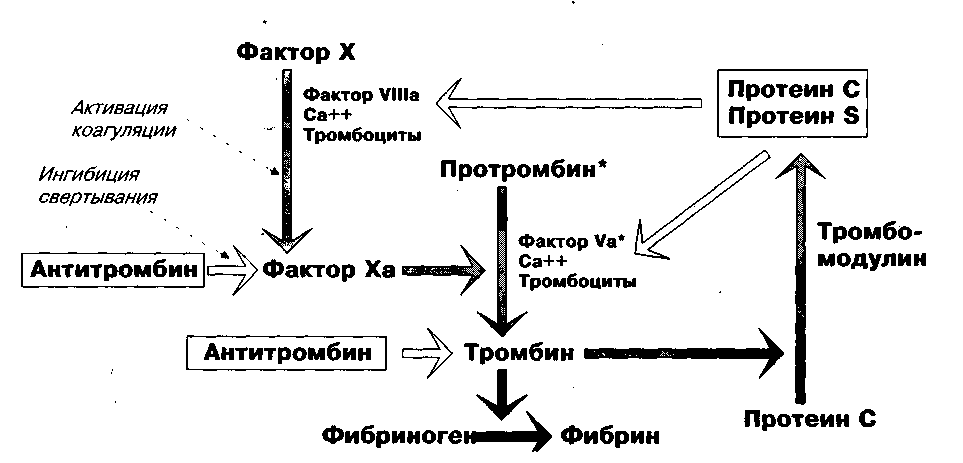
Рисунок 2. Активация или ингибиция свертывания
* Мутации факторов II и V, связанные с ВТ.
*Ч.
Фактор V Лейдена (сопротивление активированного Протеина С)
На поверхности эндотелиальных клеток тромбин в присутствии тромбомодулина активирует протеин С до активной формы (АПС). Последний активирует кофакторы Va и Villa (6). В 1993 году описаны случаи, когда у пациентов имеется сопротивление активации АПС. Наличие такого чаще всего наследственного дефекта предрасполагает к развитию ВТ (6,7). В большинстве случаев сопротивление активации АПС (САПС) вызывается изолированной мутацией фактора V (FV R506Q), который носит название фактор V Лейдена (8). Гетерозиготность по мутантной аллели сопряжена с 5-10 кратным повышением риска развития ВТ, а гомозиготность - с 50-100 кратным.
Мутация FV R506Q в некоторых популяциях присутствует достаточно широко (например, в некоторых регионах Европы - у 15% населения). Это обнаруживается также и среди пациентов с другими генетическими дефектами, такими как дефицит антитромбина, протеина С или S, что усиливает зависимость к тромбофилии не только в среде повышенного риска (рак, оперативное вмешательство, травма, иммобилизация, беременность, гормональная контрацепция или заместительная терапия, ожирение и др.), но и при комплексной и сочетанной генетической патологии (9,10). Значение этой проблемы становится еще более ярким, если учесть, что при различной патологии наличие у пациента более одного, даже умеренно выраженного фактора риска тромбофилии, может привести к тяжелым клиническим проявлениям.
Тесты САПС выполняются несложно. При наличии лаборатории молекулярной биологии подтверждение патологии фактора V элементарно. Для выполнения исследования необходимо учитывать наличие определенных состояний (например, беременность, прием оральных контрацептивов, волчаночного антикоагулянта, повышенная концентрация фактора VIII и др.), которые могут проявляться фенотипом САПС.
Фактор II G20210A
Недавно обнаружена взаимосвязь перемещения нуклеотида G на место А в позиции 20210 в гене протромбина с повышенным риском развития ВТ и увеличенной концентрацией протромбина (7,8)- В таблице 1 представлено превалирование этой мутации среди пациентов с ВТ в Кавказской популяции. У женщин с такой мутацией при приеме оральных контрацептивов имеется риск развития венозного тромбоза сосудов головного мозга (11). На втором месте по частоте после мутации в гене протромбина находится патология фактора V Лейдена, что также повышает риск развития тромбозов. Такие недавние открытия подчеркивают, что все генетические факторы и их взаимодействия нами недостаточно изучены.
Таблица 1. Скрининг по основным тестам тромбофилии. Сравнительная характеристика двух групп: общей Кавказской популяции и среди пациентов с ТГВ
|
Патология |
Присутствие в об. популяции (%) |
Наличие у пациентов с ТГВ (%) |
|
Фактор V R506Q |
3-6 |
20 |
|
Фактор IIG20210A |
1-2 |
6 |
|
Антитромбин |
0,02 |
1 |
|
Протеин С |
0,2 |
3 |
|
Протеин S |
0,1 |
1-2 |
|
Антифосфолипидные антитела |
2 |
4 |
Дефицит антитромбина
Первой причиной тромбофилии была выявлена патология антитромбина (AT), основного ингибитора свертывания. Дефицит AT, вызывающий тромботические осложнения, является редкой формой нарушений (табл.1). Дефицит AT обнаруживают как дополнительное подтверждение у пациентов с высоким риском ВТ (7,12). Лабораторно дефицит AT определяется несложно.
Протеин С
Гетерозиготный дефицит Протеина С (ПС), витамин К-зависимого белка, подтверждает 7-кратное увеличение риска ВТ как в семейной, так и в общей популяции (7). Риск повышается при снижении концентрации ПС. У пациентов с гомозиготным или сложным гетерозиготным ПС может развиться молниеносная пурпура новорожденных, а в дальнейшем при дефиците ПС может возникать тромбоз в начале антикоагулянтной терапии антагонистами витамина К.
Интерпретация результатов лабораторного исследования затрудняется из-за совпадений данных у нормальных и у гетерозиготных пациентов с дефицитом ПС. Также, как и дефицит AT, недостаточность ПС представляет собой генетическое заболевание, эффектно прогрессирующее, но молекулярная характеристика смешана с множеством дефектов.
Протеин S
Протеин S (П8) является неферментным зависимым кофактором, необходимым для антикоагулянтной активности АПС. Более того, П8 сам по себе обладает антикоагулянт-ными свойствами. Также, как и при всех генетических дефектах, маркером, по которому оценивают склонность к развитию ВТ, является исследование связанных с ним факторов
риска, например, САПС. В современных лабораториях для определения свободного и общего ПЗ антигена используют методику ELISA. Существует несколько методик оценки активности ПЗ, но в обычной практике показатель активности ПЗ принят по небольшому соглашению. Тем не менее, диагностика дефицита ПЗ представляет трудности до сих пор.
Антифосфолипидные антитела
В последних обзорах описывается взаимосвязь между ВТ, внутриутробной гибелью плода, антифосфолипидными антителами (АФА) и возможными механизмами развития тромбозов (13,14). Термин антифосфолипиды не совсем точен, так как эти антитела проявляют активность в основном в отношении фосфолипидов, связанных с белками плазмы. Наличие АФА - наиболее определяемый маркер приобретенных нарушений гемостаза, ведущих к развитию ВТ. АФА могут быть обнаружены у пациентов с различной патологией, например, при системной красной волчанке. Если у больного без соответствующей патологии, но с клиническими осложнениями есть АФА, то выставляется первичный антифосфолипидный синдром. Являются ли АФА прямым стимулятором развития тромбозов или можно ли их использовать в качестве протромботического маркера до сих пор не ясно.
АФА гетерогенны и могут обнаруживаться путем коагуляции (волчаночный антикоагулянт - ВА) или иммунологически (в основном - антикардиолипин, АКЛ). Для обнаружения ВА необходимы длительный опыт работы, включая тщательную обработку проб, скрининговые тесты, сочетание экспериментальных и подтверждающих тестов. Индивидуальный подход требуется для выявления АКЛ, даже если есть масса разногласий в использовании различных соответствующих методик (15). Более специфические тесты, такие как определение антир2-СР1 или антипротромбиновых антител, в будущем смогут заменить исследование АКЛ. Для поиска АФА необходимы как коагуляционные, так и иммунологические тесты.
Другие исследования
Другие формы патологии гемостаза (например, повышенная концентрация факторов VIII, IX, XI или гипергомоцистеинемия) также сопряжены с ВТ (16-19). Однако, их место при первичном скрининговом поиске до сих пор дискутируется и в данном обзоре не будут рассматриваться.
Какие пациенты могут быть подобраны для исследования на тромбофилию?
Многие авторы пытались выделить подобную группу пациентов, требующих исследований в отношении тромбофилии (5,7,12,20). До назначения обследования на тромбофилию необходимо исключить такие возможные причины, как рак. После тщательного семейного и персонального анамнеза назначаются скрининговые тесты тем пациентам, которые подходят по критериям, указанным в таблице 2.
Проще, когда у пациента есть семейный анамнез заболевания. Главной причиной, по которой назначают обследование на тромбофилию, является даже не сам пациент, а его асимптомные родственники. Скрининговые тесты на тромбофилию также должны назначаться пациентам с рецидивирующим тромбозом, тем, у кого обычное клиническое и простое лабораторное исследование не выявили данной патологии, или когда тромбоз развивается после минимально провоцирующих ситуаций, например, после путешествий или приема оральных контрацептивов. Наличие предрасполагающих факторов не исключает возможности генетической патологии, особенно у молодых пациентов с несколькими предрасполагающими факторами риска развития тромбофилии. Повторное возникновение тромбоза после длительной ремиссии также не исключает возможности генетиче-
ского дефекта. Действительно, последние начинают манифестировать при появлении провоцирующих факторов.
Таблица 2..Пациенты с венозным тромбоэмболизмом, которым необходимо проведение скрининговых тестов на тромбофилию
• Семейное заболевание венозными тромбозами
• Рецидивирующий идиопатический венозный тромбоз
• Тромбоз, возникающий при обычной провокации (например, при беременности, путешествиях, приеме эстрогенов и др.)
• Тромбоз, возникавший в возрасте до 50 лет
• Сочетанные артериальные и венозные тромбозы
• взаимосвязь тромбоза и внутриутробной гибели плода
• Тромбоз с необычной локализацией (сосуды ЦНС, органов брюшной полости)
• Вызванный кумарином некроз кожи
• Молниеносная пурпура новорожденных
Возраст пациентов - вопрос спорный. Назначая исследование на САПС (21), подразумевают не только для лиц до 50 лет, но и до 70, у которых был эпизод тромбоза, как спонтанно развившегося, так и после минимально провоцирующих моментов.
При наличии сочетанного артериального и венозного тромбоза пациентам также назначают исследование на тромбофилию. Сочетание тромбоза (венозного или артериального) с внутриутробной гибелью плода повышает подозрение на наличие АФА. Врожденное состояние повышенной свертываемости крови может быть причиной повторной внутриутробной гибели плода, но этот вопрос мы не будем рассматривать в данном обзоре. Тромбозы в несвойственных для них местах (например, мезентериальные сосуды) являются показанием для проведения тестов на тромбофилию, но нельзя исключить при этом и такие заболевания, как полицитемия или пароксизмальная ночная гемоглобину-рия. Наконец, существуют такие редко встречающиеся состояния, как кумарин-обусловленный некроз кожи и молниеносная пурпура новорожденных, которые обусловлены дефицитом ингибиторов свертывания.
Список предполагаемых состояний, представленный в табл.2, прост и схематичен. Если состояние здоровья действительно важно для пациента, то необходимо не исключать тестов на тромбофилию, так как это не только клиническая проблема, но и семейная.
Прогресс в лечении ВТ: правильный выбор соответствующему пациенту
Персональное и семейное исследования позволяют подобрать вариант профилактики и лечения пациента, если обнаруживается склонность его к образованию тромбов (12,20). Для гетерозиготных больных по AT, ПС, П8 риск развития тромбоза составляет 1-2% в течение года, а в разновозрастной популяции с отрицательными тестами - 0,1%. Риск развития больше у гомозиготных больных, особенно с сочетанной патологией (7,11), и меньше при двух часто встречающихся нарушениях, мутациях фактора V Лейдена и фактора II G20210A (12). Профилактика и лечение должны быть подобраны в зависимости от типа патологии и количества независимых факторов риска у пациента. Нет ни одного рандомизированного исследования пациентов с наследственными нарушениями, поэтому клинические решения проблемы основываются на оценке тромбоза на разных
его стадиях развития и симптоматичны при развитии кровотечения на фоне приема антикоагулянтов.
Вторичная профилактика '
Пациентам с наличием симптоматики точно установленного заболевания подбирается длительность и интенсивность антикоагулянтной терапии. Например, всем пациентам с врожденной тромбофилией при низком риске кровотечения после первого эпизода тромбоза назначается 6 месячный курс постоянной антикоагулянтной терапии (12,22), и более длительный курс - пациентам с дефицитом AT, ПС, П8, также как и при обнаружении АФА. Пока четко не установлено, что у больных при наличии мутации факторов V Лейдена и фактора II G20210A риск рецидивирования ВТ повышен по сравнению с нормальными пациентами. Более того, при ЭЛА реже присутствует фактор V Лейдена, чем при ТГВ, что предусматривает менее агрессивное лечение (23). Пациентам, у которых в анамнезе было 2 и более эпизодов спонтанного тромбоза, назначают длительную анти-коагулянтную терапию. Поскольку всегда имеется высокий риск развития кровотечения, то антикоагулянтная терапия подбирается индивидуально. По данным последних исследований, чем меньше концентрация INR (от 1,5 до 2,0), тем лучше, меньше риск развития кровотечения (24). Пациентам с двумя и более наследственными нарушениями должно подбираться специальное лечение (11,12,25). Иногда лечение концентратом AT при его дефиците удобно и применимо, если не учитывается соответственная гепаринизация, когда возникает рецидивирующий тромбоз несмотря на адекватную антикоагулянтную терапию, а также перед крупным оперативным вмешательством или родами, если антикоагулянтная терапия проводилась без учета риска развития кровотечения. Назначение концентрата ПС выполняется экстренно у гомозиготных критически больных новорожденных с молниеносной пурпурой и должно быть обдуманно для пациентов с кумарин-обусловленным некрозом кожи.
Первичная профилактика
Среди асимптомных членов семьи важно определить хотя бы один из генетических дефектов (или в семьях с независимо изолированными двумя нарушениями - один или два дефекта). Это может иметь профилактическое значение в ситуациях с высоким риском, так как около 50% эпизодов тромбоза при врожденной тромбофилии обусловлены хорошо известными обратимыми факторами (например, при беременности, хирургическом вмешательстве или иммобилизации). Асимптомным родственникам следует дать рекомендации в отношении клинических проявлений заболевания, которые могут потребовать экстренной медицинской помощи. При приеме оральных контрацептивов или при заместительной гормональной терапии необходимо тщательно оценить соотношение затрат к пользе.
В настоящее время нет сведений по скринингу тромбофилии в общей популяции. Положительные прогностические показатели индивидуальных исследований зависят от наличия патологии в рассматриваемой популяции, при этом не следует забывать о таких редких нарушениях, как тромбоз, обусловленный дефицитом AT, ПС, П8. Иначе обстоит дело с фактором IV G20210A, который обнаруживается в некоторых популяциях. Этот вопрос поднимался в отношении женщин, принимающих оральные контрацептивы, и беременных, но проведенный скрининг в этой группе не выявил достоверных доказательств (26).
Генетические факторы и их взаимодействие пока еще изучены недостаточно, поэтому и рекомендации при этой патологии со временем изменяются. Современные исследования пытаются повысить качество оценки, отразить более четко взаимосвязь между известными факторами риска, новыми факторами, предрасполагающими или профилакти-рующими развитие тромбоза и рандомизированными клиническими исследованиями.
Заключение
В последнее время качество лечения ВТ. значительно повысилось. Логический поиск, сочетающий определение концентрации ДД и компрессионную ультрасонографию, используется при диагностике как ТГВ, так и ЭЛА. При подтверждении ВТ клиническое и лабораторное обследование с обязательным сбором персонального и семейного анамнеза должно включать соответствующие специфические тесты. Согласно полученным результатам назначается конкретное лечение или профилактические мероприятия.
Литература
1. Bounameaux H, de Moerloose P, PerrierA, Miron M-J. Quarterly Journal Medicine 1997; 90:437-42.
2. Perrier A, Desniarais S, Miron MJ, de Moerloose P, Lepage R, Didier D, Lancet 1999; 353:190-5.
3. de Moerloose P. D-dimer assays for the exclusion of venous thromboembolism: which test for which diagnostic strategy? Thrombosis and Haemostasis 2000 ; 83:180-1.
4. Reber G, de Moerloose P. Seminars Thrombosis and Hemostasis 2000 ; 26: 619-624.
5. British Society for Haematology: Journal of Clinical Pathology 1990 ; 43:703-10.
6. Dahlback B. Seminars Thrombosis and Hemostasis 1999 ; 25:273-89.
7. Huisman MV, Rosendaal FR. Thrombophilia. Current Opinion in Hematolology 1999; 6:291-7.
8. Bertina R. Molecular risk factors for thrombosis. Thrombosis and Haemostasis 1999; 82: 601 -9.
9. Seligsohn U, Zivelin A. Thrombophilia as a multigenic disorder. Thrombosis and Haemostasis 1997; 78:297-301.
10. Zoller B, Garcia de Frutos P, Hillarp A, Dahlback B. Thrombophilia as a multigenic disease. Haematologica 1999 ; 84:59-70.
11. Martinelli I, Sacchi E, Land/' G, et a/. New England Journal of Medicine 1998; 338:1793-7.
12. Kearon C, Crowther M, Hirsh J. Medicine 2000 ; 51:169-85.
13. Roubey RAS. Antiphospholipid syndrome: antibodies and antigens. Current Opinion in Hematology 2000; 7:316-20.
14. Harris NE, Pierangeli SS. Equivocal antiphospholipid syndrome. Journal of Autoimmunity 2000 ; 15:871-5.
15. Reber G, ArvieuxJ, Comby E, Degenne D, Potron G. Thrombosis and Haemostasis 1995 ; 73:444-52.
w*-»• 16. O'Donnel JO, Mumford AD, Manning RA, Laffan M. Elevation of factor VIII :C in venous thromboembolism is persistent and independent of the acute phase response. Thrombosis and Haemostasis 2000:83:10-3.
17. van Hylckama A, van der Linden I, Bertina RM, Rosendaal FR. High levels of factor IX increase the risk of venous thrombosis. Blood 2000 ; 95:3678-82.
18. Meijers JC, Tekelenburg WL, Bouma BN, Bertina RM, Rosendaal FR. High levels of factor XI as a risk factor for venous thrombosis. New England Journal of Medicine 2000 ; 542: 696-701.
19. den Heijer M. Homocysteine and venous thrombosis. In: Robinson K, eds. Homocysteine and vascular disease. The Netherlands: Kluwer Academic Publishers, 2000:239-252.
20. de Moerloose P, Mannucci P, Bounameaux H. Screening tests for thrombophilic patients: which test, for which patient, by whom, when and why? Seminars Thrombosis and Hemostasis 1998; 24:321-7.
21. Ridker PM, Hennekens CH, Lindpainter K, Stampfer MJ, Eisenberg RP, Miletich JP. Mutation in the gene coding for coagulation factor V and the risk of myocardial infarction, stroke and venous thrombosis in apparently healthy men. New England Journal of Medicine 1995; 332:912-7.
22. Bounameaux H, de Moerloose P, Sarasin FP. Optimal duration of oral anticoagulant therapy following deep vein thrombosis of lower limbs. Blood Coagulation and Fibrinolysis 1996 ; 7:507-14.
23. de Moerloose P, Reber G, PerrierA, Pernegger T, Bounameaux H. Prevalence of factor V Leiden and prothrombin G20210A mutations in unselected patients with venous thromboembolism. British Journal of Haematology 2000 ; 110:125-9.
24. Ridker PM. Long-term, low-dose warfarin among venous thrombosis patients with and without factor V Leiden mutation: rationale and design for the prevention of recurrent venous thromboembolism (PREVENT) trial. Vascular Medicine 1998; 3: 67-73.
25. De Stefano V, Martinelli I, Mannucci PM, et al. The risk of recurrent deep venous thrombosis among heterozygous carriers of both factor V Leiden and the G20210A prothrombin mutation. New England Journal of Medicine 1999; 341:801-6.
26. Vandebroucke JP, van der Meer FJ, Helmerhorst FM, Rosendaal FR. Factor V Leiden: should we screen oral contraceptives users and pregnant women? British Medical Journal 1996 ; 313:1127-30.
ФАРМАКОЛОГИЧЕСКАЯ ЗАЩИТА ПОЧЕК
Дж. Шор ген (Кор к, Ирландия)
•
Патофизиология периоперационной острой почечной недостаточности
Термин «ренопротекция» применяется к терапии, направленной на поддержание работы почек в условиях «высокого риска». Она включает лекарственную терапию с помощью ингибиторов ангиотензинпревращающего фермента (АПФ) [1] или блокаторов ангиотен-зиновых рецепторов [2], направленную на замедление или остановку хронической почечной недостаточности. Однако, это касается первичной или вторичной профилактики острой почечной недостаточности (ОПН) во время операции.
Основной причиной периоперационной острой почечной недостаточности является острый канальцевый некроз, вызванный ишемией [3, 4]. Хотя процесс потери эпителиальных клеток канальцев после ишемии, называемый «некрозом», является результатом некроза и апоптоза. Поврежденные канальцевые клетки слущиваются и блокируют узкую часть нисходящей петли Генле, вызывая обратное попадание фильтрата в интерстицию почек [4]. Вторично повреждению способствует активация ренин-ангиотензиновой системы, которая вызывает гломерулярную вазоконстрикцию и уменьшение гломерулярной фильтрации. Клетки просвета извитого проксимального канальца и восходящий конец петли Генле очень активны и наиболее подвержены ишемии. Когда запускается острый канальцевый некроз на фоне ишемии, в следующие 1-2 недели наблюдается «светлый» промежуток прежде, чем значительно уменьшится гломерулярная фильтрация. В этот период почечный вазомоторный тонус зависит от противоположных влияний оксида азота и очень мощного, длительно действующего эндогенного вазоконстриктора эндотелина (ЭТ 1). В отличие от степени и продолжительности начального инсульта не до конца поняты факторы, определяющие — восстановится ли функция почек. Степень, при которой начинают регенерироваться клетки почечных канальцев, в норме не репродуцирующиеся, определяет — произойдет ли выздоровление. Если выздоровление произойдет, обычно это становится ясно в течение первых трех недель после травмы. В дополнение к шоку (септическому, кардиогенному или гиповолемическому) ишемический острый канальцевый некроз может быть связан с пережатием аорты, искусственным кровообращением или введением нефротоксических препаратов. Хотя супраренальное пережатие аорты представляет величайший риск для почек, инфраренальное пережатие в 3-5% случаев вызывает почечную недостаточность, требующую гемодиализа [4-6]. Инфраренальное пережатие аорты вызывает гипоперфузию почек, сопротивление почечных сосудов увеличивается на 75% и на 38% уменьшается почечный кровоток [7]. Изменяется распределение кровотока в почках, уменьшаясь в кортикальном слое. Даже после снятия зажима с аорты патологическое состояние сохраняется в течение 60 минут [8]. Уменьшение почечного кровотока и его перераспределение вызывает временное уменьшение гломерулярной фильтрации [7, 9]. Острая почечная недостаточность является серьезным осложнением операций с искусственным кровообращением, встречается в 1,1-16% [10]. Причинами могут быть низкое перфузионное почечное давление, выброс вазоконстриктора эндотелина [4]. Вызвать или ухудшить ишемическое повреждение может использование препаратов с местным реноваскулярным действием, например, нестероидные противовоспалительные препараты, ингибиторы АПФ, циклоспорин А.
Ренопротекторы
Все усилия, потраченные на доказательства защитных свойств допамина в периопе-рационных условиях, оказались неубедительными [11,12]. Побочные эффекты больших доз допамина объясняются непредсказуемым а-адренергическим эффектом. Они включают тахиаритмию, ишемию миокарда и инфаркт [13], периферический некроз.
Использование допамина для защиты почек связано с повреждением, вызванным ги-поперфузией или ишемией, которая компенсируется одновременным увеличением доставки кислорода (увеличение почечного кровотока) и уменьшением потребления кислорода (угнетение канальциевой №+К+АТФазы). Однако допамин обладает дозозависимым влиянием на ОАг и cci-адренергические рецепторы. Неселективность «экзогенного» допамина на уровне периферических рецепторов можно счесть за отсутствие явной почечной протекции: при плохой перфузии почек допамин может ухудшить регионарное распределение кровотока или усилить почечное реперфузионное повреждение [13].
Агонист допаминовых рецепторов допексамин обладает (^-влиянием, однако более клинически значим а-адренергический эффект. Допексамин изучался в условиях плановых операций на аорте [14], АКШ [15], пересадки печени [16], выраженного защитного действия в отношении почек не выявлено.
Высокоселективный агонист DA1 рецепторов фенолдопама мезилат вызывает селективную почечную вазодилятацию и угнетает канальцевую реабсорбцию натрия [17-19]. Этот препарат способен уменьшать потребность почек в кислороде и увеличивает доставку кислорода к почкам. У здоровых добровольцев и больных с гипертензией внутривенная инфузия фенолдопама увеличивала почечный кровоток и уменьшала почечное сосудистое сопротивление [20-22]. В нашем госпитале мы выяснили, что фенолдопам предотвращает падение клиренса креатинина в первые восемь часов после операции на аорте или АКШ.
Петлевые диуретики блокируют систему Na+-K+-CI~ транспорта в восходящей части петли Генле. При уменьшении потребления кислорода в этой метаболически активной зоне снимается гипоксическое повреждение в целом в почке. Хотя этот выгодный эффект был продемонстрирован на изолированной почке [23] и на животной модели [24], клинического эффекта интраоперационно получено не было [25].
Предсердный натрийуретический гормон вырабатывается в ответ на растяжение предсердия и другие стимулы, включая эндотелии и катехоламины. Он вызывает общую вазодилятацию, увеличение клубочковой фильтрации, угнетение выработки ренина и на-трийурез. Клинические исследования защитных свойств синтетического аналога ПНР анаритида дали разочаровывающие результаты [26-27].
Эндотелии-1 может иметь значение при различных формах периоперационной ОПН. Связываясь с рецепторами типа А в гладкой мускулатуре сосудов, эндотелии увеличивает концентрацию ионов цитоплазматического кальция [28]. У добровольцев блокаторы кальциевых каналов уменьшали эндотелиновый почечный эффект [29]. Защитный ре-нальный эффект антагонистов эндотелиновых рецепторов еще не изучен, а их клиническое значение ограничено ожидаемым гипотензивным действием.
Другой целью для фармакологической защиты почек является фаза восстановления или регенерации. Восстановление после острого канальцевого некроза регулируется генетически - геном WT 1, который определяет дифференцировку почечных структур у эмбриона и активируется при ишемическом канальцевом некрозе [30]. На ранней стадии ОПН выражена активность эпидермального рецептора и рецептора инсулиноподобного фактора роста.
После ишемического или септического стресса на эндотелии сосудов прикрепляются лейкоциты, что может блокировать почечные сосуды и усугубить ишемию. У трансгенетических мышей без гена ICAM-1 (ответственного за выработку молекул межклеточной адгезии) функция почек после ишемического повреждения сохраняется [31]. Необходимо проведение исследования эффективности антител к ICAM-1 для профилактики ишемиче-ской ОПН.
Лазароиды (21 аминостероид, лишенный глюкокортикоидного эффекта) полностью угнетает перекисное окисление липидов и нейтрализуют свободные радикалы. Ранние ис-
следования подтверждают, что эти препараты могут защищать почки от повреждения [32-34].
Таким образом, нет препаратов явно эффективных для профилактики или лечения ранней периоперационной ОПН. Однако ясно, что «почечной дозе» допамина требуется альтернатива.
Литература
1. Sharma К, Eltayeb ВО, McGowan ТА, eta/. American Journal of Kidney Disease 1999;34:818-23.
2. Buter H, Navis G, de Zeeuw D, de Jong PE. Kidney International Supplement 1997;63:S185-7.
3. Welch M, Knight DC, Carr HMH, Smyth JV, Walker MG. Surgery 1994; 115: 46-51
4. Sladen RN, Prough DS. Perioperative renal protection. Problems in Anaesthesia 1997; 9:314-331.
5. . Olsen PS, Schroeder T, Perko M, Roder ОС, Agerskov K, Sorensen S, Lorentzen JE. Renal failure after operation for
abdominal aortic aneurysm. Annals of Vascular Surgery 1990; 4:580-583.
6. O'Donnell D, Clarke G, Hurst P. Australian New Zealand Journal of Medicine 1989; 59:405-408.
7. Gamulin Z, Forster A, Morel D, Simonet F, Aymon E, Favre H. Effects of infrarenal aortic cross-clamping on renal hemodynamics in humans. Anesthesiology 1984; 61:394-399
8. Abbott WM, Cooper JD, Austen WG. Journal of Surgical Research 1973; 14:385-392.
9. Paul MD, Mazer'CD, Byrick RJ, Rose DK, Goldstein MB. Journal ofNephrology 1986; 6:427-434.
10. Mangos GJ, Brown MA, Chan WYL, Whitworth JA. Australian New Zealand Journal of Medicine 1995; 25:284-289.
11. Myles PS, Buck/and MR, Schenk NJ, et al. Anaesthesia and Intensive Care 1993;21:56-61.
12. Baldwin L, Henderson A, Hickman P. Effect of postoperative low-dose dopamine on renal function after elective major vascular surgery. Annals of Internal Medicine 1994;120:744-7
13. Heyman SN, Kaminski N, Brezis M. Dopamine increases renal medullary blood flow without improving regional hypoxia. Experimental Nephrology 1995;3:331-7.
14. Welch M, Newstead CG, Smyth JV, Dodd PD, Walker MG. Evaluation ofdopexamine as a renoprotective agent during aortic surgery. Annals of Vascular Surgery 1995;9:488-92.
15. Berendes E, Mollhof T, Van Aken H, et al. Effects of dopexamine on creatinine clearance, systemic inflammation and splanchnic oxygenation in patients indergoing coronary artery bypass grafting. Anesthesia and Analgesia 1997;84:950-7.
16. Gray PA, Bodenham AR, Park GR. A comparison of dopexamine and dopamine to prevent renal impairment in patients undergoing orthoptic liver transplantation. Anaesthesia 1991;46:638-4l.
17. Ackerman DM, Blumberg AL, McCafferty JP, Sherman SS, Weinstock J, Kaiser C, Berkowitz B. Potential usefulness of renal vasodilators in hypertension and renal disease: SK&F 82526. Federal Proceedings 1983; 42:186-190.
18. Brogden RN, Markham A. Fenoldopam. Drugs 1997; 54:634-650.
19. Mathur VS, Swan SK, Lambrecht U, Anjum S, Fellmann J, McGuire D, Epstein M, Luther RR. Critical Care Medicine 1999; 27: 1832-1837.
20. Murphy MB, McCoy CE, Weber RR, Frederickson ED, Douglas FL Goldberg U. Circulation 1987; 76:1312-1318.
21. Ruilope LM, Robles RG, Miranda B, Tovar J, Alcazar JM. Renal effects offeno/dopam in refractory hypertension. Journal of Hypertension 1988; 6: 665-669.
22. Bughi S, Morton R, Antonipillai I, Manoogian C, Ehrlich L, NadlerJ. Comparison of dopamine and fenoldopam effects on renal blood flow and prostacydin excretion in normal and essential hypertensive subjects. Journal of Clinical Endocrinology and Metabolism 1989; 69:1116-1121.
23. Heymann SN, Rosen S, Epstein FH, Spokes K, Brezis M. Loop diuretics reduce hypoxic damage to proximal tubules of the isolated perfused kidney. Kidney International 1994;45:981-5.
24. Heyman SN, Brezis M, Greenfield Z, Rosen S. Protective role offurosemide and saline in radiocontrast induced renal failure in the rat. American Journal of Kidney Disease 1989; 14:377-85.
25. Hager B, Betschart M, Krapf R. Effect of postoperative intravenous loop diuretics on renal function after major surgery. Schweiz Med Wochenschr 1996; 126:666-73.
26. Kurnik BR, Allgren RL, Center FC, et al. Prospective study of atria/ natriuretic peptide for the prevention of radiocontrast nephropathy. American Journal of Kidney Disease 1998;31:674-80.
27. Allgren RL, Marbury TC, Rahman SN, et al. Anaritide in acute tubular necrosis. New England Journal of Medicine 1997;336:8288-94.
28. Voets AJ. Reversal by calcium channel blockade but not by nitrovasodilators or endothelium derived relaxing factor. Circulation 1991;83:469-75.
29. Dressier GR. Transcription factors in renal development: the WT -1 and pax-s story. Seminars in Nephrology 1995; 15:263-71.
30. Kelly K, Williams W, Colvin R et al. Intercellular adhesion molecule-1-deficient mice are protected against ischaemic renal injury. Journal of Clinical Investigation 1996;97:1056-63.
31. Nath KA, Balla J, Croatt AJ, Vercellotti GM. Heme protein - mediated renal injury: a protective role for 21 aminosteroids in vitro and in vivo. Kidney International 1995;47:592-602.
32. Krysztopik RJ, Bentley FR, Spain DA, Wilson MA, Garrison RN. Lazaroids prevent acute cydosporine induced renal vasoconstriction. Transplantation 1997;63:1215-20.
33. Krysztopik RJ, Bentley FR, Spain DA, Wilson MA, Garrison RN. Free radical scavenging improves renal blood flow during sepsis. Surgery 1996; 120:657-62.
ПРОПОФОЛ В ЭМУЛЬСИИ ТРИГЛИЦЕРИДОВ ДЛИННОЙ И СРЕДНЕЙ ЦЕПОЧЕК
И. Pay, M. Рой цен, А.Донике, М. О'Коннор
Пропофол выпускается в виде 1% раствора в жировой эмульсии (Intralipid-®, KabiVitrum, Stockholm, Sweden), содержащей 10% соевое масло (триглицериды длинной цепочки). При вбедении пропофола многие пациенты (от 32% до 67%) испытывают болевые ощущения средней и большой интенсивности [1]. В ранних иследованиях, когда применялись более высокие концентрации свободного пропофола в водной фазе эмульсии, боли регистрировались чаще [2,3]. Смеси триглицеридов с длинной и средней цепочками (Lipofundin-® мет 10% , ВБшип, Mebungen), используемые в настоящее время в качестве носителей, в исследованиях на добровольцах при болюсном введении значительно реже ассоциировались с болями средней и высокой интенсивности. При этом изменений фармакодинамики и фармакокинетики препарата не отмечалось [4]. В данном проспективном рандомизированном исследовании с использованием двойного слепого метода была поставлена задача сравнить частоту возникновения и интенсивность болевых ощущений при инъекции 1% растворов пропофола-липуро (Propofol-CsLipuro, B.Braun, Melsungen, Germany) и дипривана (Diprivan®, AstmZeneca, Gem any) при плановых оперативных вмешательствах.
„ Методы
,,<ц В исследовании приняли участие 152 пациента, по классификации ASA соответствовавшие I-III уровням. Всеми было предоставлено письменное согласие на участие в ис-следовании. Все были в возрасте старше 18 лет, всем планировалось проведение планового оперативного вмешательства. В исследование не включались кормящие матери, пациенты с неврологическими заболеваниями в анамнезе, с признаками печеночной и почечной недостаточности, положительным результатом теста на беременность. Пациентов рандомизированно распределили на две группы: дипривана и пропофола-липуро. Исследователи и пациенты были "ослеплены", т.е. лишены информации о том, какой из препаратов используется в конкретном случае. Флаконы и цвет растворов не отличались друг от друга.
Для премедикации использовали 1-2 мг лоразепама перорально за 1-2 часа до введения в аненстезию. В операционной использовалась стандартная схема мониторинга. Интенсивность боли определялась при помощи 100-мм визуальной аналоговой шкалы (ВАШ) спустя 5 минут после введения канюли 18G в вену на тыле кисти.
Вводная анестезия проводилась болюсным введением пропофола 20 мл/мин до исчезновения роговичного рефлекса. По ходу введения пациента просили описывать свои ощущения. После утраты сознания перед эндотрахеальной интубацией по усмотрению анестезиолога вводились фентанил и атракуриум. Вентиляция проводилась кислородо-воздушной смесью, поддержание анестезии обеспечивалось постоянным введением пропофола. Спустя час после экстубации пациента повторно просили описать ощущения, испытанные при первоначальном введении пропофола и оценивали их по ВАШ. Полученные данные анализировали при помощи тестов Фишера и Wilcoxon's Mann-Whitney Litest.
Результаты
Основные параметры участвовавших в исследовании, продолжительность операции, уровни интенсивности болевых ощущений через 5 минут после наложения венозного доступа не имели существенных различий между группами. Средние дозы индукции, время от начала введения до утраты роговичного рефлекса, поддерживающие дозы также были сходными. Все три переменные по группам были статистически эквивалентны.
Частота побочных эффектов (задержка дыхания, возбуждение, кашель) не различалась. В группе пропофола-липуро 2 пациента (2,7%), а в группе дипривана - 11 человек (14,7%) жаловались на дискомфорт во время инъекции (Р <0,005). Интенсивность дискомфорта была менее выражена в группе пропофола-липуро, чем в группе дипривана. При этом на боли при введении 1% пропофола-липуро жаловалось меньшее число пациентов (10,8% против 26%). Интенсивность болевых ощущений, оцениваемая по ВАШ, спустя час после экстубации была также существенно ниже (средние значения 2 мм против 11,5 мм). Результаты приведены в таблице 2.
Таблица 1. Частота и интенсивность болей в месте инъекции
|
Боль при инъекции Одновременное сообщение |
Propofol-SLipuro 1% (п = 74) |
Diprivan® 1% (п = 75) |
значение Р |
|
слабая |
0 (0%) |
4 (5,3%) |
|
|
умеренная |
2 (2,7%) |
3 (4,0%) |
|
|
сильная |
0 (0%) |
4(5,3%) |
|
|
Всего |
2 (2,7%) |
11(14,7%) |
0,01713 |
|
Сообщение после опроса |
|
|
|
|
слабая |
20 (27%) |
26 (34,7%) |
|
|
умеренная |
8(10,8) |
12(16) |
|
|
сильная |
0 (0%) |
8(10,7%) |
|
|
Всего |
28 (37,8%) |
46(61,3%) |
0,00532 |
Таблица 2. Оценка болевых ощущений по визуальной аналоговой шкале
Propofol-OJpuro 1%
Diprivan® 1%
|
|
после установки канюли |
после введения |
после установки канюли |
после введения |
|
медианная |
0 |
2 |
0 |
11,5* |
|
нижняя/верхняя четверти |
0/4 |
0/11 |
0/3 |
0/24 |
|
шкалы |
0/18 |
0/49 |
0/17 |
0/75 |
|
мин/макс значения |
|
|
|
|
*/о—0,0007 между группами
Обсуждение
Болевые ощущения, возникающие при внутривенной инъекции препаратов пропофола, являются общеизвестной и распространенной проблемой [1]. Разработаны различные способы их снижения, включающие предварительное введение лидокаина или смеси ли-докаина с пропофолом [1,5-7]. Так как лидокаин абсорбируется жировой эмульсией, его смесь с пропофолом следует вводить сразу же после приготовления, для достижения максимального местного обезболивающего эффекта лидокаина. В случаях, когда целесообразно медленное введение, пропофол разводят 5% раствором глюкозы [8]. Кроме того, инъекции холодного (4° С) изотонического раствора перед введением пропофола способны снижать частоту болевых ощущенний с 75% до 22% [8].
Добавление 5% раствора глюкозы к пропофолу снижает концентрацию свободного пропофола водной фазы лишь на 6,4%. Данное исследование проводилось с использованием диализа in vitro в течение 24 часов [2]. Следует отметить при этом, что смесь 20
мл чистого пропофола с 10 мл 10% раствора липофундина МСТ (триглицерида со средней длиной цепочки) приводит к снижению концентрации свободного пропофола водной фазы до 39,9% [2]. Соответственно происходит и сокращение болевых ощущений. На основании этих результатов мы предположили, что появление болей при введении препарата непосредственно связано с объемом пропофола водной фазы эмульсии. Разведение имеющихся в настоящее время препаратов пропофола сопряжено с необходимостью проведения дополнительных манипуляций и увеличивает риск контаминации растворов [9].
Концентрация свободного пропофола водной фазы 1% раствора в 10% эмульсии триглицеридов с длинной и средней цепочкой составляла 14,0±0,5 мкг/мл в сравнении с 18,6±0,6 мкг/мл у дипривана, что соответствовало снижению на 25% [2].
Новый препарат пропофола в концентрации 10 мг/мл (Propofol-®Lpuro 1% ) производится компанией B.Braun. В изготовлении его использован метод прямой эмульсифика-ции. В нашем предыдущем исследовании, в котором приняли участие 24 здоровых добровольца, применение 1% пропофола ассоциировалось со значительно меньшей частотой возникновения болевых ощущений. Фармакокинетические характеристики нового препарата пропофола с триглицеридами средней и длинной цепочек не отличались от пропофола стандартной формулы [4, 10].
Использование 1% пропофола-липуро для вводной анестезии у пациентов I-III групп по классификации ASA сопровождалось меньшими болевыми ощущениями при его введении. При этом различия степени гипнотического действия, а также других фармакоди-намических характеристик в сравнении с диприваном клинического значения не имеют.
Литература
1. Nathanson MH, Cajraj NM, Russel JA. Prevention ofppain on injection ofpropofol. A comparison oflidocaine with alfentanil. Anesth Analg 1996;82:469-71
2. Bab/ j, Doenicke A, Moench V. New Propofol LCT/MCT fat emulsions as solvent: approach to reducing pain on injecion of propofol? Eur Hosp Pharm 1995;!: 15-21.
3. Doenicke AW, Roizen MF, Rau J, et al. Reducing pain during propofol injection: the role of solvent. Anesth Analg; 1996;82:472-4.
4. Doenicke AW, Roizen MF, Rau J, et al. Pharmacokinetics and pharmacodynamics ofpropofol in a new solvent. Anesth Analg 1997; 85:1399-403.
5. Klement W, ArndtJO. Pain on injection ofpropofol: effects of concentration and diluent/ Br J Anaesth 1991;67:281-4.
6. McLeskey CU, Walamander CA et al. Adverse events in a mmulticenter phase IV study of propofol: evaluation by anesthesiologists and postanesthesia care. Anesth Analg 1993;77(Suppl)S3-9.
7. King SY, Davis FM, Wells JE et al. lidocaine for the prevention of pain due to injection of propofol. Anesth Analg 1992;74:246-9.
8. Barker P, Langton JA, Murphy P, Rowbotham DJ. Effect of prior administration of cold saline on pain during propofol injection: a comparison with cold propofol and propofol with lignocaine. Anaesthesia 1991; 46:10569-70.
9. Crowline J, Tolly DT et al. Growth of microorganisms in propofol, thiopental, and 1:1 mixture of propofol and thidpental. Anesth Analg 1996;82:475-8.
10. Shafer S. Advances in propofol pharmacokinetics and pharmacodynamics. J Cl/n Anesth 1993; 5(Suppl 1):14S-21S.
КАК ЧИТАТЬ МЕДИЦИНСКИЕ ЖУРНАЛЫ: 10 ВОПРОСОВ О НАУКЕ
И.Виллар, А.Улиарте (Тенерифе, Испания)
* . . | , • • ; . -
ВВЕДЕНИЕ г
Для того, чтобы познакомиться с информацией из 5 ведущих журналов в области анестезиологии и интенсивной терапии, в месяц необходимо прочитать более 100 статей. Сейчас в мире издается более 20000 биомедицинских журналов, которые буквально заваливают читателя различной информацией. Так, термин "острая дыхательная недостаточность" содержит более 10000 ссылок в Medline за последние 10 лет. Более того, каждый год количество биомедицинских журналов увеличивается еще на 7%.
Мы пишем статьи и читаем их в силу самых различных причин. Чтение статей направлено, главным образом, на получение полезной информации. Тем не менее, во многих медицинских журналах регулярно появляются слабые, некачественные статьи. Эта лекция, в какой то мере, поможет Вам отделить "злаки от плевел" при чтении медицинской литературы.
