
- •Общая химия
- •Требования к выполнению лабораторных работ и написанию отчета
- •Работа 1. Важнейшие классы неорганических соединений: оксиды, гидроксиды (основания, кислоты), соли
- •Работа 2. Труднорастворимые электролиты. Обменные реакции в растворах
- •Работа 3. Приготовление растворов
- •Работа 4. Основы электрохимии
- •Работа 5. Комплексные соединения
- •Работа 6. Окислительно-восстановительные реакции с участием р-элементов (неметаллов) V, VI, VII групп Периодической системы
- •Работа 7. Свойства металлов (s-, p-, d-элементов)
- •Работа 8. Свойства лантанидов и актинидов на примере Ce, Th, u
- •Работа 9. Химическое равновесие в растворах слабых кислот (оснований)
- •Работа 10. Гидролиз солей
- •Реактивы
- •Библиографический список
- •620002, Екатеринбург, Мира, 19
Работа 9. Химическое равновесие в растворах слабых кислот (оснований)
Равновесный процесс ионизации слабого электролита количественно характеризуется константой ионизации и степенью ионизации. В растворах слабых кислот (оснований) в равновесии участвуют ионы водорода (гидроксила), концентрация которых определяет значение рН раствора:
pH = - lg a (H+) - lg [H+],
рОН = - lg a (OH) - lg [OH],
pH + pOH = 14.
Измерение рН раствора слабой кислоты (основания) дает возможность рассчитать константу кислотности (основности) и степень ионизации.
Пример 1. HAc ⇄ H+ + Ac, [H+] = [Ac]
[HAc] C0(HAc)
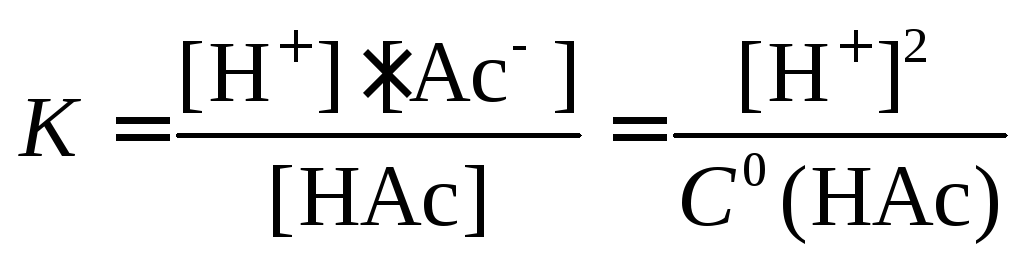
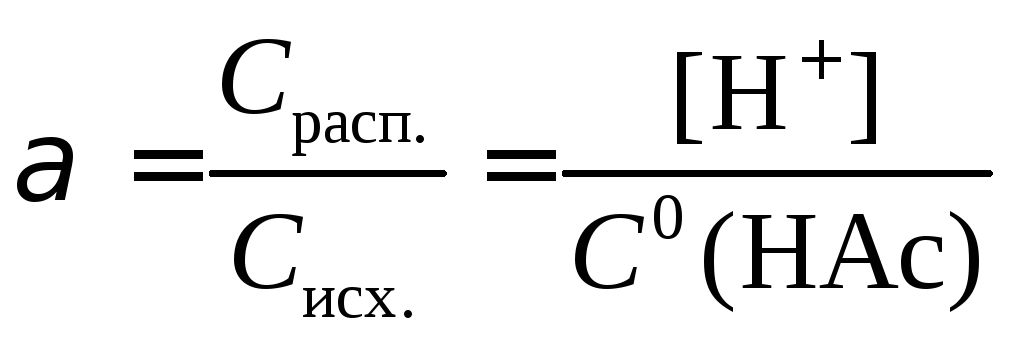
Пример 2. NH3H2O ⇄ NH4+ + OH-, [OH] = [NH4+],
[NH3] C0(NH3)
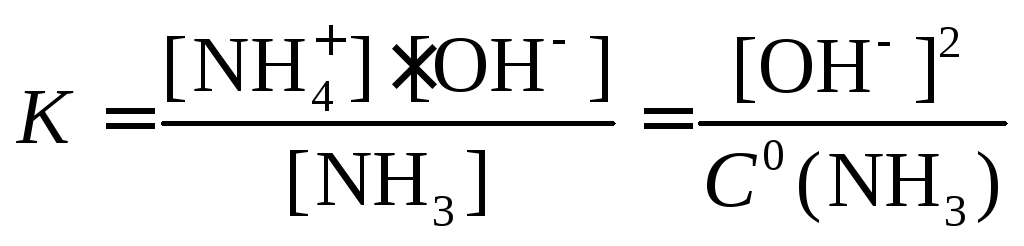
![]()
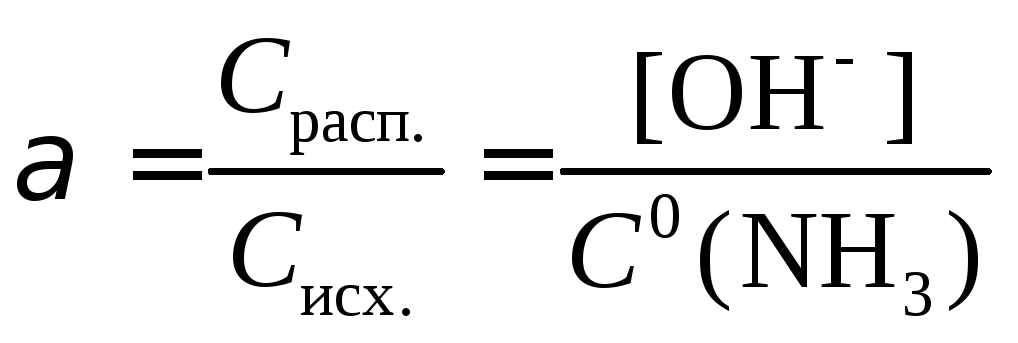
При данной температуре степень ионизации зависит от концентрации слабого электролита (закон разведения Оствальда) и присутствия избыточного количества одноименных ионов.
Например, равновесие NH3H2O ⇄ NH4+ + OH сильно смещено влево в присутствии солей аммония.
Цель работы – изучение характера смещения равновесия в растворах уксусной кислоты или аммиака при разбавлении растворов и введении солей, содержащих одноименные ионы.
Варианты индивидуальных заданий приведены в табл. 7.
Таблица 7
Индивидуальные задания к лабораторной работе 9
|
Вариант |
Состав и концентрация электролитов, моль/дм3 | ||||||
|
Раствор 1 |
Раствор 2 |
Раствор 3 | |||||
|
1 2 3 4
5 6 7 8 |
HAc (CH3COOH) |
HAc |
HAc |
+ |
NaAc | ||
|
0,01 0,01 0,01 0,01 |
0,0004 0,0005 0,0008 0,001 |
0,0004 0,001 0,0005 0,001 |
|
0,0008 0,001 0,001 0,001 | |||
|
NH3 в воде |
NH3 в воде |
NH3 |
+ |
NH4Cl | |||
|
0,01 0,01 0,01 0,01 |
0,0004 0,0005 0,0008 0,001 |
0,0004 0,0005 0,0008 0,001 |
|
0,001 0,001 0,001 0,001 | |||
Задание 1. Расчет константы и степени ионизации по значению рН
Измерьте значение рН раствора 1, используя прибор рН-метр или иономер.
Рассчитайте концентрацию ионов водорода (или гидроксила), константу ионизации электролита и степень ионизации 1. Сравните рассчитанное значение константы ионизации с табличным.
Задание 2. Зависимость степени ионизации от концентрации
Приготовьте раствор 2 путем разбавления более концентрированного 0,01 М раствора водой. Рассчитайте объем 0,01 М раствора, который необходим для приготовления 50 см3 раствора 2. Воспользуйтесь мерной колбой вместимостью 50 см3. Налейте в нее из бюретки необходимый объем 0,01 М раствора, долейте дистиллированной водой до метки, закройте пробкой, тщательно перемешайте и измерьте рН.
Рассчитайте степень ионизации 2 и значение константы ионизации.
Сравните значения 1 и 2 и сделайте вывод о влиянии разбавления раствора на степень ионизации слабого электролита.
Задание 3. Смещение равновесия в растворе слабого электролита при введении одноименного иона
Приготовьте смесь двух электролитов: слабая кислота (основание) и соль, содержащая одинаковые со слабым электролитом ионы (раствор 3).
Рассчитайте объемы 0,01 М растворов HAc (NH3H2O) и NaAc (NH4Cl), необходимые для приготовления 50 см3 раствора 3. В мерную колбу вместимостью 50 см3 налейте из бюреток необходимые объемы растворов и долейте дистиллированной водой до метки. Закройте колбу пробкой, тщательно перемешайте раствор, измерьте рН.
Рассчитайте степень ионизации 3 и значение константы ионизации. При расчете константы ионизации учтите, что
[Ac] C(NaAc),
[NH4+] C(NH4Cl).
Сравните значения 2 и 3 и сделайте вывод о влиянии одноименного иона на ионизацию слабого электролита.
