
- •Общая химия
- •Требования к выполнению лабораторных работ и написанию отчета
- •Работа 1. Важнейшие классы неорганических соединений: оксиды, гидроксиды (основания, кислоты), соли
- •Работа 2. Труднорастворимые электролиты. Обменные реакции в растворах
- •Работа 3. Приготовление растворов
- •Работа 4. Основы электрохимии
- •Работа 5. Комплексные соединения
- •Работа 6. Окислительно-восстановительные реакции с участием р-элементов (неметаллов) V, VI, VII групп Периодической системы
- •Работа 7. Свойства металлов (s-, p-, d-элементов)
- •Работа 8. Свойства лантанидов и актинидов на примере Ce, Th, u
- •Работа 9. Химическое равновесие в растворах слабых кислот (оснований)
- •Работа 10. Гидролиз солей
- •Реактивы
- •Библиографический список
- •620002, Екатеринбург, Мира, 19
Работа 10. Гидролиз солей
Гидролизом соли называется процесс взаимодействия соли с водой, в результате которого изменяется реакция среды (рН). Гидролизу подвергаются соли, в состав которых входят анионы слабых кислот или катионы слабых оснований. Соли, содержащие и анион слабой кислоты и катион слабого основания гидролизуются в значительной степени. Гидролиз солей многоосновных кислот и многогидроксильных оснований протекает ступенчато. Наиболее значимой является первая ступень гидролиза.
Для определения рН используют растворы кислотно-основных индикаторов, индикаторную бумагу, иономер. Измерение рН раствора соли дает возможность оценить количественные характеристики процесса гидролиза – константу и степень гидролиза.
Пример 1. Гидролиз соли алюминия, содержащей катион слабого основания, протекает по первой ступени в соответствии с уравнением
Al3+ + H2O = AlOH2+ + H+
Степень гидролиза
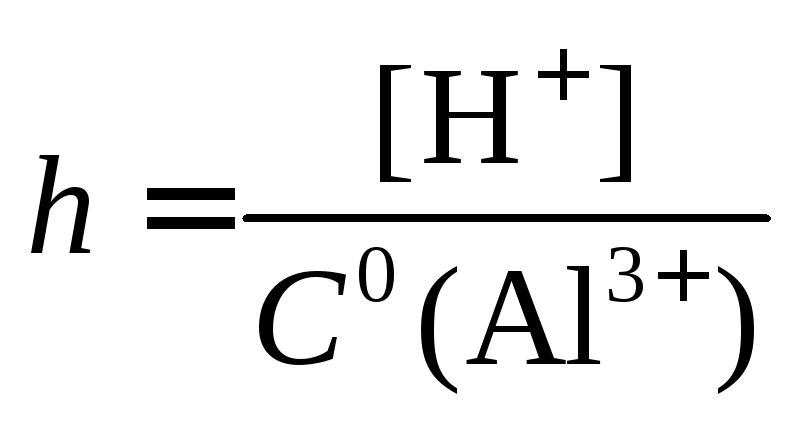
Константа гидролиза
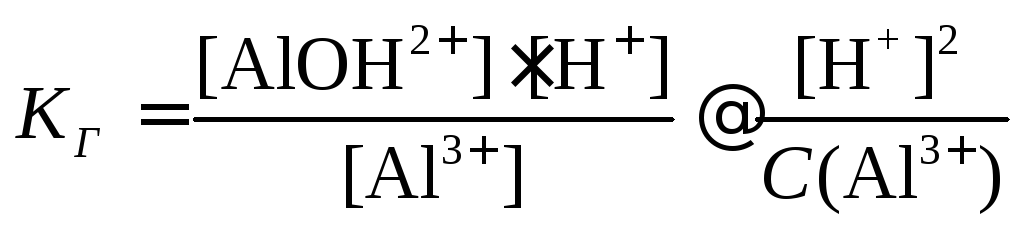
Пример 2. Гидролиз карбонатов, содержащих анион слабой кислоты, протекает по первой ступени согласно уравнению
CO32 + H2O = HCO3 + OH
Степень гидролиза
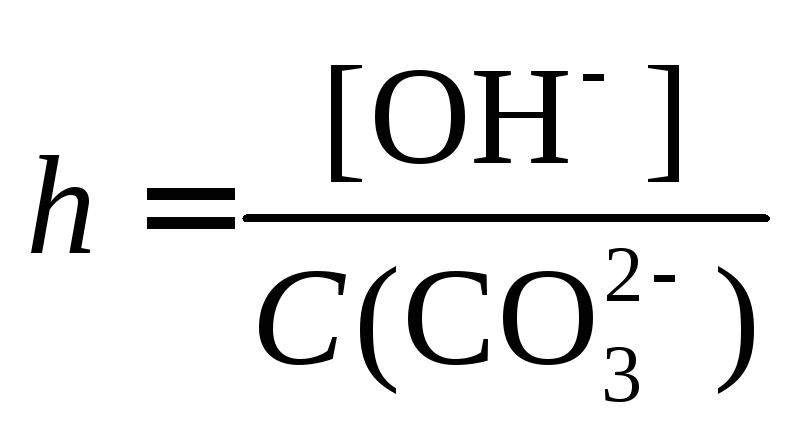
Константа гидролиза
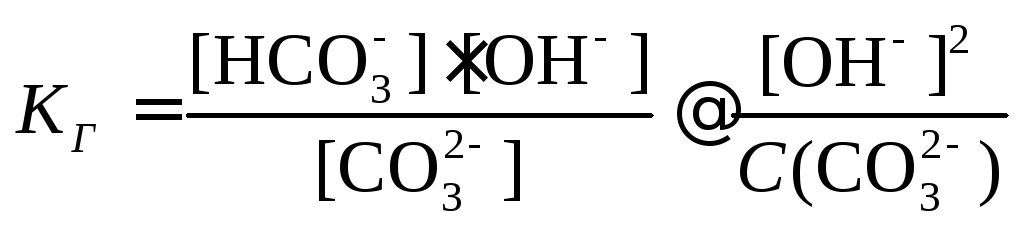
Задание 1. Изменение реакции среды при растворении соли
С помощью универсальной индикаторной бумаги определите значения рН водных растворов следующих солей: Na2CO3, NaAc, Al(NO3)3, NaCl.
На часовое стекло поместите несколько кристалликов соли, добавьте 3-5 капель дистиллированной воды. Стеклянной палочкой нанесите каплю полученного раствора на полоску индикаторной бумаги, сравните окраску влажного пятна с цветной шкалой, запишите значения рН.
Используя ту же индикаторную бумагу, определите рН дистиллированной воды и сделайте вывод о том, какие из изученных солей при взаимодействии с водой подвергаются гидролизу.
Напишите уравнения гидролиза в ионно-молекулярной и молекулярной формах. Для тех солей, гидролиз которых протекает в несколько ступеней, напишите уравнения первой ступени гидролиза.
Задание 2. Влияние температуры на процесс гидролиза
В пробирку налейте 1-2 см3 охлажденной дистиллированной воды, внесите несколько кристалликов соли цинка (II) и 1-2 капли раствора индикатора метилового красного. Отметьте цвет индикатора в растворе соли цинка. Слегка подогрейте пробирку с раствором на спиртовке. Наблюдайте изменение цвета индикатора.
Найдите в справочнике интервал рН изменения окраски индикатора метилового красного. Напишите уравнение процесса гидролиза соли цинка в ионно-молекулярной и молекулярной формах. Укажите, в каком направлении смещается равновесие при нагревании и объясните это явление. Сделайте вывод о влиянии температуры на процесс гидролиза.
Задание 3. Совместный гидролиз солей
В три пробирки внесите по 1 см3 раствора карбоната натрия (соды) Na2CO3. В каждую пробирку приливайте по каплям раствор одной из следующих солей: Cu(II), Al(III), Cr(III). Наблюдайте образование осадков основной соли меди (CuOH)2CO3, гидроксидов алюминия, хрома и выделение пузырьков СО2 (заметно при встряхивании пробирки). Отметьте цвета осадков и запишите уравнения реакций совместного гидролиза в ионно-молекулярной и молекулярной формах.
Задание 4. Расчет константы и степени гидролиза соли по измеренному значению рН
Измерьте значение рН раствора соли с концентрацией С1=0,1 М, используя прибор иономер. Рассчитайте концентрацию ионов водорода (или гидроксила), значение константы гидролиза и степень гидролиза h1.
Приготовьте раствор соли с заданной концентрацией С2 путем разбавления водой 0,1 М раствора в мерной колбе вместимостью 50 см3. Измерьте значение рН, рассчитайте концентрацию ионов водорода (или гидроксила), значение константы гидролиза и степень гидролиза h2.
Сравните значения h1 и h2 и сделайте вывод о влиянии разбавления раствора на степень гидролиза соли.
Рассчитайте теоретическое значение константы гидролиза и сопоставьте с экспериментально полученными значениями.
Таблица 8
Индивидуальные задания к лабораторной работе 10
|
Вариант |
Раствор Na2CO3 |
Вариант |
Раствор Al(NO3)3 | ||
|
C1, моль/дм3 |
С2, моль/дм3 |
C1, моль/дм3 |
С2, моль/дм3 | ||
|
1 2 3 4 5 |
0,1 0,1 0,1 0,1 0,1 |
0,001 0,002 0,0025 0,004 0,005 |
6 7 8 9 10 |
0,1 0,1 0,1 0,1 0,1 |
0,005 0,004 0,0025 0,002 0,001 |
