
- •Растворы электролитов
- •Совместный гидролиз 2х солей.
- •Окислительно-восстановительные реакции (овр)
- •Термохимия
- •Химическая кинетика и равновесие.
- •3. Влияние катализатора на скорость х.Р.
- •Химическое равновесие
- •4 Моля 2 моля
- •Комплексные соединения.
- •Диссоциация кс.
- •Общие свойства металлов
- •Двойной электрический слой на границе « металл – раствор»
- •Гальванический элемент и его эдс
- •Защита Ме от коррозии
- •Электролиз с растворимым анодом. Применяют при рафинировании Ме от примесей а также при нанесении Ме покрытий
- •Семейство железа.
- •Химические св-ва Fe Co Ni
- •Соединения Fe Co Ni
Термохимия
Химические реакции всегда сопровождаются выделением или поглощением энергии в виде тепла, света, электричестве, т.е. превращением химической энергии в другие виды.
Для количественного сопоставления энергетических эффектов их, путём пересчёта, приводят к одному виду энергии – тепловой.
Раздел химии, изучающий изменение тепла в ходе химической реакции, называется термохимия.
Для реакций, которые идут при постоянном давлении и температуре обозначают ΔН и называют энтальпия. (V, T)=const, ΔU-внутренняя энергия.
Реакции бывают:
- экзотермические (выделение тепла в окружающую среду, ΔН<0)
- эндотермические (поглощение тепла из окружающей среды; ΔН>0)
Т.к. тепловой эффект реакции зависит от внешних условий, то его принято определять при стандартных условиях: T=298K (25˚C), P=101,3 кПа (1 ат, 760 мм рт. ст.), ΔН˚298 ΔU˚298. [ΔН; ΔU]= Дж(кал)/кДж(ккал).
Химические уравнения, записанные с указанием теплового эффекта, называют термохимическими; в них принято указывать агрегатное и аллотропическое состояние.
Тепловой эффект всегда относится к взаимодействию того числа молей, которое указано в уравнении реакции.
Тепловой эффект образования одного моля сложного вещества из простых называется энтальпией образования. ΔНобр; ΔНf ; ΔНобр˚298
[ΔН˚обр]=Дж/моль
Чем больше ΔН˚обр вещества, тем оно прочнее.
ΔН˚обр практически всех известных веществ экспериментально найдены и содержатся в справочниках.
Не все вещества однако можно синтезировать из простых в условиях, позволяющих производить калориметрические измерения (измеряют калориметром)
Однако ΔН˚обр можно найти и косвенным путём, пользуясь основным законом термохимии, законом Гесса
«Тепловой эффект реакции не зависит от пути процесса, а определяется только начальным и конечным состоянием системы.» Закон справедлив только если процесс идёт при (Р, Т)=const, или (V, P)=const.
Следствия закона Гесса:
-
термохимические уравнения можно складывать и вычитать алгебраически.
-
тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком.
-
(закон Лавуазье-Лапласса, открыт за 60 лет до закона Гесса) если в результате ряда преобразований система приходит в исходное состояние, то тепловой эффект такого процесса равен нулю.
-
тепловой эффект реакции равен разности между суммой ΔН образования продуктов реакции и суммой ΔН образования исходных веществ с учётом стехиометрических коэффициентов (коэффициентов перед формулой данного вещества уравнения реакции)
Химическая кинетика и равновесие.
Химическая кинетика изучает скорость химических реакций и зависимость этой скорости от различных факторов.
Количественно скорость химической реакции принято оценивать по изменению концентрации реагирующих веществ в единицу времени. Поскольку вещества реагируют в эквивалентных соотношениях, то о скорости можно судить по изменению концентрации любого одного из участников реакции (исходного вещества или продукта). О скорости можно судить так же по изменению какого-либо параметра (свойства системы), зависящего от концентрации (окраска раствора, давление газа, электропроводность электролита и т.д.)
П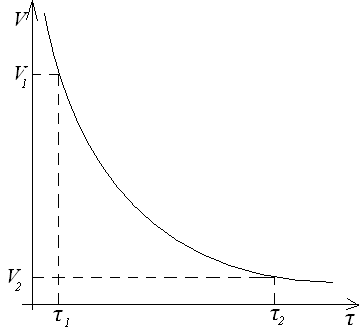 ри
постоянных внешних условиях скорость
реакции меняется, поэтому говоря о
скорости имеют ввиду скорость в данный
момент времени. Скорость в данный момент
времени – производная от концентрации
по времени.
ри
постоянных внешних условиях скорость
реакции меняется, поэтому говоря о
скорости имеют ввиду скорость в данный
момент времени. Скорость в данный момент
времени – производная от концентрации
по времени.
dc - бесконечно малое изменение концентрации.
dτ - бесконечно малое изменение времени.
![]() с
исходного вещества ↑, с продукта ↓.
с
исходного вещества ↑, с продукта ↓.
![]()
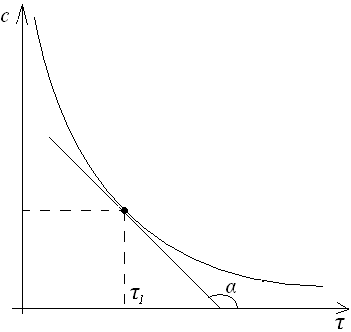
![]()
V=-tgα
Реакции делят на гомогенные и гетерогенные.
Гомогенные – протекают в одной среде (газ/жидкость)
Гетерогенные – между частицами, находящихся в разных фазах (имеется поверхность раздела).
Кинетика гомо и гетерогенных реакций существенно различаются: в гетерогенных реакциях присутствует стадия диффузии веществе, влияющая на скорость реакции.
V=ƒ(природа веществ, C, T, катализатор, …)
1. Влияние концентрации на скорость химических реакций установили норвежские учёные Гульдберг и Вааге; выведенное ими соотношение известно под название закон действующих масс (з. д. м.): при Т=const скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степени их стехиометрических коэффициентов (закон справедлив только для наиболее простых по механизму гомогенных реакций).
А+В=С; V=k*ca*cb ;V=k[A][B]
k – константа скорости химической реакции; k=ƒ(природа, Т, катализатор)
СА=СB=1моль/л V=k
2A+B=D; V=k[A]2[B]
Для гетерогенных реакций з. д. м. можно применять только если в выражениях для скорости не включать твёрдую фазу.
Сив+О2=CO2; V=k[O2]
2. Влияние температуры на скорость химической реакции. С увеличением Т скорость х/р увеличивается. На практике подтверждается приближённое правило Вант-Гоффа: «При повышении Т на каждые 10 градусов скорость реакции увеличивается от 2х до 4х раз.
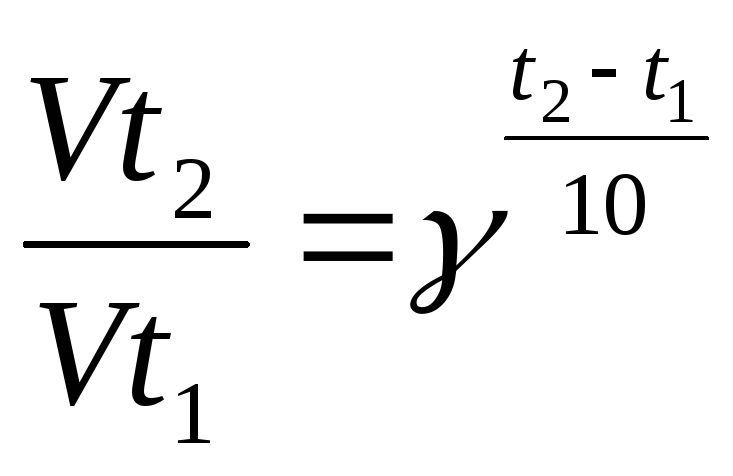 ;
Vt1(t2)
– скорость при соответствующих
температурах, γ-температурный коэффициент
скорость реакции, γ
;
Vt1(t2)
– скорость при соответствующих
температурах, γ-температурный коэффициент
скорость реакции, γ![]() (2;4)
(2;4)
Для того, чтобы реакция произошла, реагирующие частицы должны столкнуться с тем, чтобы их электронные оболочки смогли перекрыться, опыт показывает, что далеко не каждое столкновение приводит к химическому взаимодействию.
Аррениус высказал предположение, что реакционно-способными являются не все, а только активные молекулы, т.е. энергия которых выше средней. Избыток энергии, которым обладают активные молекулы, называется энергией активации; он необходим для преодоления некоторого энергетического барьера, обусловленного силами отталкивания электронных оболочек.
![]()
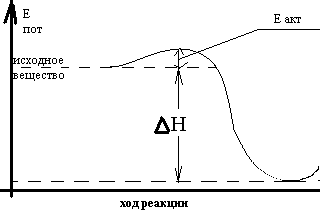
k – константа скорости х.р.
А – константа реакции (своя для каждой)
У=2,7183 – основание ln
R – универсальная газовая постоянная
Т – температура по шкале Кельвина
С увеличением Т k резко увеличивается.
Т=const k↑↑, если ↓Еакт
Это возможно при наличии катализатора.
