
- •Растворы электролитов
- •Совместный гидролиз 2х солей.
- •Окислительно-восстановительные реакции (овр)
- •Термохимия
- •Химическая кинетика и равновесие.
- •3. Влияние катализатора на скорость х.Р.
- •Химическое равновесие
- •4 Моля 2 моля
- •Комплексные соединения.
- •Диссоциация кс.
- •Общие свойства металлов
- •Двойной электрический слой на границе « металл – раствор»
- •Гальванический элемент и его эдс
- •Защита Ме от коррозии
- •Электролиз с растворимым анодом. Применяют при рафинировании Ме от примесей а также при нанесении Ме покрытий
- •Семейство железа.
- •Химические св-ва Fe Co Ni
- •Соединения Fe Co Ni
3. Влияние катализатора на скорость х.Р.
Катализаторы сильно изменяют скорость реакции за счёт участия в промежуточном химическом взаимодействии, но они восстанавливают свой состав после каждого цикла взаимодействия. При гомогенном катализе катализатор и реагирующее вещество составляют одну фазу (газообразную или жидкую). При гетерогенном катализе взаимодействие происходит на поверхности, как правило твёрдого катализатора. Механизм действия катализатора может быть различным, но чаще всего он даёт промежуточные соединения с реагирующими веществами.
А+В=АВ очень медленная реакция, К-катализатор
А+К=АК
+АК+В=АВ+К
А+В=АВ
Е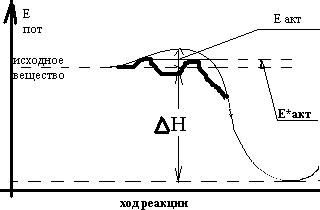 *акт-
энергия активации каталитической
реакции.
*акт-
энергия активации каталитической
реакции.
В присутствии катализатора реакция идёт по иному, более сложному пути, но с меньшей энергией активации.
Отрицательные катализаторы-ингибиторы Vх.р. ↓
В гетерогенном катализе большую роль играет процесс адсорбции, т.е. поверхностной концентрации вещества на катализаторе.
Увеличение концентрации газа на поверхности твёрдого вещества называется адсорбцией.
Есть физическая адсорбция, осуществляемая за счёт сил электромагнитного притяжения, есть химическая адсорбция, когда возникает связь между газом и тв. в-вом
В реакции гетерогенного катализа происходит адсорбция реагирующих веществ на поверхности катализатора. Образуются эти химические соединения с катализатором (промежуточные соединения), которые в дальнейшем вступают в дальнейшие химические взаимодействия. Продукты уходят с поверхности катализатора и весь цикл повторяется.
Адсорбция происходит не на всей поверхности катализатора, а только на небольшой её части (активных центрах)
Каталитические яды прочно адсорбируются на поверхности активных центров и выводят катализатор из действия. Это явление называется отравлением катализатора, а вещества, вызывающие его -каталитическими ядами. (Н2S, H2O пар, соединения As)
Промоторы усиливают каталитическую активность, т.к. способствуют удалению продуктов с поверхности катализатора. Для V2O5 промоторами являются сульфаты щелочных металлов.
Химическое равновесие
-
Реакции протекают необратимо, если продукты уводятся из газовой среды в виде осадка, газа или мало диссоциируемого вещества.
AgNO3+KCl=AgCl+KNO3
Zn+H2SO4=Zn+H2↑
KON+HNO3=KNO3+H2O
-
Обратимые реакции идут до определённого предела и как бы восстанавливаются, идёт обратная реакция.
CO2→←CO+H2O
N2+3H2→←2NH3
Состояние системы, когда концентрация веществ не изменяется во времени называется химическим равновесием. Это равновесие динамичное, подвижное, т.к. одновременно идут как прямая, так и обратная реакции, но одна сводит на нет результаты другой
Критерием химического равновесия является равенство скоростей прямой и обратной реакции.Vпр=Vобр.
|
V1=k1[A][B] V2=k2[C][D] V1=V2 |
k1[A][B]=k2[A][B]
|
 рименим
з. д. м. для прямой и обратной реакции
для уравнения А+В→←С+D
рименим
з. д. м. для прямой и обратной реакции
для уравнения А+В→←С+D
Kc-константа химического равновесия, выраженная через концентрацию, зависит от природы и температуры
В случае гетерогенных реакций в константу равновесия не входит концентрация твёрдой фазы.
Состояние равновесия зависит от: Температуры, концентрации, давления.
Смещение равновесия подчиняется принципу Ле Шателье: «Если изменить одно из условий, при котором система находится в равновесии (С, Т, Р), то равновесие смещается в сторону реакции, противодействующей произведенному воздействию».
