
- •Материальный баланс ванны электроэкстракции цинка
- •1. Электродные реакции
- •1.1 Катодный процесс
- •1.2 Анодный процесс
- •1.3 Суммарная электрохимическая реакция
- •2.Составы электролитов для электроэкстракции цинка
- •2.1 Сульфатный электролит
- •2.2 Хлоридный электролит
- •2.3 Щелочные цинкатные электролиты
- •2.4 Выбор электролита
- •3.Расчет материального баланса ванны электроэкстракции
- •3.1Исходные данные для расчета материального баланса и нахождение параметров ванны. Расчет материального баланса
- •Заключение
- •Библиографический список
ФГАОУ ВПО «Уральский федеральный университет имени первого Президента России Б.Н. Ельцина»
Кафедра Технологии электрохимических производств
Оценка проекта_____________
Члены комиссии_____________
Материальный баланс ванны электроэкстракции цинка
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
КУРСОВАЯ РАБОТА
Руководитель
Доцент, к.т.н. _____________________ Н.И. Останин
Нормоконтролер
Доцент, к.т.н. _____________________ Н.И. Останин
Студент
гр. Х – 410501 _____________________ М.В. Лаптев
Екатеринбург
2014
Содержание
Введение 2
1. Электродные реакции 4
1.1 Катодный процесс 4
1.2 Анодный процесс 5
1.3 Суммарная электрохимическая реакция 7
2.Составы электролитов для электроэкстракции цинка 7
3. Расчет материального баланса ванны электроэкстракции 10
3.1 Исходные данные для расчета материального баланса и нахождение параметров ванны. Расчет материального баланса 11
Заключение 22
Библиографический список 23
Введение
В современной практике применяют два способа получения цинка: пирометаллургический и гидрометаллургический. Основным недостатком первого метода является то, что им нельзя получить чистый цинк, удовлетворяющий современным требованиям. Для этого полученный цинк необходимо рафинировать. Актуальность работы заключается в том, что гидрометаллургический же способ позволяет получать не только более чистый металл, но и повышает комплексное извлечение других металлов. Вместе с тем основные процессы способа можно механизировать. В нашей стране этим способом получают 90% всего цинка. Суть способа заключается в электроэкстракции цинка из сульфатного раствора, который получают выщелачиванием обожжённых сульфидных концентратов [1].
Методом электроэкстракции можно получать цинк высокой чистоты (99,995%). Метод достаточно легко осуществляется технически, что позволяет активно его использовать для получения металла высокого качества [2].
В России гидрометаллургический способ пытался внедрить инженер Лощинский: с 1909 по 1914 гг. он получал цинк на полузаводской установке. Однако дальнейшего распространения способ не получил.
В 1933 году был пущен первый в стране электролизный завод в г. Орджоникидзе. В 1935 году был введен в строй Челябинский цинковый завод [1].
Цель курсовой работы: рассчитать материальный баланс ванны электроэкстракции цинка из сульфатного электролита, определить, какого состава и с какой скоростью подавать электролит в ванну, чтобы поддерживать постоянный состав выходящего электролита
1. Электродные реакции
Электролизер для осаждения цинка представляет собой следующую электрохимическую систему [3]:
 (1.1)
(1.1)
1.1 Катодный процесс
Цинк
является электроотрицательным металлом
( и поэтому в кислых растворах на катоде
следовало бы ожидать преимущественного
разряда ионов водорода, а не осаждения
цинка. Однако ток обмена водорода на
цинке мал и, следовательно, перенапряжение
выделения водорода на нем очень велико.
Это дает возможность осаждать цинк на
катоде из кислых растворов. Основными
реакциями на катоде, погруженном в
кислый сульфатный раствор, содержащий
ионы цинка, являются следующие:
и поэтому в кислых растворах на катоде
следовало бы ожидать преимущественного
разряда ионов водорода, а не осаждения
цинка. Однако ток обмена водорода на
цинке мал и, следовательно, перенапряжение
выделения водорода на нем очень велико.
Это дает возможность осаждать цинк на
катоде из кислых растворов. Основными
реакциями на катоде, погруженном в
кислый сульфатный раствор, содержащий
ионы цинка, являются следующие:
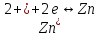 (1.2)
(1.2)
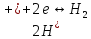 (1.3)
(1.3)
Равновесный
потенциал водорода в этом растворе
близок к нулю, равновесный потенциал
цинка
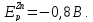 Кривые поляризации цинка идут значительно
круче, чем водорода, так как ток обмена
цинка на несколько порядков больше. При
погружении цинкового электрода в раствор
на нем устанавливается некоторый
стационарный потенциал, характеризующийся
равенством катодного тока разряда ионов
водорода и анодного тока ионизации
цинка. То есть цинк будет растворяться
в электролите с выделением водорода.
Стационарный потенциал при этом
положительнее равновесного потенциала
цинка, но отрицательнее равновесного
потенциала водорода. При катодной
поляризации цинкового электрода в
интервале потенциалов от стационарного
до равновесного рост катодного потенциала
уменьшает растворение цинка, но на
электроде продолжает идти только процесс
выделение водорода, причем с увеличивающейся
скоростью. При равенстве катодного
потенциала и равновесного растворение
цинка прекращается. При дальнейшем
возрастании катодного потенциала
процесс сопровождается совместным
выделением на электроде цинка и водорода,
причем рост потенциала приводит к
увеличению выхода по току цинка. Рост
катодного потенциала увеличивает выход
по току цинка вплоть до наступления
концентрационной поляризации по этому
металлу. Последняя вновь уменьшает долю
тока, расходуемого на разряд ионов
цинка.
Кривые поляризации цинка идут значительно
круче, чем водорода, так как ток обмена
цинка на несколько порядков больше. При
погружении цинкового электрода в раствор
на нем устанавливается некоторый
стационарный потенциал, характеризующийся
равенством катодного тока разряда ионов
водорода и анодного тока ионизации
цинка. То есть цинк будет растворяться
в электролите с выделением водорода.
Стационарный потенциал при этом
положительнее равновесного потенциала
цинка, но отрицательнее равновесного
потенциала водорода. При катодной
поляризации цинкового электрода в
интервале потенциалов от стационарного
до равновесного рост катодного потенциала
уменьшает растворение цинка, но на
электроде продолжает идти только процесс
выделение водорода, причем с увеличивающейся
скоростью. При равенстве катодного
потенциала и равновесного растворение
цинка прекращается. При дальнейшем
возрастании катодного потенциала
процесс сопровождается совместным
выделением на электроде цинка и водорода,
причем рост потенциала приводит к
увеличению выхода по току цинка. Рост
катодного потенциала увеличивает выход
по току цинка вплоть до наступления
концентрационной поляризации по этому
металлу. Последняя вновь уменьшает долю
тока, расходуемого на разряд ионов
цинка.
Увеличение концентрации ионов цинка, повышение температуры и скорости циркуляции электролита способствует уменьшению поляризации для разряда цинка, облегчая протекание этого процесса, и в то же время практически не оказывает влияния на перенапряжение водорода. Повышение кислотности, наоборот, будет благоприятствовать разряду ионов водорода и повлечет за собой понижение выхода по току цинка. Однако решающее влияние на выход по току при электроэкстракции оказывают примеси других металлов и ионов, обычно находящиеся в растворе сульфата цинка [3].
