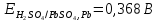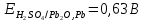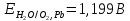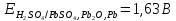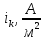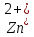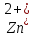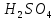- •Материальный баланс ванны электроэкстракции цинка
- •1. Электродные реакции
- •1.1 Катодный процесс
- •1.2 Анодный процесс
- •1.3 Суммарная электрохимическая реакция
- •2.Составы электролитов для электроэкстракции цинка
- •2.1 Сульфатный электролит
- •2.2 Хлоридный электролит
- •2.3 Щелочные цинкатные электролиты
- •2.4 Выбор электролита
- •3.Расчет материального баланса ванны электроэкстракции
- •3.1Исходные данные для расчета материального баланса и нахождение параметров ванны. Расчет материального баланса
- •Заключение
- •Библиографический список
1.2 Анодный процесс
При электролитическом рафинировании металлов на аноде происходит полезный процесс – растворение чернового металла. В случае электролиза цинка применять растворимые электроды нельзя, так как при ионизации цинка и примесей многие из них, переходя в раствор, будут соосаждаться с цинком, ухудшая качество катодных осадков. Следовательно, необходимо, чтобы продукты анодного процесса не загрязняли электролит, а сам процесс шел с минимальным расходом электроэнергии. Кроме того, вещества, выделяющиеся на аноде, не должны быть токсичными. В наибольшей степени этим требованиям удовлетворяет процесс анодного разложения воды с образованием кислорода (1.3)
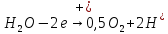 (1.3)
(1.3)
При этом образуются ионы водорода, которые могут восстанавливаться на катоде вместе с цинком, снижая выход последнего.
В качестве материала анода, обеспечивающего осуществление нужного процесса, который бы при анодном потенциале с учетом перенапряжения кислорода до 2 В не окислялся и не растворялся в электролите используется свинец (чаще Pb +1% Ag). На таком аноде возможно протекание следующих электрохимических реакций:
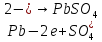 (1.4)
(1.4)
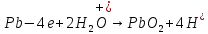 (1.5)
(1.5)
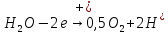 (1.6)
(1.6)
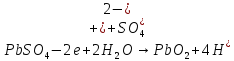 (1.7)
(1.7)
Сопоставим равновесные потенциалы этих реакций:
Таким
образом, термодинамически наиболее
вероятен процесс ионизации свинца. В
реальных условиях электролиза также
возможен этот процесс, поскольку он
протекает с меньшей поляризацией, чем
остальные. Однако эта электрохимическая
реакция будет проходить кратковременно,
так как в прианодном слое быстро наступает
предел растворимости сульфата свинца
и электрод покрывается его пленкой.
Сульфат свинца обладает низкой
электропроводностью и для поддержания
заданной скорости электролиза приходится
увеличивать анодную поляризацию. В
порах пленки сульфата свинца плотность
тока возрастает и становится возможным
протекание более энергоемкой реакции
(1.5). Диоксид свинца, откладываясь в порах
рыхлой пленки сульфата, закрывает их,
после чего растворение свинцового анода
прекращается, так как диоксид свинца
обладает электронной проводимостью,
то при дальнейшей поляризации анода
становится возможным протекание процесса
разложения воды с выделением кислорода
(1.6). Этот процесс идет на диоксиде свинца
с большим перенапряжением и протекает
с необходимой скоростью (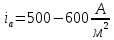 )
при анодном потенциале около 2 В[3].
)
при анодном потенциале около 2 В[3].
1.3 Суммарная электрохимическая реакция
С учетом вышеизложенного в электролизере протекает суммарная электрохимическая реакция[1]:
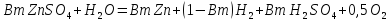 (1.8)
(1.8)
2.Составы электролитов для электроэкстракции цинка
2.1 Сульфатный электролит
|
Способ электролиза |
|
Нейтральный электролит |
Отработанный электролит | |
|
|
|
| ||
|
Низкокислотный |
380-500 |
40-120 |
50-60 |
90-120 |
|
Интенсифицированный |
500-700 |
150-170 |
55-60 |
150-200 |
|
Способ Тейтона |
1000-1200 |
200-230 |
30-50 |
270-300 |
Таблица 1- Составы электролита при электроосаждении цинка (г/л)
Кроме
того, в электролите, как было указано
выше, всегда присутствует некоторое
количество примесей сульфатных солей
других металлов, таких как Mn,
Fe,
Cu,
Niи
др. Содержание основных компонентов и
примесей оказывает существенное влияние
на процесс электролиза. Так, в условиях
применения высоких катодных плотностей
тока (550-700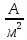 )
требуется наличие у электрода достаточного
содержания разряжающихся ионов цинка,
что может быть обеспечено высокой
концентрацией сульфата цинка в объеме
раствора. В этом случае выход по току
цинка будет достаточно высок, а катодный
осадок – иметь плотную структуру. Однако
при чрезмерно высоком содержании
сульфата цинка заметно снижается
электропроводность электролита. Исходя
из этого и основываясь на практике
работы советских и зарубежных заводов,
принимают концентрацию ионов цинка в
отработанном электролите не менее 50-55
г/л.
)
требуется наличие у электрода достаточного
содержания разряжающихся ионов цинка,
что может быть обеспечено высокой
концентрацией сульфата цинка в объеме
раствора. В этом случае выход по току
цинка будет достаточно высок, а катодный
осадок – иметь плотную структуру. Однако
при чрезмерно высоком содержании
сульфата цинка заметно снижается
электропроводность электролита. Исходя
из этого и основываясь на практике
работы советских и зарубежных заводов,
принимают концентрацию ионов цинка в
отработанном электролите не менее 50-55
г/л.
Достаточное высокое содержание серной кислоты в электролите обеспечивает повышенную электропроводность, снижение напряжения на ванне и, как следствие, удельного расхода электроэнергии. Однако с повышением концентрации серной кислоты существенно возрастает скорость выделения водорода на катоде, поэтому доля тока, идущая на разряд ионов цинка, падает. Для каждого значения катодной плотности тока имеется некоторая оптимальная концентрация серной кислоты в электролите, при которой наблюдается минимальный расход электроэнергии. Установлено, что с повышением плотности тока возрастает и оптимальная концентрация кислоты и наоборот. В процессе электролиза в ванну подается нейтральный электролит, содержащий сульфат цинка и серную кислоту. Следовательно, при выборе состава электролита необходимо знать не только содержание цинка в отработанном электролите, но и в поступающем нейтральном растворе.
Наличие в электролите вредных примесей, таких как Ge, As, Cu, Co и других резко снижает выход по току цинка. Поэтому поступающий в ванну нейтральный раствор предварительно тщательно очищается от указанных примесей.
Процесс электроэкстракции цинка из сульфатных растворов, даже в случае применения высоких и сверхвысоких плотностей тока, сохраняет ряд недостатков, и в первую очередь применение свинцовых анодов, а также неиспользование анодного кислорода [1].