
- •Установление электронной структуры
- •Заполнение электронных оболочек
- •Векторная модель атома
- •Магнитный момент свободного атома
- •Правила Хунда
- •Электронная конфигурация редкоземельных металлов
- •Типы кристаллических структур чистых редкоземельных металлов
- •Магнитные структуры
- •Магнитокристаллическая анизотропия и магнитострикция
- •Теория геликоидальной спиновой структуры
- •Магнитоупругие свойства РЗМ
- •Магнитокристаллическая анизотропия в гексагональном кристалле.
- •Природа магнитокристаллической анизотропии в РЗМ
- •Элементы теории магнитокристаллической анизотропии по механизму кристаллического поля
- •Температурная зависимость Ms, klm, λlm
- •Применение чистых РЗМ в качестве магнитов
- •Интерметаллические соединения.
- •Кристаллические структуры
- •Соединения РЗМ-3d
- •Методы измерения магнитострикции
- •Магнитострикция соединений 4f-3d-переходный металл
- •Влияние атомов внедрения на магнитные свойства интерметаллидов 4f-3d-переходный металл
- •Механизм влияния атомов внедрения на магнитные свойства материалов
- •Постоянные магниты
- •Основные характеристики магнитотвердого материала
- •Материалы для постоянных магнитов
- •Примеры развития технических устройств, связанного с развитием постоянных магнитов
- •Перспективы дальнейшего развития магнитотвердых материалов

Установление электронной структуры
Вспомним некоторые моменты атомной физики и квантовой механики. Когда мы имеем дело с одноэлектронным атомом, (рисунок ядра атома с положительно заряженным ядром и вокруг него можно представить вращающиеся электроны). Энергетическое состояние электрона может быть описано четырьмя квантовыми числами: главным квантовым числом n, орбитальным квантовым числом l, магнитным квантовым числом ml, (проекция орбитального момента на выделенное направление), спиновым квантовым числом ms (проекция спина на выделенное направление). Электроны – это частицы, подчиняющиеся статистике Ферми-Дирака (фермионы) [правилу запрета Паули]. В ансамбле одинаковых фермионов не может быть двух , обладающих одинаковыми квантовыми числами. Главное квантовое число n может принимать положительные целые значения, l может принимать значения от 0 до (n-1), ml принимает значения от -l до l через единицу (всего 2l+1 значений), ms принимает значения ± ½. Совокупность электронов атома с определенным значением главного квантового числа n образует электронный слой. Совокупность электронов с заданными n и l образует оболочку.
Заполнение электронных оболочек
Если вокруг ядра «вращается» только один электрон (атом водорода), то возможным его состояниям отвечают энергетические уровни, определяемые набором четырех квантовых чисел (n=1, l=0, ml=0, ms=± ½). В простейшей модели многоэлектронного атома – без учета взаимодействий между электронами – заполнение электронных оболочек происходит так, что электроны последовательно заполняют состояния с минимальным значением энергии. Сначала заполняется оболочка с n=1, на которой могут разместиться 2 электрона. Эта оболочка обозначается как 1s2. Здесь первый индекс соответствует главному квантовому числу, буква s показывает, что l=0, а верхний индекс 2 показывает, что в этой оболочке находятся 2 электрона. Следующей заполняется оболочка с n=2 и l=0. Эту оболочку можно записать как 2s2. Далее заполняется следующая оболочка 2p с n=2 и l=1. В ней может находиться 6 электронов, так как ml может принимать значения -1, 0, 1 и каждому значению соответствуют два значения проекции спина. Дальнейшая схема заполнения электронных оболочек по этой модели представлена в таблице 1.
Таблица 1:
|
|
|
l |
|
|
|
|
|
|
|
|
n |
s |
p |
d |
f |
g |
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
2 |
2 |
6 |
|
|
|
|
|
|
|
|
|
3 |
2 |
6 |
10 |
|
|
|
|
|
|
|
|
4 |
2 |
6 |
10 |
14 |
|
|
|
|
|
|
|
5 |
2 |
6 |
10 |
14 |
18 |
Полностью заполненные оболочки называются замкнутыми.
Модель, на основе которой рассмотрено заполнение, соответствует действительности лишь до атома аргона Ar с порядковым номером 18 и электронной структурой 1s2 2s2 2p6 3s2 3p6. У следующего элемента периодической системы химических элементов K заполняется не 3d
1
оболочка, как следовало ожидать, а 4s. Это связано с так называемой «центробежной» энергией, зависящей от оболочки, в которой находится электрон. Это приводит к тому, что начинают заполняться состояния с большими n, но меньшими l, поскольку большему значению l соответствуют большие значения момента импульса электрона и его «центробежной» энергии.
Химические элементы с не полностью заполненной 3d оболочкой называются 3dпереходными металлами, или металлами группы железа. Элементы с частично заполненной 4f оболочкой называются редкоземельными металлами, или лантаноидами, или лантанидами.
Для нас интересны электроны 4f, это та самая оболочка в редкоземельных элементах, которая несет магнетизм, поскольку у 13 элементов эта оболочка не является заполненной. У лантана 4f электронов нет, а у лютеция эта оболочка полностью заполнена. В промежутке между этими элементами оболочка заполнена частично, что приводит возникновению специфических магнитных свойств у этих металлов в конденсированной фазе. Выше была рассмотрена модель с одним электроном, однако мы имеем дело с многоэлектронными атомами, для описания заполнения оболочек которых необходимо применять векторную модель атома.
Векторная модель атома
В предыдущем параграфе состояние электронов в атоме характеризовалось электронной конфигурацией. Если электроны заполняют целиком несколько электронных оболочек, то орбитальные и спиновые моменты электронов компенсируют друг друга и суммарный орбитальный и суммарный спиновый магнитные моменты всех электронов равны нулю. У всех инертных газов полные моменты равны нулю. У атомов щелочных металлов с одним электроном в s-состоянии сверх замкнутых оболочек суммарный спиновый момент равен ±½, орбитальный момент равен нулю, таким образом полный момент электронов атома равен спиновому.
Электронная конфигурация не полностью описывает состояние атома, поскольку не учитывает «направления» спинового и орбитального моментов. Поясним на примере. В атоме углерода в 2p оболочке находятся 2 электрона. Их орбитальные моменты могут быть параллельны, тогда у атома будет результирующий орбитальный момент, а могут быть антипараллельны и тогда у атома результирующего орбитального момента не будет. Ситуация со спиновыми моментами аналогична. Таким образом каждой электронной конфигурации соответствует несколько состояний, различающихся значениями полного момента электронов. Это объясняется тем, что в модели самосогласованного поля (самосогласованным называется результирующее поле, создаваемое ядром атома и электронной оболочкой) не учитываются два типа взаимодействия: остаточное взаимодействие (часть кулоновского взаимодействия не сводящаяся к центральносимметричному согласованному полю) и спин-орбитальное взаимодействие.
Обычно в атомах спин-орбитальное взаимодействие меньше остаточного и последним можно пренебречь. Такое приближение называется случаем Расселя-Саундерса, или РассельСаундерской связью, или LS-связью, или нормальной связью. Полный момент атома с Рассель-Саундерской связью определяется по формуле (1):
|
|
|
|
|
|
|
|
, |
(1) |
|
|
|
|
|
J |
=L S |
|||
|
N |
|
, |
|
N |
|
|
|
|
где L=∑ li |
S=∑ si – полные орбитальный и спиновый моменты соответственно. |
||||||||
|
i=1 |
|
|
|
i =1 |
|
|
|
|
2

Такая связь реализуется в переходных атомах группы железа.
В тяжелых атомах реализуется jj-связь, поскольку спин-орбитальное взаимодействие превосходит электростатическое. Полный момент атома с jj-связью определяется по формуле (2):
|
N |
|
|
|
, |
(2) |
|
J |
=∑ ji |
i=1
где ji=si li .
В чистом виде в атомах jj-связь не реализуется, а реализуется промежуточная связь, поскольку спин-орбитальное и электростатическое взаимодействия сравнимы по порядку величины.
Переход от LS-связи к jj-связи с ростом заряда ядра объясняется разной зависимостью взаимодействия от Z: электростатическое ~Z, а спин-орбитальное ~Z4.
Магнитный момент свободного атома
Поскольку при заполнении оболочки складываются орбитальные и спиновые моменты электронов, то складываются и соответствующие им магнитные моменты. Из квантовой механики известно, что электрон обладает собственным моментом количества движения, или спином ps :
ps = s s 1 (3)
Спину соответствует спиновый магнитный момент электрона μs:
s=2 B |
|
=2 |
B |
ps ,(4) |
||||
s s 1 |
||||||||
|
||||||||
|
|
|
|
|
|
|
||
где |
B = |
e |
- магнетон Бора. |
|||||
2mc |
||||||||
|
|
|
|
|
|
|||
В атоме электрон занимает определенную оболочку и обладает определенным моментом количества движения, связанным с оболочкой и определяемым орбитальным квантовым
числом l, pl :
pl = l l 1 (5)
Магнитный момент, связанный с орбитальным движением электрона, l записывается в виде:
l= B l l 1 (6)
Полный магнитный магнитный момент атома складывается из орбитального и спинового моментов каждого электрона аналогично полному механическому моменту. Поскольку правила сложения механических моментов определены выше, то магнитный момент можно записать через механический:
J = g J B |
J J 1 |
, (7) |
|
|
|
где gJ называется g-фактором Ланде: |
|
||||
g J =1 |
J J 1 S S 1 − L L 1 |
|
(8) |
||
|
|||||
|
|
2J J 1 |
|
||
Из формулы 8 можно видеть справедливость коэффициентов в формулах (4) и (6).
3
Правила Хунда
Правила Хунда — правила для нахождения самых глубоких уровней энергии, соответствующих определенной электронной конфигурации атома при нормальной связи спиновых и орбитальных моментов образующих эти конфигурации электронов. Правила Хунда были установлены эмпирически в 1925 году.
1.Основным является уровень с максимальным полным спином S при определенной электронной конфигурации.
2.Основному состоянию атома при наибольшем значении S соответствует состояние с максимальным полным орбитальным моментом L.
3.При заполнении первой половины оболочки полный механический момент атома J
минимален, то есть L и |
S |
антипараллельны (J=L-S). При заполнении второй |
||
|
|
|
S |
параллельны (J=L+S). |
половины оболочки J максимален, то есть L и |
||||
|
|
|
|
|
Электронная конфигурация редкоземельных металлов
Если бы электронные конфигурации РЗМ определялись нормальной связью, то выглядели бы следующим образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4fn 5s2 5p6 5d1 6s2. Общее число электронов составляет 57+n. Фактор переходности этих элементов проявляется в том, что при переходе от элемента к элементу в ряду лантана, внешняя электронная оболочка 5d1 и 6s2 остается, а заполняется состояние внутри 4f от 1 до 14.
Реальная электронная конфигурация атомов РЗМ представлена в таблицах 2 и 3.
Таблица 2: белов, белянчикова и др, боровик и др
|
Обо |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
знач |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d |
5f |
6s |
|
ени |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
57 |
La |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
|
2 |
6 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
58 |
Ce |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
2 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
59 |
Pr |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
3 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
Nd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
4 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
61 |
Pm |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
5 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
62 |
Sm |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
6 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
63 |
Eu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
64 |
Gd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
65 |
Tb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
8 |
2 |
6 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
66 |
Dy |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
10 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
67 |
Ho |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
11 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
68 |
Er |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
12 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
69 |
Tu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
13 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
Yb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
71 |
Lu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4

|
Обо |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
знач |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d |
5f |
6s |
|
ени |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
39 |
Y |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3:
|
Обо |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
знач |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p |
4d |
4f |
5s |
5p |
5d 5f |
6s |
|
ени |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
57 |
La |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
|
2 |
6 |
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
58 |
Ce |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
1 |
2 |
6 |
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
59 |
Pr |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
3 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
Nd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
4 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
61 |
Pm 2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
5 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
62 |
Sm |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
6 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
63 |
Eu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
64 |
Gd |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
7 |
2 |
6 |
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
65 |
Tb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
9 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
66 |
Dy |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
10 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
67 |
Ho |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
11 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
68 |
Er |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
12 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
69 |
Tu/ |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
13 |
2 |
6 |
|
2 |
Tm |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
Yb |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
71 |
Lu |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
10 |
14 |
2 |
6 |
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
39 |
Y |
2 |
2 |
6 |
2 |
6 |
10 |
2 |
6 |
1 |
|
2 |
|
|
|
Проследим теперь за изменением квантовых числе S, L и J. Не совпадет что-то из рассказа и двух таблиц. + надо брать таблицы с величинами магнитных моментов
Величины L, S и J, полученные применением правила Хунда представлены на рисунке 1.
5
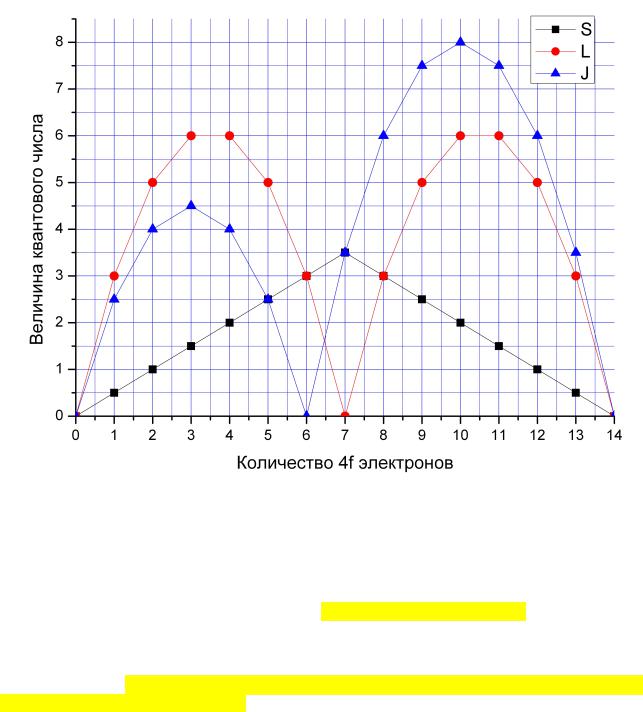
Рисунок 1:
Из рисунка видно, что орбитальный момент Gd равен нулю. Это состояние интересно тем, что электронная оболочка пространственно симметрична, поэтому такая конфигурация электронов слабо взаимодействует с электрическими полями, особенно с их градиентами кристаллической решетке. Таким образом чистый Gd и его сплавы и соединения как правило имеют значительно меньшую по величине магнитокристаллическую анизотропию.
В таблице 4 приведены значения количества 4f электронов в ионах РЗМ, полного спина, полного орбитального момента, полного механического момента, g-фактора и магнитного момента электронной оболочки. Магнитный момент электронной оболочки атома был рассчитан по формулам (7) и (8) в приближении LS-связи. В таблице значения приведены в магнетонах Бора. Такие цифры получаются для величины магнитного момента 4f оболочки свободного редкоземельного атома. Как видно из таблицы, у тяжелых элементов величины магнитных моментов существенно выше, чем у легких. В таблице приведены некоторые данные для металлических состояний элементов, то есть чистых металлов в конденсированном состоянии.
Таблица 4 - Некоторые параметры R ионов в свободном состоянии (теоретические) и в металлах (экспериментальные) при 4,2 K.
R-ион |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Число 4f электронов |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
0 |
1/2 |
1 |
3/2 |
2 |
5/2 |
3 |
7/2 |
3 |
5/2 |
2 |
3/2 |
1 |
1/2 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L |
0 |
3 |
5 |
6 |
6 |
5 |
3 |
0 |
3 |
5 |
6 |
6 |
5 |
3 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
J |
0 |
5/2 |
4 |
9/2 |
4 |
5/2 |
0 |
7/2 |
6 |
15/2 |
8 |
15/2 |
6 |
7/2 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g |
- |
6/7 |
4/5 |
8/11 |
3/5 |
2/7 |
- |
2 |
3/2 |
4/3 |
5/4 |
6/5 |
7/6 |
8/7 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
gJ |
|
2,14 |
3,2 |
3,27 |
2,4 |
0,72 |
0 |
7 |
9 |
10 |
10 |
9 |
7 |
4 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
