
- •Установление электронной структуры
- •Заполнение электронных оболочек
- •Векторная модель атома
- •Магнитный момент свободного атома
- •Правила Хунда
- •Электронная конфигурация редкоземельных металлов
- •Типы кристаллических структур чистых редкоземельных металлов
- •Магнитные структуры
- •Магнитокристаллическая анизотропия и магнитострикция
- •Теория геликоидальной спиновой структуры
- •Магнитоупругие свойства РЗМ
- •Магнитокристаллическая анизотропия в гексагональном кристалле.
- •Природа магнитокристаллической анизотропии в РЗМ
- •Элементы теории магнитокристаллической анизотропии по механизму кристаллического поля
- •Температурная зависимость Ms, klm, λlm
- •Применение чистых РЗМ в качестве магнитов
- •Интерметаллические соединения.
- •Кристаллические структуры
- •Соединения РЗМ-3d
- •Методы измерения магнитострикции
- •Магнитострикция соединений 4f-3d-переходный металл
- •Влияние атомов внедрения на магнитные свойства интерметаллидов 4f-3d-переходный металл
- •Механизм влияния атомов внедрения на магнитные свойства материалов
- •Постоянные магниты
- •Основные характеристики магнитотвердого материала
- •Материалы для постоянных магнитов
- •Примеры развития технических устройств, связанного с развитием постоянных магнитов
- •Перспективы дальнейшего развития магнитотвердых материалов

этом одним из узлов холодильного агрегата должен быть гадолиниевый элемент. В зависимости от организации процессов теплообмена, магнитное рабочее тело может быть разной формы, например, стержень, движущийся возвратно-поступательно, вращающееся колесо и др.
Разумеется, гадолиний достаточно дорогой материал, однако поскольку до настоящего момента он не добывался специально, а лишь совместно с, например, неодимом, самарием, поэтому на складах в Китае его скопилось очень много и цены в данный момент на него достаточно низки (в 4-5 раз меньше, чем на неодим).
Было еще одно применение чистых редкоземельных металлов. В 60-70-е гг использовали сплавы Dy-Er в качестве магнитных сердечников. В 3d металлах самая высокая индукция насыщения у сплава пермендюр (Fe-Co) достигает величины Bs~2,4 Тл. Индукция насыщения лимитирует магнитный поток через единицу площади поперечного сечения сердечника. На сплавах типа Dy-Er было получено Bs~3,5 Тл, то есть примерно в полтора раза выше, чем у пермендюра. А Er и Dy были выбраны, потому что знак первой константы магнитокристаллической анизотропии у РЗМ различен: у Tb, Dy, Ho это отрицательная величина, а у Er, Tm она положительна, то есть сплавляя элементы с разным знаком этого коэффициента, можно минимизировать общую магнитокристаллическую анизотропию сплава и тем самым обеспечить достаточно легкое насыщение в относительно небольшом магнитном поле. Правда, этот материал может работать только при низких температурах, поскольку температура Кюри у всех, исключая гадолиний, РЗМ ниже комнатной.
Этими двумя прямыми в магнитном отношении применениями чистых РЗМ. Больше особо широких применений не реализовано, зато реализованы применения РЗМ сплавов и соединений с другими металлами.
Интерметаллические соединения.
В узком смысле, интерметаллическими соединениями, или интерметаллидомами, называют кристаллы, представляющие представляющие собой соединения металлов друг с другом, в широком смысле двухили многокомпонентные кристаллы, электронное строение которых имеет характерные признаки металла. (Большая физическая энциклопедия).
Многие исследователи пытались установить общее правило формирования таких соединений, или фаз, то есть установить при каких факторах, характеризующих компоненты A и B образуется тот или иной интерметаллид. Существование попыток известно с 1839 года начиная с работ Юма Розери. Однако проблема оказалась весьма сложной и полной ясности в этом вопросе не достигнуто до сих пор, но определенные закономерности, которые здесь существуют были выявлены: во-первых, геометрический фактор, то есть соотношение
размеров атомов компонентов A и B RA , во-вторых, электронный фактор. Электронный
RB
фактор — это количество валентных, или коллективизирующихся, электронов, приходящихся на один атом интерметаллического соединения. Рассмотрим, как срабатывает тот или иной фактор.
Геометрический фактор. Возьмем, например, такую структуру — фаза Лавеса — AB2 наибольшее число известных фаз имеет соотношение компонентов 1:2 и характеризуются плотными упаковками с чередование слоев, причем размер атома A должен быть больше,
|
|
|
|
|
RA |
|
|
|
|
|
|
||
чем размер атома B. Выяснилось, что при |
|
~1,1 |
возникает структура типа MgZn2, это так |
||||||||||
RB |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
RA |
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
называемая структура |
c14, |
|
или |
гексагональная решетка. Если |
|
~1,2 , то |
возникает |
||||||
|
RB |
||||||||||||
|
|||||||||||||
структура типа MgCu2 |
— |
это |
структурный тип |
|
|
— кубический. Если |
отношение |
||||||
|
c15 |
||||||||||||
40

RA |
~1,3 , то возникает структура типа MgNi2, структурный тип c36, тетраэдрическая |
RB |
решетка. Такие закономерности были выявлены и достаточно хорошо работают на большинстве систем металл-металл.
В таблице 13 приведены значения электронного фактора и тип решетки, в которую кристаллизуется соответствующее соединение.
Таблица 13:
Система |
c15 |
— кубическая |
c36 |
— тетраэдрическая |
c14 |
— гексагональная |
|
|
|
|
|
|
|
Mg(Cu, Zn)2 |
1,33÷1,75 |
1,83÷1,90 |
1,98÷2,00 |
|||
|
|
|
|
|
|
|
Mg(Cu, Al)2 |
1,33÷1,73 |
1,84÷1,95 |
2,03÷2,05 |
|||
|
|
|
|
|
|
|
Mg(Cu, Si)2 |
1,33÷1,71 |
1,81÷1,86 |
1,91÷2,02 |
|||
Не смотря на то, что системы на самом деле тройные, можно считать, что они двойные. Cu
— одновалентна, Zn — двухвалентен, Al — трехвалентен, Si — четырехвалентен.. Количество коллективизированных электронов, приходящихся на один атом можно менять за счет введения металла более высокой валентности.
Цифры в таблице — среднее число валентных электронов, приходящихся на атом такого интерметаллида. В зависимости от числа валентных электронов будет изменяться тип решетки.
В таблице 14 представлены все известные на сегодняшний день бинарные химические соединения, в состав которых входит РЗМ (RmMen).
Таблица 14:
3-1 |
2-1 |
5-3 |
3-2 |
4-3 |
5-4 |
1-1 |
1-2 |
1-3 |
2-7 |
6-23 |
1-5 |
1-6 |
2-17 |
1-12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Al |
Al |
Ge |
Al |
Co |
Si |
Al |
Al |
Al |
Al |
Fe |
Co |
Cu |
Co |
Mn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Co |
In |
In |
|
|
Ge |
Ga |
In |
In |
Ni |
Mn |
Ni |
|
Ni |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni |
|
|
|
|
|
Ge |
Ga |
Ag |
Co |
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
In |
|
|
|
|
|
Cu |
Si |
Au |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag |
Ge |
Ni |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Au |
Sn |
Co |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni |
Cu |
Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zn |
Ag |
Pd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Au |
Sn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Co |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ru |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rh |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Os |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
41
3-1 2-1 5-3 3-2 4-3 5-4 1-1 1-2 1-3 2-7 6-23 1-5 1-6 2-17 1-12
Ir
Pt
Zn
Не все РЗМ могут образовывать соединения, указанные в таблице. Например, у Eu, Yb и Ce валентность может быть отличной от 3.
На рисунке 25 приведена диаграмма состояния системы Gd-Co («Диаграммы состояний двойных металлических систем»). Gd и Co друг в друге почти не растворяются. Эвтектически образуется только соединение Gd2Co17, остальные семь соединений образуются по перитектическим реакциям.
42
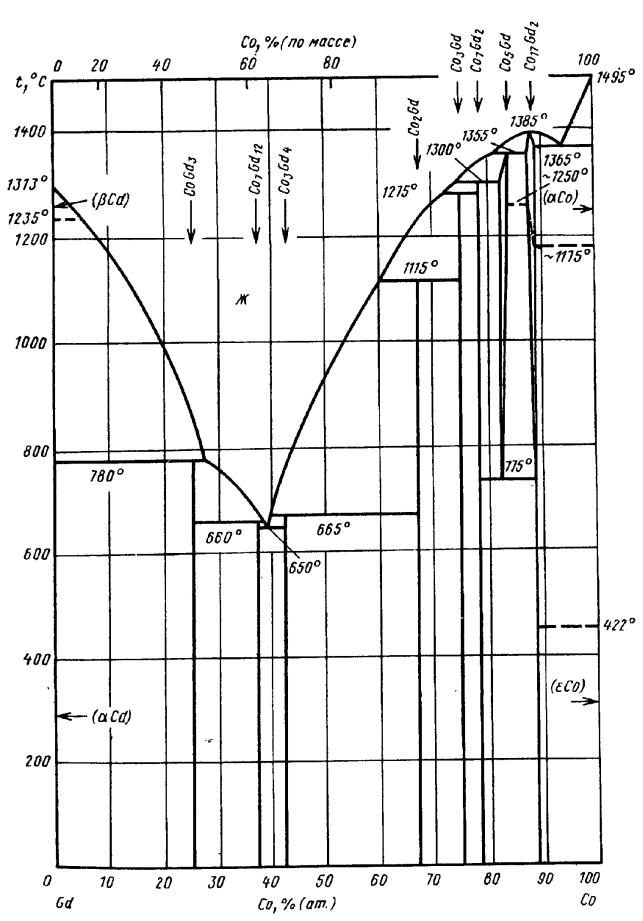
Рисунок 25:
43
