
22_komplexnye_soedinenia
.pdf
Комплексные (координационные) соединения |
|
ВВЕДЕНИЕ.............................................................................................................. |
2 |
Основные понятия в химии координационных соединений. ............................. |
3 |
Номенклатура координационных соединений..................................................... |
4 |
Комплексонаты.................................................................................................... |
7 |
Сандвичевые металлокомплексные соединения. Ферроцен. ......................... |
9 |
Металлокластеры. ............................................................................................... |
9 |
Пространственное строение координационных соединений. .......................... |
11 |
Изомерия комплексных соединений................................................................... |
12 |
Комплексообразование в растворах.................................................................... |
15 |
Гидролиз как процесс комплексообразования............................................... |
20 |
Амфотерность как процесс комплексообразования...................................... |
22 |
Влияние комплексообразования на окислительно-восстановительные |
|
свойства центрального атома........................................................................... |
22 |
Химическая связь в координационных соединениях........................................ |
24 |
Теория валентных связей. ................................................................................ |
24 |
Теория кристаллического поля........................................................................ |
27 |
ЛИТЕРАТУРА....................................................................................................... |
33 |
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

ВВЕДЕНИЕ
Комплексные (координационные) соединения чрезвычайно широко распространены в живой и неживой природе, применяются в промышленности, сельском хозяйстве, науке, медицине. Так, хлорофилл – это комплексное соединение магния с порфиринами, гемоглобин содержит комплекс железа(II) с порфириновыми циклами. Многочисленные минералы, как правило, представляют собой координационные соединения металлов.
Подавляющее большинство соединений металлов побочных подгрупп (d- и f- металлы) относятся к числу так называемых координационных или комплексных соединений. Эти вещества являются устойчивыми в растворе, твердом состоянии и являются стехиометрически достоверными, но в тоже время они являются комбинацией из других химических соединений, которые сами по себе являются стабильными. Известны они с 19 века, например:
Берлинская лазурь (Дисбах, 1800-1815гг.): KCN·Fe(CN)2.Fe(CN)3 или KFe[Fe(CN)6]
соли Тассера (1798г): CoCl3·6NH3 желтая; CoCl3·5NH3 пурпурная; CoCl3·4NH3 зелёная; CoCl3·3NH3 фиолетовая.
Для объяснения строения аммиакатов солей металлов и им подобных соединений потребовался почти столетний напряженный труд многих ученых. Некоторые комплексные соединения, сыгравшие большую роль в развитии координационной химии, называют по имени авторов, впервые их получивших, например :
соль Цейзе – K[Pt(C2H4)Cl3]; соль Косса – K[Pt(NH3)Cl3];
соль Пейроне – цис-[Pt(NH3)2Cl2]; соль Магнуса – [Pt(NH3)4][PtCl4] ;
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

А. Вернер
(1866-1919)
Согласно теории Вернера – Миолати следует, что существует три типа классических вернеровских комплексов:
1.координационные ацидосоединения, во внутренней сфере которых содержатся только кислотные остатки;
2.молекулярные координационные соединения, во внутренней сфере которых содержатся только лиганды в молекулярной форме;
3.смешанные ацидо-молекулярные координационные соединения.
Основные понятия в химии координационных соединений.
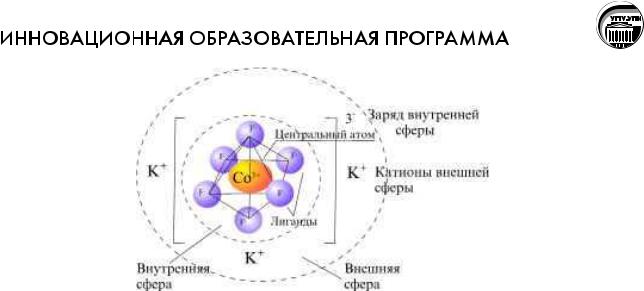
Центральное положение в координационном соединении занимает центральный атом (ион металла), который называют комплексообразователь, вокруг которого формируется координационная сфера из заряженных ионов или нейтральных молекул, которые называются лигандами. Число лигандов, окружающих комплексообразователь, называется координационным числом.
Различают внутреннюю и внешнюю координационные сферы. Внутренняя включает ионы, которые непосредственно связаны с атомом металла комплексообразователя. При записи формул координационных соединений внутреннюю координационную сферу заключают в квадратные скобки:
[Co(NH3)5Cl]Cl2; K3[CoF6]; KFe[Fe(CN)6] ; [Cu(NH3)4]Cl2 и тд.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
Номенклатура координационных соединений
Первым в именительном падеже называется анион, а затем в родительном падежекатион. В названии комплексного иона сначала перечисляются лиганды, далее центральный ион. Число лигандов указывается греческими числительнымиди, три, тетра, пента, гекса и т.д. К латинскому названию лигандов добавляют окончание «о»: Cl-- хлоро; NO2- - нитро и тд.
Примеры:
[Cu(NH3)4]Cl2 - хлорид тетрамминмеди (II);
[Pt(NH3)3NO2Cl]SO4 - сульфат хлоронитротриамминплатины (IV); [PtCl4(NH3)2] - диаминтетрахлороплатина.
За некоторыми координационными соединениями сохранились исторически сложившиеся названия: K3[Fe(CN)6] – красная кровяная соль; K4[Fe(CN)6] – желтая кровяная соль и др.
Лигандами могут быть нейтральные молекулы или анионы кислот:
1)нейтральные H2O, NH3, CO, этилендиамин- Н2N-CH2-CH2-NH2 и др.
2)анионы: Cl-, OH-, CN-, F-, оксалат-ион- С2O42- и др.
Заряд внутренней сферы складывается из заряда катиона металла и суммы зарядов лигандов: [Ag(CN)2]-, [Pt(Cl)6]2-, [Fe(CN)6]4-.
Лиганды могут быть монодентатными и полидентатными. Монодентатные лиганды связаны с центральным атомом металла только одной связью, а полидентатныенесколькими, например:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

H |
H |
|
|
|
|
O 2- |
N2 |
N2 |
2+ |
O |
O |
O |
|
Cu |
|
|
|
|
Cu |
|
N |
N |
|
O |
O |
O |
O |
H2 |
H2 |
|
|
|
|
|
a |
|
|
|
|
б |
|
Простой линией обозначается внутрикомплексная химическая связь, образованная между катионом металла и отрицательно заряженным анионным лигандом (б), а стрелочкой – донорно-акцепторная связь между катионом металла и электронейтральным лигандом (а).
Важнейшим параметром комплексообразователя и всего координационного соединения является координационное число (к.ч.), которое наряду со степенью окисления в комплексных соединениях служит еще одной его характеристикой.
Координационным числом называют число атомов лигандов, непосредственно присоединенных к центральному атому. Лиганды характеризуются дентатностью (от английского «dent» – зуб). К лигандам, способным занимать только одно координационное место (монодентатным), относятся H2O, NH3, C5H5N – пиридин, другие полярные молекулы (PPh3), однозарядные анионы CN–, Hal–, OH– и т. п. Некоторые лиганды могут занимать более одного координационного места, если содержат два и более донорных (со свободной электронной парой) атома. Такие лиганды называют полидентатными: NH2–
CH2–CH2–NH2 – этилендиамин, NH2–CH2–COO– – глицинат.
Координационные соединения с бидентатными лигандами, образующие металлоциклы, как указано выше, часто называют хелатными.
Так, в комплексах металлов с диметилглиоксимом реализуются хелатные металлоциклы, например, в комплексе никеля(II):
|
|
|
H |
|
||
H3C |
O |
O |
CH3 |
|||
|
|
|
|
|||
N |
N |
|||||
|
N |
Ni |
|
|||
H3C |
N |
CH |
||||
|
|
|
|
|||
O |
O |
3 |
||||
|
||||||
|
|
|||||
|
|
|
H |
|
||
Здесь точками обозначены внутримолекулярные водородные связи. Этот плоский (квадратный) комплекс - бис(диметилглиоксимато)никель(II), представляет собой малорастворимое в воде соединение красного цвета; применяется для определения никеля(II).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Прочность таких соединений как правило выше, чем с монодентатными лигандами с аналогичными донорными группами. Этот эффект усиления прочности связывания бидентатными лигандами называют хелатным эффектом (от англ. Сhelate – клешня) .
Хелатный эффектэто частный случай общей закономерности усиления прочности связывания ионов металла при увеличении степени его обхвата лигандом.
Например для лигандов:
NH3 |
H N |
NH2 |
(en) |
|
2 |
|
|
|
|
|
2-3-2 |
|
H |
|
NH HN |
H2N |
N |
N |
NH2 |
|
|
H |
NH HN |
|
|
|
|
|
(trien) |
|
|
|
хелатный эффект |
макроциклический эффект |
|
наблюдается увеличение прочности связывания с катионом металла при увеличении дентатности лиганда для реакции:
[Ni(H2O)6]2+ + n L |
[Ni(L)n(H2O)2]2+ + 4H2O |
где L - NH3 , (en), (trien) (хелатный эффект) или соединение (2,3,2) - макроциклический эффект. Логарифмы констант устойчивости (lgβn) приведены в таблице:
L= |
NH3 |
en |
trien |
2-3-2 |
n= |
4 |
2 |
1 |
1 |
lgβn= |
8,12 |
13,5 |
13,8 |
14,6 |
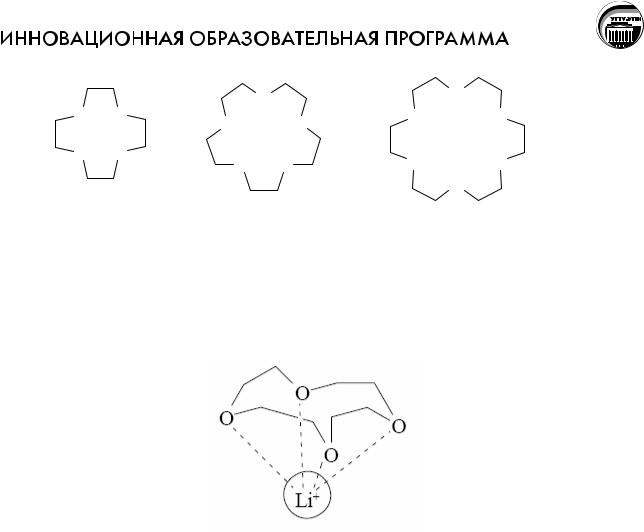
В случае макроциклического эффекта для более прочного связывания катиона металла необходимо, чтобы диаметр полости макроцикла соответствовал диаметру центрального атома. Это свойство многократно усилено в краунэфирах из-за большого числа гетероатомов в цикле, к тому же неподеленные электронные пары ориентированы внутрь цикла.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
O |
O |
|
O |
|
O |
O |
O |
O |
O |
||
|
|
|
|
||
O |
O |
O |
O |
O |
O |
|
|
||||
|
|
|
|
|
O |
12-краун-4 |
15-краун-5 |
18-краун-6 |
|||
В результате ионы щелочных и щелочноземельных металлов входят внутрь цикла, образуя прочные комплексы. Меняя величину цикла и, соответственно, размер внутренней полости, можно точно настроить краун-эфир на удерживание катиона определенного размера, например, 12-краун-4 наиболее прочно захватывает катион лития:
15-краун-5 соответствует по размеру катиону натрия, а 18-краун-6 «подходит по размеру» катиону калия.У краун-эфиров склонность к «захвату» катионов выражена настолько сильно, что даже если катион не соответствует по размеру внутренней полости цикла, то все равно оказываются возможными варианты, при которых катион все же удерживается. Например, если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краун-эфира, образуя подобие бутерброда.
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Например, широко применяемый окислитель перманганат калия KMnO4 практически нерастворим в органических растворителях, но в присутствии 18-краун-6 он легко растворяется в бензоле, приобретая при этом высокую окисляющую способность. Причина в том, что в водном растворе анионы MnO4–, осуществляющие окисление, окружены водной сольватной оболочкой, а в бензольном растворе они как бы обнажены и потому высокоактивны.
Комплексонаты.
Комплексонаты – это координационные соединения металлов с анионами комплексонов – полиосновных аминокарбоновых или аминофосфорных ки-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
слот. Анионы комплексонов обычно выступают в роли полидентатных лигандов. Примеры комплексонов.
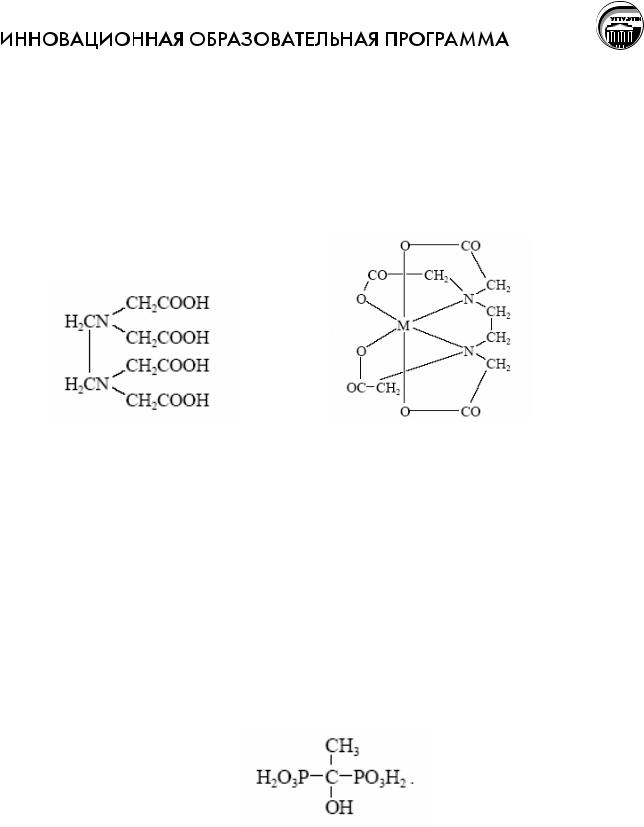
Этилендиаминтетрауксусная кислота (ЭДТА). Как видно, молекула ЭДТА содержит 4 кислотных и 2 основных центра. Удачное сочетание и взаимное расположение этих центров сделало ЭДТА одним из наиболее эффективных действующих и универсальных комплексонов, нашедших весьма широкое и разнообразное применение.
В кислом растворе ЭДТА (H4edta) протонируется, образуя катион – кислоты Н5edta+ и H6edta2+, если edta4– - анион четырехосновной кислоты. Формула комплексона показывает, что анион edta4– является потенциально декадентатным: координация может осуществляться через два атома азота и восемь атомов кислорода, считая четыре "карбоксильных" и четыре "карбонильных". Однако пространственная структура соединения такова, что дентатность не может быть выше шести – в координации могут участвовать два атома азота и четыре "карбоксильных" атома кислорода. При этом образуются пять пятичленных металлоциклов, что приводит к исключительно высокой устойчивости комплексонатов.
Среди комплексонов с фосфоновыми группами наиболее полно охарактеризована нитрилтриметиленфосфоновая кислота N(CH2PO3Н2)3 (НТФ) и оксиэтилендифосфоновая кислота (ОЭДФ), содержащая две фосфоновые группы:
ОЭДФ и НТФ широко применяются в водоподготовке для предотвращения карбонатных, сульфатных отложений (накипи) на теплопередающих поверхностях водогрейных котлов и оборотных циклах водоснабжения систем охлаждения. Ингибиторы на основе комплексонов с фосфоновыми группами, способны в субстехиометрическом (т.е. в 100-1000 раз меньше стехиометри-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
ческого) соотношении препятствовать росту кристаллов труднорастворимых солей щелочноземельных металлов.
Сандвичевые металлокомплексные соединения. Ферроцен.
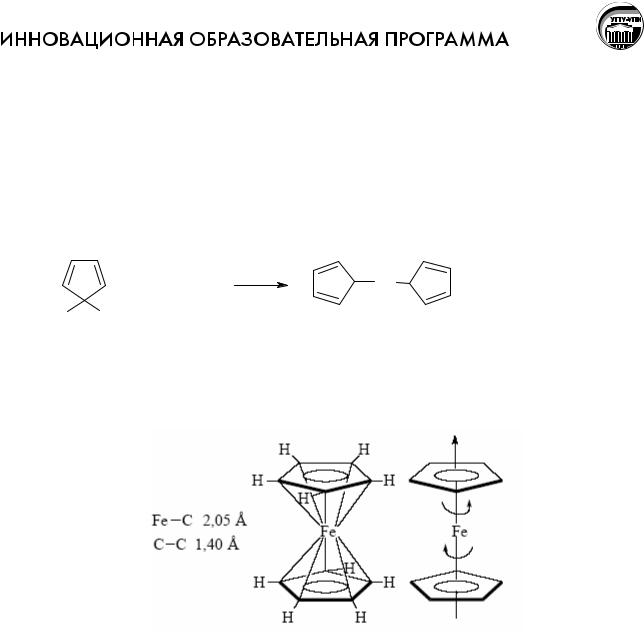
В 1951 г. Английскими химиками Посоном и Кили был открыт ферроцен – Fe(C5H5)2: желтое кристаллическое вещество. Оно легко получается при нагревании циклопентадиена с восстановленным железом в атмосфере азота при 300оC:
2 |
+ Fe |
N2 |
Fe |
+ H 2 |
|
300 0C |
|||||
H |
H |
|
|
||
|
|
|
Это соединение стало родоначальником широко изученного теперь класса так называемых сэндвичевых соединений. Потребовалось около года, чтобы понять, как построено это соединение. Выяснилось, что атом железа "запечатан" между двумя высокосимметричными пятичленными кольцами:
И, кроме того, оказалось, что кольца свободно вращаются в молекуле относительно друг друга вокруг оси, соединяющей центры колец и пронизывающей атом железа насквозь. Соединение было названо ферроценом, а подобный структурный тип – сандвичевым.
О стабильности ферроцена следует сказать несколько конкретных слов. В вакууме, то есть при отсутствии других, в том числе и агрессивных, реагентов, соединение выдерживает, не разрушаясь, нагревание до температуры выше 5000C. И даже в присутствии воздуха, в котором содержится агрессивный для ферроцена кислород, ферроцен оказывается стабильным при нагревании до 400оC. Для него можно провести классические для ароматических соединений реакции без разрушения сэндвичевой структуры.
Металлокластеры.
Термин "кластер" происходит от английского "cluster" – рой, гроздь, груда, скопление. В химии это понятие стало использоваться с 1964 года, когда
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
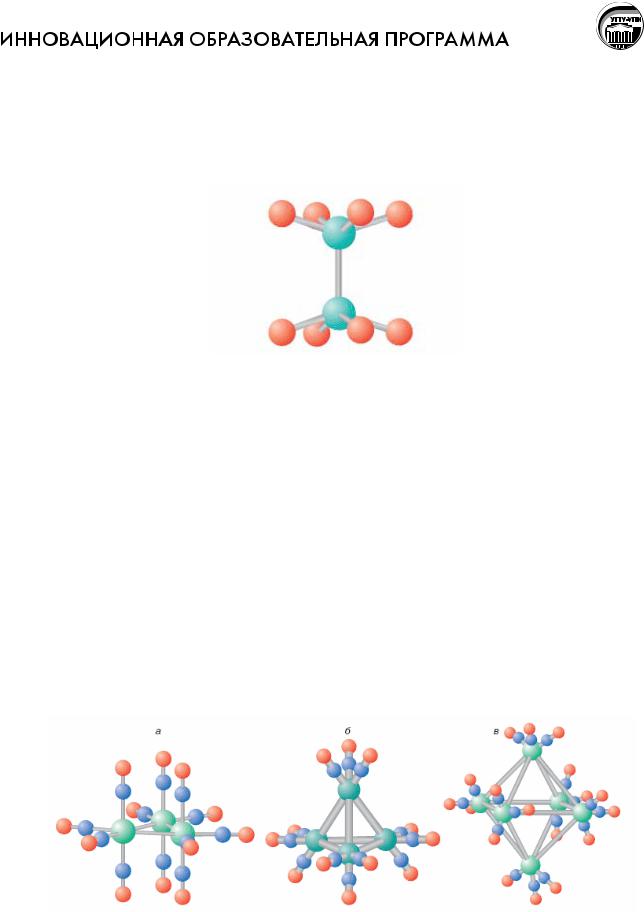
профессор Ф.А. Коттон предложил называть химические соединения, в которых атомы металла образуют между собой химическую связь, кластерами. Примером таких соединений может быть ион [Re2Cl8]2-. При исследовании структуры этого аниона было установлено, что атомы рения непосредственно связаны друг с другом:
Структура аниона [Re2Cl8]2-
Характерные структурные типы кластеров относятся к одному из самых необычных и красивых разделов современной химической науки. Структурная химия кластеров соединяет новизну строительных принципов и совершенство геометрических форм молекул и ионов полиэдры из атомов металла, скрепленные связями металл-металл. В роли лигандов могут выступать самые разнообразные одно-, двух- и многоатомные ионы и нейтральные молекулы, например, СO.
CO (окись углерода), имеет свободные π* орбиты, является важнейшим из лигандов π – акцепторов. Любой из переходных металлов образует карбонильные производные по меньшей мере одного типа. Первые комплексные соединеия карбонилов металлов – Ni(CO)4 и Fe(CO)5 – были открыты Мон-
дом в 1890 и 1891 гг.
Приведем примеры малых кластеров, содержащих от трех до шести атомов металла.
В карбонильном кластере Os3(CO)12 (а) атомы осмия образуют трехчленный металлоцикл в виде равностороннего треугольника. Примером карбонильно-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
