- •Методы электронной спектроскопии
- •• Спектроскопия — разделы физики и
- •• По объектам исследования можно
- •Электромагнитный спектр
- ••Прямая задача спектроскопии —
- •1.Атомный и молекулярный спектраль ные анализы позволяют определять элементный и молекулярный состав вещества,
- ••Спектральные методы являются наиболее
- ••Молекула, переведенная в возбужденное электронное состояние, может потерять избыток энергии любым из
- •Абсорбционная спектроскопия в
- •Лекция
- ••Способность поглощать электромагнитное излучение является общим свойством всех молекул. Поглощение избирательно, т.е.
- •Закон Бера-Бугера-Ламберта
- ••Условия применения закона Бугера- Ламберта-
- ••Закон аддитивности
- •спектров
- ••Спектры поглощения в ультрафиолетовой (УФ-
- •Схема энергетических состояний двухатомной молекулы
- ••Электронные спектры (ближняя
- •Вид полосы поглощения
- •поглощения
- ••Электронные переходы в молекуле классифицируют
- •Относительные энергии
- •Типы молекулярных
- •Классификация полос
- •ВЛИЯНИЕ СТРОЕНИЯ И СРЕДЫ НА УФ-СПЕКТРЫ ПОГЛОЩЕНИЯ
- •Взаимосвязь электронных спектров и
- •Основные хромофорные группы
- ••Атомную группировку, которая придает соединению способность и избирательному поглощению в ближнем ультрафиолете или
- ••Атомную группировку, не содержащую кратных связей, которая не имеет максимума поглощения в ближнем
- ••При выявлении взаимосвязи спектра со
- •Взаимосвязь электронных спектров и структуры органических молекул
- ••Смещение в сторону меньших длин волн (больших частот и энергий)
- •Типы смещений полосы поглощения в УФ-спектре
- ••Наиболее чувствительны к различным факторам
- •переход) карбонильной группы
- ••При переходе из газовой фазы в
- •Механизм возникновения гипсо- и батохромных
- ••В общем случае влияние растворителя
- ••В эксперименте для π → π* - переходов в
- •Гипсохромный и батохромный сдвиги для n → π*
- •• Важным экспериментальным критерием отнесения полосы к *- или n *- переходам является
- ••ЭЛЕКТРОННЫЕ СПЕКТРЫ ПОГЛОЩЕНИЯ ОСНОВНЫХ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
- ••Насыщенные углеводороды с гетероатомами. Таковыми являются алканы, содержащие в своем составе атомы О,
- •Электронные спектры поглощения основных классов органических
- •Электронные спектры поглощения
- •Электронные спектры поглощения основных классов органических
- •Электронные спектры поглощения
- ••В УФ-спектре бензола наблюдается три полосы различной интенсивности
- •Вид спектра монозамещенных бензола
- ••Соединения с сопряженными двойными связями. Сопряжение проявляется в УФ-спектрах батохромным сдвигом для полосы
- ••Полоса π → π* перехода для изолированной двойной связи (этилене, например) имеет максимум
- ••Имеются эмпирические уравнения и
- ••Количественный спектральный анализ
- •Нефелометрический и турбидиметрический анализ
- •Внефелометрическом и турбидиметрическом
- ••Метод с измерением интенсивности
- •Применение методов, основанных на измерении
•Способность поглощать электромагнитное излучение является общим свойством всех молекул. Поглощение избирательно, т.е.
излучение определенной длины волны данной молекулой интенсивно поглощается, тогда как излучение при других длин волн поглощается слабо или совсем не поглощается. Если энергия излученного кванта света с энергией
• |
Е=hν |
•совпадает с собственной внутренней энергией поглощающей частицы (молекулы, иона и т.д.) по поглощение произойдет и частица приобретет другую, более высокую энергию
• |
М + hν = М(+) |
• |

Закон Бера-Бугера-Ламберта
Экспериментально открыт П. Бугером (1729), теоретически выведен И.Г. Ламбертом (1760), для растворов
(1852) |
|
|
|
|
|
lg (I0/I) = |
|
|
|
||
alc |
|
|
|
|
|
А = |
|
|
П. Бугер |
И.Г. Ламбе |
|
|
|
||||
|
lc |
|
|
|
|
а - коэффициент поглощения, констан |
|||||
от , но не зависящая от концентраци |
|||||
l - длина оптического пути; |
|
||||
При с [моль/л], l[см] , a =c - концентрация
- молярный коэффициент
Величина молярного коэффициента поглощения пропорциональна вероятности определенного перехода
А = lg |
А – погашение |
I=I0 10 |
-εlc |
(I / I) |
плотность ) |
|
|
|
(оптическая |
|
|
0 |
Т - |
|
|
Т = I/I0 |
пропускание |
|
|
•Условия применения закона Бугера- Ламберта-
Бера
1.Закон справедлив для монохроматического света не слишком большой интенсивности
Аλ=ελ lc
2.Пучек света должен быть параллельным
3.Закон справедлив для не слишком концентрированных растворов ε= f(n)
4.Температура должна быть постоянной в пределах 1-2 градусов
5. Закон соблюдается для систем, где |
|
поглощающими центрами являются частицы |
|
одного сорта |
|
Cr2O2-7 + H2O = 2HCrO-4 |
= 2CrO42- + 2H+ |
Различие в εCr2O2-7 |
εCrO2-4 |
•Закон аддитивности
•Поглощение света каким либо веществом не
зависит от присутствия в растворе других веществ, как поглощающих свет, так и не
поглощающих. A=A1 + A2 +…An
•оптическая плотность смеси веществ равна сумме оптических плотностей каждого из них (при условии подчинения закону Бугера
– Ламберта – Бера). Для одной и той же длины волны и толщины слоя для смеси веществ
•A = ε1 ∙l1 ∙c1 + ε2 ∙l2 ∙c2 + …εn ∙ln
∙cn
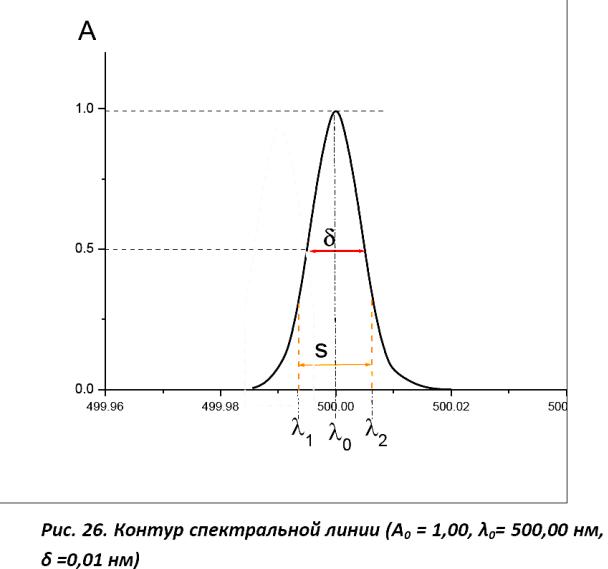
спектров
Электронные спектры поглощения записываются в виде зависимости поглощения от длины волны (Ǻ , нм) или
частотыВеличина(смпоглощения-1) может быть выражена:
процентом поглощения [(I0 – I)/ I0 · 100% ], процентом пропускания [(I/I0) ·
100%], оптической плотностью D ,
коэффициентом молярного поглощения
Область поглощения называется
полосой; совокупность полос (ε) или его логарифмом (lgε)
поглощения-спектр ее поглощения. Спектр – это последовательность квантов
энергии электромагнитных колебаний, поглощенных, выделившихся или рассеянных при многочисленных переходах
атомов или молекул из одних энергетических состояний в
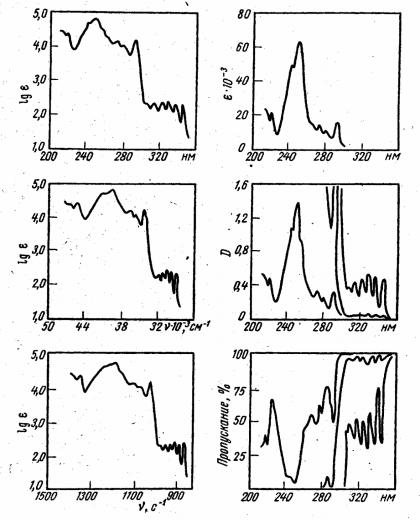
•Спектры поглощения в ультрафиолетовой (УФ-
спектры) и видимой областях обусловлены энергетическими переходами между электронными состояниями молекулы, в связи с чем их также называют электронными спектрами.
•Каждое электронное состояние молекулы характеризуется некоторым интервалом значений энергии, связанным с колебательным движением молекулы. Поэтому любому электронному переходу в спектре соответствует широкая полоса поглощения. При съемке спектра в газовой фазе, как правило, удается выявить колебательную структуру электронного перехода (в таком случае полоса поглощения выглядит как система близко расположенных узких полос)
• |
Е = Еэл + Екол + Евр |
• |
Еэл:Екол:Евр= 1000:100:1 |
• |
Евр = 0,125 -1,25 |
|
кДж/моль |
• |
Екол + Евр = 1,25-50 |
|
кДж/моль |
• |
Еэл + Екол + Евр = 60-600 |
|
кДж/моль |
• |
|
• |
∆Е = Е1 – Е0 |
• |
∆Е =h = hc/λ |
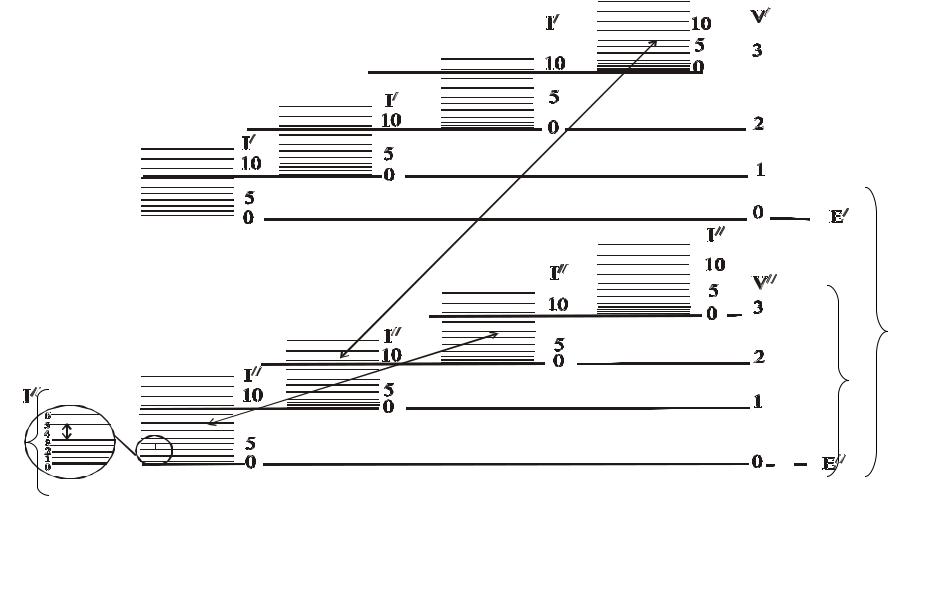
Схема энергетических состояний двухатомной молекулы
Ее
Еv
Еr
Схема энергетических состояний двухатомной молекулы: Ее – различные электронные состояния; Еv –
различные колебательные состояния; Еr – различные вращательные состояния; νе.v.r – переходы, соответствующие электронно-колебательно-вращательному спектру; νv.r – переходы, соответствующие колебательно-вращательному спектру; νr – переходы, соответствующие вращательному спектру
•Электронные спектры (ближняя
ультрафиолетовая и видимая области) характеризуют только сопряженные системы кратных связей, ароматические структуры, функциональные группы с гетероатомами и - связями (CO, NO, NO2 и др.). В пределах этих фрагментов, являющихся "хромофорами", метод дает ценную информацию, включая некоторые данные о конфигурации и степени разветвленности скелета. Однако никаких данных о структуре удаленных от хромофорных частей молекулы, предельных соединений и соединений с изолированными двойными или тройными углерод - углеродными связями электронная спектроскопия не дает.