
- •Методы электронной спектроскопии
- •• Спектроскопия — разделы физики и
- •• По объектам исследования можно
- •Электромагнитный спектр
- ••Прямая задача спектроскопии —
- •1.Атомный и молекулярный спектраль ные анализы позволяют определять элементный и молекулярный состав вещества,
- ••Спектральные методы являются наиболее
- ••Молекула, переведенная в возбужденное электронное состояние, может потерять избыток энергии любым из
- •Абсорбционная спектроскопия в
- •Лекция
- ••Способность поглощать электромагнитное излучение является общим свойством всех молекул. Поглощение избирательно, т.е.
- •Закон Бера-Бугера-Ламберта
- ••Условия применения закона Бугера- Ламберта-
- ••Закон аддитивности
- •спектров
- ••Спектры поглощения в ультрафиолетовой (УФ-
- •Схема энергетических состояний двухатомной молекулы
- ••Электронные спектры (ближняя
- •Вид полосы поглощения
- •поглощения
- ••Электронные переходы в молекуле классифицируют
- •Относительные энергии
- •Типы молекулярных
- •Классификация полос
- •ВЛИЯНИЕ СТРОЕНИЯ И СРЕДЫ НА УФ-СПЕКТРЫ ПОГЛОЩЕНИЯ
- •Взаимосвязь электронных спектров и
- •Основные хромофорные группы
- ••Атомную группировку, которая придает соединению способность и избирательному поглощению в ближнем ультрафиолете или
- ••Атомную группировку, не содержащую кратных связей, которая не имеет максимума поглощения в ближнем
- ••При выявлении взаимосвязи спектра со
- •Взаимосвязь электронных спектров и структуры органических молекул
- ••Смещение в сторону меньших длин волн (больших частот и энергий)
- •Типы смещений полосы поглощения в УФ-спектре
- ••Наиболее чувствительны к различным факторам
- •переход) карбонильной группы
- ••При переходе из газовой фазы в
- •Механизм возникновения гипсо- и батохромных
- ••В общем случае влияние растворителя
- ••В эксперименте для π → π* - переходов в
- •Гипсохромный и батохромный сдвиги для n → π*
- •• Важным экспериментальным критерием отнесения полосы к *- или n *- переходам является
- ••ЭЛЕКТРОННЫЕ СПЕКТРЫ ПОГЛОЩЕНИЯ ОСНОВНЫХ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
- ••Насыщенные углеводороды с гетероатомами. Таковыми являются алканы, содержащие в своем составе атомы О,
- •Электронные спектры поглощения основных классов органических
- •Электронные спектры поглощения
- •Электронные спектры поглощения основных классов органических
- •Электронные спектры поглощения
- ••В УФ-спектре бензола наблюдается три полосы различной интенсивности
- •Вид спектра монозамещенных бензола
- ••Соединения с сопряженными двойными связями. Сопряжение проявляется в УФ-спектрах батохромным сдвигом для полосы
- ••Полоса π → π* перехода для изолированной двойной связи (этилене, например) имеет максимум
- ••Имеются эмпирические уравнения и
- ••Количественный спектральный анализ
- •Нефелометрический и турбидиметрический анализ
- •Внефелометрическом и турбидиметрическом
- ••Метод с измерением интенсивности
- •Применение методов, основанных на измерении
•При выявлении взаимосвязи спектра со
структурой молекулы бывает целесообразным наблюдение за изменениями в положении и интенсивности полос поглощения при переходе от некоторого родоначального хромофора, ответственного за поглощение, к модифицированному. Для этого в систему вводят дополнительную хромофорную или ауксохромную группу. Для характеристики спектральных изменений, вызванных модификацией структуры, используется специальная терминология:
Взаимосвязь электронных спектров и структуры органических молекул
Для характеристики спектральных изменений, вызванных модификацией структуры, введены специальные термины:
гипсохромный сдвиг (синий сдвиг) – для смещения полос поглощения в коротковолновую область
спектра;
батохромный сдвиг (красный сдвиг) – для смещения полос
поглощения в область
длинных волн;
гиперхромный эффект – увеличение интенсивности поглощения;
гипохромный эффект – уменьшение интенсивности
•Смещение в сторону меньших длин волн (больших частот и энергий)
называется гипсохромных сдвигом или синим смещением. Смещение в
сторону больших длин волн (меньших частот и энергий) называется батохромным сдвигом или красным смещением.
•Увеличение интенсивности полосы
– называется гиперхромным эффектом, уменьшение – гипохромным эффектом
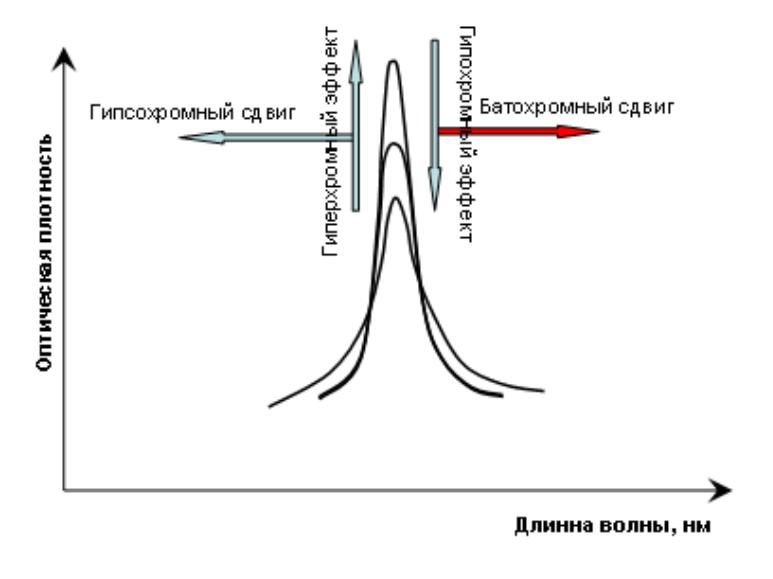
Типы смещений полосы поглощения в УФ-спектре
•Наиболее чувствительны к различным факторам
строения и среды являются n → π* и π → π* переходы. Здесь отчетливо проявляются эффекты сопряжения двойных связей в молекулах, полярность заместителей и среды. Рассмотрим последовательно эти три случая.
•Сопряжение проявляется батохромным смещением полос поглощения для n → π* и π → π* переходов.
•Увеличение полярности заместителя в α- положении такого хромофора как карбонильная группа сопровождается гипсохромным сдвигом n → π* полосы (см рис.).
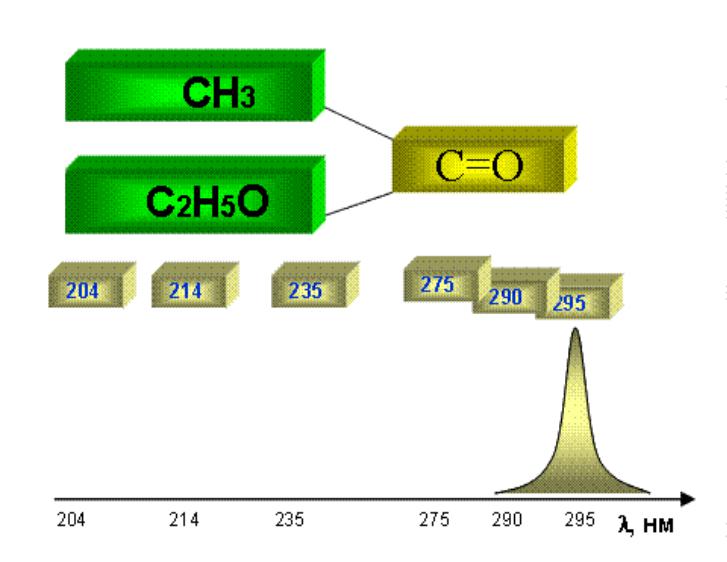
переход) карбонильной группы
в следующем ряду соединений (H-, H-); (H-, CH3-);
(CH3-, CH3-); (CH3-, Cl-);
(CH3-, NH2-); (CH3-, C2H5O-).
•При переходе из газовой фазы в
жидкую, или изменении полярности растворителя, энергия основного и возбужденного электронных состояний молекулы изменяется. Это также приводит к гипсо- или батохромным сдвигам полос поглощения для n → π* и π → π* переходов, т.е. оказывают влияние на разность энергий между электронными состояниями(см. рис.). В общем случае влияние растворителя должно проявляться в понижении средней энергии как основного так и возбужденного состояний. И чем больше полярность растворителя, тем сильнее должны быть такие взаимодействия.
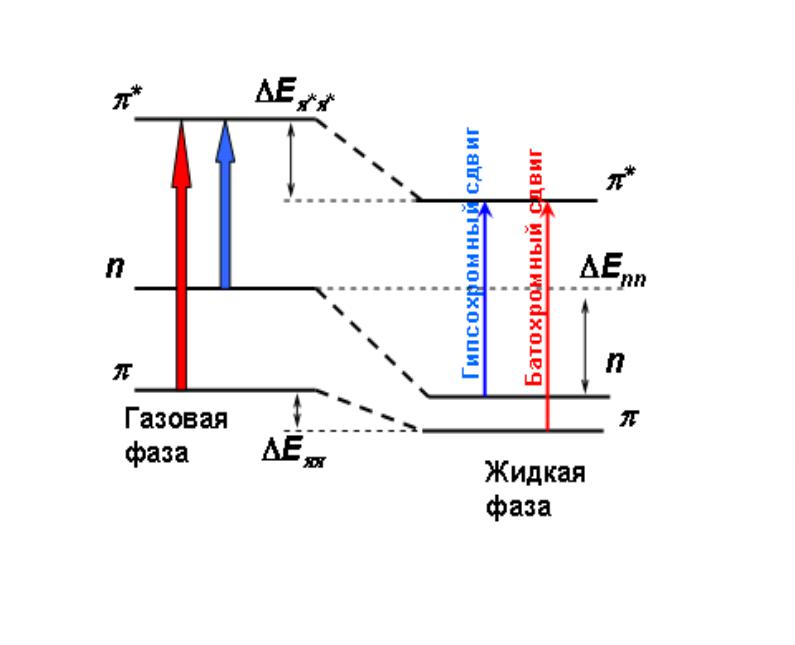
Механизм возникновения гипсо- и батохромных
сдвигов в электронных спектрах поглощения под влиянием растворителя.
•В общем случае влияние растворителя
должно проявляться в понижении средней энергии как основного так и возбужденного состояний. И чем
больше полярность растворителя, тем сильнее должны быть такие взаимодействия. Однако для того, чтобы произошел сдвиг частоты поглощения, необходимо изменить относительную энергию двух состояний.
•В эксперименте для π → π* - переходов в
полярных растворителях спектр поглощения сдвигается (батохромно) в сторону больших длин волн, а для n → π* - переходов гипсохромно.
•В качестве примера на рис. приведены данные по влиянию растворителя на n → π* и π → π* переходы в карбонильной группе.
•При n → π* - переходах взаимодействие молекул вещества с растворителем понижает энергию n-орбитали в основном электронном состоянии из-за сольватации или, в частности, при образовании водородной связи.
