
Ovru-all
.pdf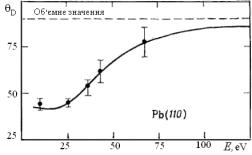
ехр(-|Δk| 2 <u 2 >/4), де k— величина імпульсу, переданого розсіяному кванту. Отже, порівняння даних рентгенівської дифракції і ДПЕ дозволяє визначити відношення амплітуд теплових коливань атома на поверхні і в об'ємі твердого тіла. Інформацію зазвичай представляють як «поверхневу» температуру Дебая (рис. 4.15). Як правило, експерименти показують, що теплові відхилення атомів перпендикулярно поверхні на 50-100 % більше, ніж в об'ємі кристала при тій же температурі. Це пов’язано з тим, що на поверхневий атом, який відхилився від положенні рівноваги, діє приблизно удвічі менша сила, що повертає його, ніж на атом в об'ємі тіла.
Рис. 4.15. Залежність температури Дебая поверхневих шарів від енергії
електронів падаючого електронного променя
(фактично, глибини проникнення )[16].
Спрощене застосування критерію Ліндемана дозволяє зробити висновок, що поверхнева гратка «плавиться» при істотно нижчій температурі, ніж об'ємна фаза. Якщо це дійсно так, то мікроскопічна ланцюгова реакція може відбуватися таким чином. З боку «підплавленого» поверхневого шару на другий шар атомів діє перпендикулярна повертаюча сила, що має проміжну величину між значеннями, характерними для впорядкованого поверхневого шару і вакууму. Відповідно другий шар плавиться при декілька вищій температурі, ніж поверхневий шар, але все ще меншої об'ємної температури плавлення. Аналогічне міркування застосовне до третього шару і так далі. Кожен шар плавиться стрибком, як тільки для нього локально реалізуються умови Ліндемана. Фронт плавлення розповсюджується в глиб кристала, причому температура плавлення з кожним шаром зростає, поки процес не завершиться при Тпл .
131

Можна наочно представити цей процес, застосовуючи моделювання за методом молекулярної динаміки (рис. 4.16 [17]). У вказаному методі проводиться чисельне інтегрування класичних рівнянь руху для системи з N взаємодіючих за певним законом частинок. Система підтримується в тепловій рівновазі при температурі Т. При більш низькій температурі всі атоми в площинах, паралельних вільній поверхні льоду (1010), виконували гармонічні коливання біля своїх положень рівноваги (рис. 4.16,а), . Проте виразно видно (рис. 4.16,b), , що при деякій вищій температурі, але все ще нижчій за об'ємну точку плавлення, поверхневий шар стає майже розупорядкованим. При підвищенні температури можна спостерігається рух фронту плавлення в глиб кристала.
Рис. 4.16. Траєкторії молекул води за результатами моделювання кристалів льоду, а – Т = 250 К; b – Т=265 К.
Чи відбувається плавлення двовимірного кристала аналогічно плавленню тривимірного? На це питання слід відповісти негативно, оскільки двовимірне тверде тіло принципово відрізняється від тривимірного. Припустимо, що ми хочемо скористатися критерієм Ліндемана. Обчислення, приведені вище, необхідно злегка модифікувати, оскільки інтеграція по хвильових векторах тепер обмежена двома
вимірюваннями, тобто необхідно замінити диференціал d 3 q на d 2 q. Проте ця невелика зміна приводить до того, що інтеграл стає таким, що логарифмічно розходиться при підстановці нижньої межі. Як вважають, це свідчить про те, що довгохвильові фонони руйнують порядок розташування частинок в двовимірному «твердому тілі». Звичайно, в будь-якому зразку кінцевих розмірів середній квадрат
атомних зсувів <u 2 > насправді не має нескінченно великої величини. Проте двовимірне тверде тіло можна швидше характеризувати дальнім орієнтаційним порядком, а не дальнім порядком трансляції [18]. Це означає, що на великих відстанях зберігається орієнтація
132
кристалічних осей, тоді як строга періодичність вузлів гратки уздовж осей відсутня. Взагалі механічна стійкість двовимірних кристалів викликала сумніви. Але ж нещодавно знайшли, що існують стійкі двовимірні плівки вуглецю (товщиною в атомний розмір), і це було пояснено особливостями ковалентних зв’язків. Двовимірні плівки вуглецю є у лініях проведених простим олівцем.
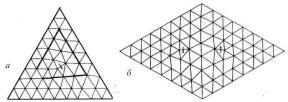
Рис. |
4.17. Дефекти в двовимірних трикутних гратках, |
а — |
ізольована дислокація, б — зв'язана пара дислокацій [19]. |
Плавлення в «двох вимірюваннях» може відбуватися за допомогою теплової генерації топологічних дефектів в гратках. На рис. 4.17, а зображена елементарна дислокація у трикутних гратках. Вектор Бюргерса уявляє собою направлений відрізок, необхідний для того, щоб замкнути лінію навколо дислокації. Енергія такої дислокації обчислюється на основі теорії пружності [20]:
Ud= |
μ(λ + μ)a02 |
A |
|
(λ + 2μ)4π ln |
|
, |
|
A |
|||
|
|
0 |
|
де μ и λ– константи Ламе матеріалу, а0 – постійна гратки і A 0 ~а 02 ,
А – площа поверхні. Далекодіюче поле напруги дислокації обумовлює логарифмічну залежність енергії від площі поверхні (A) твердого тіла. Дислокації збільшують внутрішню енергію двовимірного кристала, але одночасно й збільшують ентропію, оскільки існує багато місць їх можливого виникнення. Отже, енергетичний бар’єр для їх виникнення (зміна вільної енергії) може бути невеликим, і кристал може «плавитись» унаслідок спонтанної генерації дислокацій при температурі, визначувану умовою Ud–TплSd=0, яка вища за точку плавлення. При температурах нижче Tпл дислокації виявляються зв'язаними в пари з протилежно направленими векторами Бюргерса (рис. 4.15,6). Плавлення відбувається шляхом теплового розриву зв'язку таких пар дислокацій.
133
Розділ 5 АДСОРБЦІЯ. АДСОРБЦІЙНЕ РІВНЯННЯ ГІББСА
5.1.Адсорбція на твердих поверхнях
5.1.1.Фізична та хімічна адсорбція. Різні типи ізотерм адсорбції
Адсорбція на твердих тілах має велике практичне значення, оскільки всі адсорбенти і каталізатори, вживані в промисловості і хімічному захисті, є твердими тілами. Як зазначалося вище, експериментальні дослідження адсорбції були розпочаті на початку 20 сторіччя роботами Ленгмюра і стосувалися вони в основному питань сорбції газів на поверхнях твердих тіл. Експериментально вивчалися ізотерми й ізобари адсорбції шляхом вимірювання зміни об’єму газу до й після його проходження над поверхнею або шляхом зважування тіла під час досліду. Ленгмюр встановив, що при малих тисках, об’єм адсорбованого газу пропорційний тискові, а при збільшенні тиску відбувається насичення, тобто газ перестає далі адсорбуватися. Записавши умови кінетичної рівноваги для кількостей молекул, що випаровуються й осідають на поверхню, Ленгмюр запропонував рівняння ізотерми адсорбції (дивись нижче). Оцінки максимальної кількості речовини, що осіла на поверхні, свідчили, що її менше ніж необхідно для утворення щільного молекулярного шару. Тому Ленгмюр допустив, що адсорбція відбувається на активних центрах і може утворитися тільки один молекулярний шар на поверхні.
Подальші дослідження багатьма вченими показали, що на адсорбцію сильно впливає хімічна природа газу та адсорбенту і стан поверхні твердого тіла. У тридцяті роки багатьма дослідниками було встановлено існування двох типів адсорбції – низькотемпературної та високотемпературної (хемосорбції). Для першої характерно швидке встановлення рівноваги, низькі теплоти активації (робота десорбції менше половини теплоти випаровування для речовин, які існують в рідкому стан). Ці типи адсорбції дуже добре розрізняються на ізобарах адсорбції, тобто на графіках залежностей долі поверхні вкритої молекулами осадженого газу від температури за постійного тиску газу (дивись приклад на рис. 5.1).
Низькотемпературна адсорбція – це фізична адсорбція. При підвищенні температури адсорбція зменшується, тому що молекулам стає легше подолати енергетичний бар’єр, пов’язаний з їх взаємоді-
134
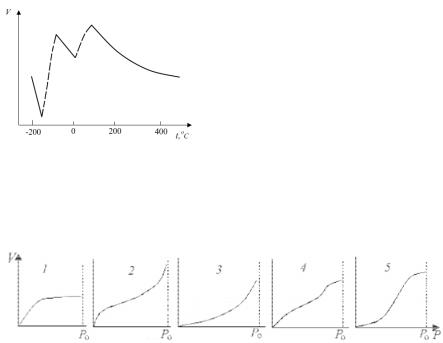
єю з поверхнею. При температурі –150º С (см. рис. 5.1).поверхню практично покидають залишки молекул газу. Але із збільшенням температури речовина знову адсорбується. І це пов’язано з хімічною реакцією між молекулами водню й поверхнею. Реакція не відбувалася при низьких температурах, тому що для її перебігу необхідно по-
долання досить значного енергетичного бар’єру. Внаслідок реакції встановлюється сильна взаємодія молекул з поверхнею, й десорбція стає можливою тільки при вельми високих температурах.
|
Теоретична ізотерма Ленгмюра |
|
не описує різноманіття процесів ад- |
Рис.5.1. Ізобара адсорбції |
сорбції, встановленого в експери- |
ментах. Залежності величини об’єму |
|
водню на активованому |
адсорбованого газу від тиску можуть |
залізному каталізаторі син- |
бути різними. Аналіз експеримента- |
тезу аміаку |
льного матеріалу призвів до виді- |
лення 5 основних типів характеру цих залежностей (рис. 5.2).
Рис. 5.2. Можливі типи ізотерм адсорбції,
Р0 – тиск насиченої пари над рідиною речовини, що адсорбується.
Зрозуміло , що були запропоновані теорії, в яких конкретний тип ізотерм пояснювався впливом певних факторів. З’явилися теорії, що враховують капілярну конденсацію, тобто конденсацію пари в порах адсорбенту. Цей фактор впливає на вигляд ізотерм при досить великих тисках. Теорія адсорбції Поляні виходить з того, що силове поле адсорбенту спадає повільно від поверхні й тому адсорбційний шар є полімолекулярним, і його густина убуває по нормалі від поверхні. Теорія Паркінсона і Юра враховувала зміну стану адсорбованих молекул від поверхневого газу до поверхневої рідини. У 60-х роках де Бур з уявлень про можливість стиснення моношару, в якому відбувається перехід від поверхневого газу до поверхневої рідини,
135

пояснив декілька типів ізотерм адсорбції. Ще в 1929 році була запропонована поляризаційна теорія де Бура й Цвиккера, в якій прийнято, що поляризація молекул сприяє осіданню молекул наступного шару. На основі розгляду експериментальних даних де Бур дійшов висновку, що теорія Ленгмюра застосовна тільки для деяких випадків оборотної хемосорбції з порівняно невеликою теплотою активації
(≈ 40 кДж/моль). Однак ця теорія важлива для розуміння всіх наступних теорій, й їхні результати в окремому випадку повинні зводитись до формули Ленгмюра.
5.1.2. Рівняння Ленгмюра
За теорією Лангмюра, кожен активний центр поверхні має лише молекулярну сферу дії, оскільки адсорбція визначається залишковими валентностями на поверхні. З цієї точки зору адсорбція є по суті хімічним процесом. В процесі адсорбції адсорбовані молекули залишаються якийсь час зв'язаними на активних центрах (цей час називається тривалістю життя в адсорбованому стані) і потім знов відриваються. Таким чином, стан рівноваги при адсорбції визначається рівністю швидкості конденсації і випаровування молекул. При цьому
частину θ адсорбуючої поверхні зайнято адсорбованими атомами або молекулами, а частина 1– θ поверхні залишається вільною. Величина θ рівна відношенню кількості адсорбованої речовини Г до максимальної кількості Гмах при повному заповненні поверхні θ = Г/Гмах. За постійної температури число зіткнень молекул з поверхнею пропорційно тиску Р або об'ємній концентрації молекул у газі або розчині. Кількість молекул, що падає із газу на одиничну площу стінки за одиницю часу, пропорційна концентрації молекул n та середньоари-
фметичній швидкості: I=nv/4. Оскільки n=P/kT, I= |
|
P |
|
, де m |
|
|
|
||
|
|
|
||
2πmkT |
—маса молекул, k —постійна Больцмана; T — температура. Згід-
но з думкою Ленгмюра, молекули адсорбуються, утворюючи лише один шар на поверхні тому, що вони не можуть адсорбуватися на вже зайняті частини поверхні, а швидкість адсорбції пропорційна концентрації (тиску) і вільній частині поверхні 1– θ.
I1 = K1P(1 − θ) ;
К1 – коефіцієнт пропорційності, К1= |
|
1 |
|
|
|
||
2πmkT |
|||
|
|
136
Навпаки, десорбція (або випаровування) молекул відбуватиметься лише із зайнятої частини поверхні, і тому швидкість цього проце-
су I2 буде пропорційна θ, |
І2= К 2 θ, |
Величина К2 залежить від |
концентрації поверхневих атомів ns, час- |
тоти їх коливань ν та фактора Больцмана від величині енергії адсорбції Uа : К2= νexp(–Uа/kT) /a2, де 1/a2 — кількість поверхневих атомів на одиницю площі (тут допущено, що всі атомні місця є активними центрами адсорбції).
Прирівнюючи в стані рівноваги швидкості обох процесів I 1 |
і І2, |
|||||||||
одержимо: |
|
K1P(1 − θ) = K2θ , |
|
|
|
|||||
або |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
θ = |
|
Г |
= |
K1P |
|
|
= |
bP |
, |
(5.1) |
Г |
мах |
(К P + К |
2 |
) |
(1 + bP) |
|||||
|
|
1 |
|
|
|
|
|
|||
де b = К1/К2.
Рис. 5.3. Ізотерма Ленгмюра
Це і є рівняння Ленгмюра, яке він отримав для поверхні з рівномірним розподілом однорідних активних центрів і за відсутності взаємодій між адсорбованими молекулами. Його можна переписати через концентрацію атомів:
Г/Гмах= |
bn |
, |
(5.2) |
(1 + bn) |
де Г – величина адсорбції; n – об’ємна концентрація молекул газу (P=nkT); b – відносна швидкість десорбції й адсорбції. Це рівняння називається рівнянням ізотерми адсорбції Ленгмюра.
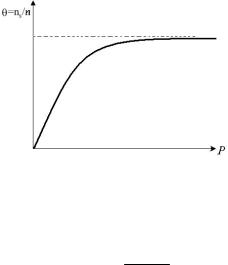
При малих концентраціях n (P<<P0, P0 – тиск насиченої пари – рівноважний тиск над рідиною) величина адсорбції пропорційна
137

концентрації або тиску ( рис. 5.3), а при високих концентраціях (P>P0) величина адсорбції прямує до граничного значення Гмах.
5.1.3. Модель для комп’ютерного аналізу адсорбції
Маємо підкладку певної площі, на яку падають молекули. Місце падіння чи відриву молекули вибирається випадковим чином – вузол двовимірної сітки з випадковими координатами. Алгоритм моделювання за методом Монте-Карло полягає в іспитах на відрив чи осадження молекул в залежності від того занятим або вільним є вибране місце. Визначаємо тиск Р01, при якому динамічна рівновага по кількості падаючих молекул та тих, що випаровуються, має місце для кожного активного центра на поверхні. Для цього прирівняємо кількості атомів, що падають на одне вільне місце з площею Sa=a2 (площа, яку займає одна конденсована молекула) за одиницю часу, і тих, що випаровуються із занятого місця:
|
|
|
|
Ua |
|
|
|
|
|
I = |
|
P01Sa |
= ν e− |
P = |
ν exp(−Ua /kT) 2πmkT |
|
|||
|
kT |
; |
. |
||||||
|
|
|
|||||||
|
|
2πmkT |
01 |
Sa |
|||||
|
|
|
|||||||
Якщо величина тиску Р більше тиску Р01 (Р> Р01), то визначаємо
час τ, за який молекула обов’язково приєднається до поверхні (I=1), з умови:
I = |
|
PSaτoc |
|
= 1 ; |
τoc = |
|
2πmkT |
|
||
|
|
|
|
. |
||||||
|
|
|
|
|||||||
2πmkT |
||||||||||
|
|
|
|
|
|
PSa |
||||
Визначимо імовірність відриву молекули за час τос з умови:
− Ua
ωв = ν e kT τос,
Uа – енергія адсорбції, ν – частота коливання частинки на підкладці. Якщо вибране місце вільне, молекулу приєднаємо. Якщо місце заняте, виконується випробування на відрив. Для цього генерується ви-
падкове число [0:1], якщо воно менше ніж величина ωв, молекула випаровується (Р> Р01).
Якщо (Р<Р01), то менше половини місць буде заповнено адсорбо-
ваними молекулами при наближенні до рівноваги. Визначимо час τв, за який молекула випаровується з підкладки з імовірністю рівної 1:
ωв=ντвexp(–Ua/kT)=1, |
τв= exp(Ua/kT)/ν, |
а також імовірність осадження молекули за цей час τв:
138

ωoc = Pτâ Sa .
2πmkT
Якщо місце було зайнято, воно звільняється. Для випадку вільного місця генерується випадкове число [0÷1]; якщо ωос більше цього числа, то молекула приєднається до поверхні (Р<Р01).
За допомогою процедури «Show» висвічуємо на екрані осадження або відрив атомів. Отже, на екрані можна спостерігати перебіг процесу адсорбції. При великому числі випробувань встановлюється рівновага між числом атомів, що приєдналися і відірвалися.
Після певного числа Монте-Карло випробувань знаходимо величину θ. Потім міняємо тиск, спостерігаємо процес і визначаємо нове значення θ. Повторюючи дослід для різних тисків, визначаємо ізотерму адсорбції. У програмі для відповідної лабораторної роботи передбачена зміна тиску в циклі і побудова графіка ізотерми адсорбції
5.1.4. Ізотерма полімолекулярної адсорбції БЕТ
Якщо є притягання молекул до поверхні, вкритої адсорбентом, можлива полімолекулярна адсорбція. Першими витончене доведення рівняння ізотерми полімолекулярної адсорбції запропонували Брунаэр, Эммет и Теллер (1938 р.). Вони припустили, що енергія взаємодії молекул з підкладкою постійна в межах першого шару, а для інших шарів однакова енергія взаємодії молекул з молекулами із шарів, ближчих до підкладки.
Позначимо:Q1- частка поверхні вкритою шаром в одну молекулу, Q2– частка поверхні, на якій є два шари молекул і т.д. Очевидно, що число адсорбованих молекул
Na = NQ1 + 2NQ2 + 3NQ3 + ...+ iNQi + ... ,
де N - число молекул на одиницю площі в заповненому моношарі. Перепишемо суму
∞
Na = N ∑iQi і знайдемо частку вільної поверхні Q0 = 1− ∑Qi
i
У рівновазі для вільної поверхні (умова збереження Q0)
nV4 Q0 = νQ0 = fNQ1 ,
де ν – інтенсивність осадження молекул, f – частота відриву молекул від поверхні першого шару, якщо над ними немає інших молекул.
139
Умова збереження площі першого моношару:
ν Q0 + f1NQ2 = fNQ1 +ν Q1 .
Враховуючи умову збереження вільної частки поверхні νQ0 = fNQ1 ,
маємо: |
νQ1 = f1NQ2 . |
Записуючи таким же чином умови рівноваги для усіх шарів з урахуванням рівноваги для попереднього шару, прийдемо до аналогічних співвідношень:ν Qi−1 = fi−1NQi .
Уводимо τi=1/f i – час життя в адсорбованому стані в і-му шарі (для першого шару τ=1/f ). Маємо систему:
NQ1 = νQ0τ
NQ2 = νQ1τ1
...
NQi = νQi−1τi−1
БЭТ припустили, що час життя в адсорбованому стані не зале-
жить від номера шару (починаючи з другого) τ1 = τ 2 |
= ... = τi = ... . |
||||||||||||||||||||
Тоді: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q2 = xQ1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q = xQ = x2Q |
|
|
|
|
|
|
ντ1 |
|
|
|
|
|
|
|
|
|
|
||||
3 |
2 |
1 |
|
|
|
x = |
|
|
|
. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
||
... |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q = xi−1Q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Крім того, Q = ντ Q = |
xτ |
Q |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
1 |
N |
0 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
τ1 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
Для повного числа адсорбованих молекул |
|
|
||||||||||||||||||
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
|
τ |
|
|
|
|
|
|
|
Na = N∑iQi = ∑ixi−1Q1 = N |
|
Q0 ∑ixi |
|
|
|
|
|
||||||||||||||
τ1 |
|
|
|
|
|
||||||||||||||||
|
i=1 |
|
|
i |
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
||
|
∞ |
|
|
|
|
τ |
|
|
|
∞ |
|
|
|
|
|
|
|
|
|
|
|
Q0 = 1 − ∑Qi = 1 − |
Q0 ∑xi |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
i=1 |
|
|
|
|
τ1 |
|
i=1 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
τ |
∞ |
|
−1 |
|
|
|
|
|
|
|
|
|
|
||||
Звідси |
Q0 = 1 |
+ |
|
|
|
∑xi . |
|
|
|
|
|
|
|
|
|
|
|||||
τ1 |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
i=1 |
|
|
|
|
|
∞ |
|
|
|
∞ |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
||
|
|
τ |
|
|
|
|
|
|
|
|
|
|
Nk∑ixi |
|
Nkx |
∑xi |
|||||
Позначимо k = |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
, тоді |
|
Na = |
|
|
|
i=1 |
= |
|
dx i=1 |
|
. |
|||||||||
|
|
|
|
|
|
|
|
||||||||||||||
τ1 |
|
|
|
|
|
∞ |
|
∞ |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 + k∑xi |
|
1 + k∑xi |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i=1 |
|
|
i=1 |
|
|
|
140
