
- •Федеральное агентство по образованию Российской Федерации
- •им. М. В. Ломоносова
- •И. А. Туторский
- •Учебное пособие
- •Москва 2004
- •И. А. Туторский
- •Введение в коллоидную химию. Часть 4.
- •11. Электроповерхностные свойства дисперсных систем
- •11.1. Значение электрокинетических явлений в природе и технике
- •11.2. Причины и механизмы возникновения заряда на поверхности в лиозолях.
- •11.3. Связь поверхностного натяжения с электрическим потенциалом. Уравнение Липпмана.
- •11.4 Строение двойного электрического слоя.
- •11.5. Электрокинетические явления.
- •11.6. Электрокинетический потенциал.
- •11.7. Влияние электролитов на двойной электрический слой. Индифферентные электролиты
- •11.9. Влияние температуры и разбавления на ДЭС
- •12. Устойчивость и коагуляция коллоидных систем
- •12.1. Понятие об устойчивости
- •12.2. Расклинивающее давление
- •12.3. Теория агрегативной устойчивости и коагуляции лиофобных дисперсных систем (теория ДЛФО)
- •12.4.Коагуляция.
- •Содержание.

12. Устойчивость и коагуляция коллоидных систем
12.1. Понятие об устойчивости
Устойчивость коллоидных систем является одной из центральных вопросов коллоидной химии, ибо она определяет возможность и время существования коллоидных систем. Время существования коллоидных систем изменяется в очень широких пределах. Так, золи золота, очищенные путем диализа, приготовленные еще Фарадеем в 1857 году, существуют еще и в настоящее время, т. е. почти 150 лет. Эмульсия масла (например, подсолнечного, вазелинового) в воде, расслаивается в течение нескольких минут. Под устойчивостью, или стабильностью коллоидной системы мы понимаем способность системы сохранять свое первоначальное состояние. При этом необходимо учитывать, что устойчивая коллоидная система должна сохранять во времени два параметра; равновесное распределение частиц в среде и степень их дисперсности. С этим связаны два вида устойчивости коллоидных систем: седиментационная, или кинетическая и агрегативная.
Седиментационная устойчивость рассматривается по отношению к силе тяжести и определяется установлением равновесия между силой тяжести, приводящей к оседанию частиц, и диффузией под действием броуновского движения, приводящей к их равномерному распределению. Вследствие этого частицы распределяются в объеме по гипсометрическому закону.
Агрегативная устойчивость определяет способность системы к сохранению степени дисперсности и индивидуальности частиц. Коллоидные системы агрегативны неустойчивы, т. к. в них протекают процессы слипания, коагуляции частиц с образованием агрегатов,
34
Втаблице (Таблица 1) приведены размеры, степень гидратации
иполяризуемость ионов Li и Na .
|
Таблица 11.1. Свойство ионов щелочных металлов. |
||||
|
|
|
|
|
|
№ |
Параметр |
|
Ион |
||
пп |
Li+ |
|
Na+ |
|
|
1. |
Кристаллохимический радиус, r , м 10 11 |
6 |
|
9,5 |
|
2. |
Радиус гидратированного иона, R , м 10 11 |
37 |
|
33 |
|
3. |
Степень гидратации, n |
7 |
|
5 |
|
|
Поляризуемость, 1026 см3 |
|
|
|
|
4. |
3 |
|
19 |
|
|
С увеличением кристаллохимического радиуса ионов их гидратация уменьшается, что позволяет им ближе подходить к поверхности, поляризуемость увеличивается, что приводит к увеличению адсорбционной способности. Следовательно с увеличением радиуса ионов они сильнее сжимают ДЭС. Таким образом, объяснение влияния радиуса иона на ДЭСможет быть дано в рамках представлений Штерна, учитывающих размеры ионов и их гидратацию.
Перезарядка золей индифферентными электролитами
Рассмотрим золь Fe(OH)3, стабилизированный FeCl3, в который вводится Электролит K4[Fe(CN)6], желтая кровяная соль, являющийся для этого золя индифферентным электролитом. Противоионом является ион [Fe(CN)6]4-, - многозарядный и слабо гидратированный ион, обладающий высокой адсорбционной способностью. Он обладает большой способностью нейтрализовать потенциалопределяющие ионы и может адсорбироваться в сверхэквивалентных количествах, то есть входить в ДЭС в количестве, превышающем заряд поверхности.
27
www.mitht.ru/e-library
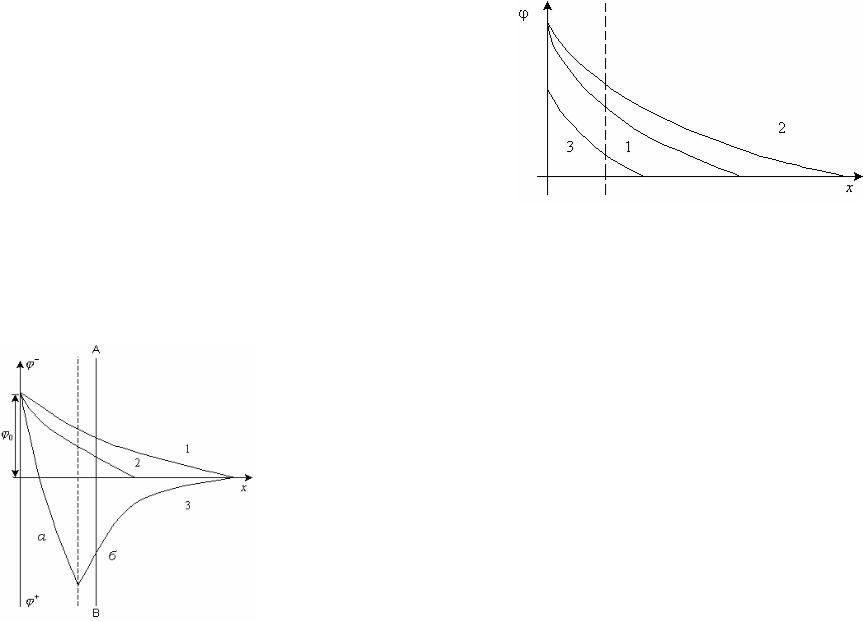
Поэтому 0 и изменяют не только величину, но и знак , то есть происходит перезарядка (рис. 11.16, кривая 3, участок а).
Ион [Fe(CN)6]4- имеет большой заряд, слабо гидратирован и вызывает перезарядку. Новым противоионом является K+, он компенсирует избыточный заряд адсорбционного слоя (участок б). Концентрация электролита увеличивается в ряду 1-2-3. (рис. 11.16). В мицелле перезаряженного золя сохраняется слой потенциалобразующих ионов, состоящих из FeO+, и образуется новый слой ионов [Fe(CN)6]4-, придающий частице отрицательный заряд. Мицелла перезаряженного золя имеет следующую формулу: mFe(OH )3 nFeO (n 4 a)Fe(CN )64 (4a x)K xK ..
4 a)Fe(CN )64 (4a x)K xK ..
Образуется как бы тройной электрический слой. На основе представлений Штерна можно объяснить различное влияние на ДЭС ионов одной валентности и явление перезарядки.
Рис. 11.16. Перезарядка золей многозарядными ионами. В ряду 1-2-3 концентрация электролита увеличивается.
28
Рис. 11.21. Влияние нагревания и разбавления на ДЭС. 1 – T1 ( C1 ); 2 –
T2 T1 ( C2 C1 ); 3 – T3 T2 ( C3 C2 ).
При сильном повышении температуры или сильном разбавлении происходит сильная десорбция потенциалопределяющих ионов в результате которой часть ионов отрывается от поверхности, что приводит к уменьшению 0 и - потенциала (кривая 3). Действие нагревания или разбавления может вызвать коагуляцию коллоидной системы.
33
www.mitht.ru/e-library
