
- •Неравновесная электрохимия. Электролиз
- •Кинетика электродных процессов. Поляризация и перенапряжение
- •Последовательность электродных процессов
- •Применение электролиза
- •Коррозия и защита металлов
- •Термодинамика химической коррозии
- •Кинетика химической коррозии
- •Электрическая коррозия. Механизм
- •Термодинамика электрохимической коррозии
- •Защита металлов от коррозии
Термодинамика химической коррозии
Сущность процесса химической коррозии — это ОВР, осуществляемая непосредственным переходом электронов металла на окислитель. Уравнение реакции:

Эта
реакция может протекать, если
 <0.
В данном случае энергию Гиббса можно
рассчитать как энергию образования
оксидов:
<0.
В данном случае энергию Гиббса можно
рассчитать как энергию образования
оксидов:
 где
где
 —стандартная
энергия Гиббса;
—стандартная
энергия Гиббса;
 —
относительное парциальное давление
кислорода.
—
относительное парциальное давление
кислорода.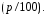
Для
большинства металлов
 >0
(коррозия невозможна) при низких давлениях
О2
и высоких Т.
>0
(коррозия невозможна) при низких давлениях
О2
и высоких Т.
Кинетика химической коррозии
В процессе окисления на поверхности металла образуется твердая пленка оксидов. Для продолжения коррозии необходимо, чтобы ионы металла или кислород диффундировали через эту пленку Через пленку диффундируют ионы металла, т.к. их радиус меньше радикса атома. В том же направлении двигается электроны. С границы газ — пленка двигаются атомы кислорода, т.к. их радикс меньше, чем у ионов. Атомы кислорода в пленке ионизируются и образуют оксиды. Скорость окисления зависит от сплошности и защитных свойств пленки. Свойства оксидных пленок зависят от следующих условий:
 (1)
(1)
 —объем
оксида;
—объем
оксида;
 —
молярная масса оксида;
—
молярная масса оксида; —
плотность металла;
—
плотность металла; —
число атомов металла в молекуле оксида;
—
число атомов металла в молекуле оксида; —
молярная масса металла;
—
молярная масса металла; —
плотность оксида.
—
плотность оксида.

1)
Если
 < 1, то пленка не может быть сплошной и
защищать металл. Скорость роста пленки
в этом случае постоянна:
< 1, то пленка не может быть сплошной и
защищать металл. Скорость роста пленки
в этом случае постоянна: ;
где
;
где —
толщина пленки;
—
толщина пленки; —const;
—const;
 —
время окисления. Такая зависимость
характерна для щелочно - земельных
металлов.
—
время окисления. Такая зависимость
характерна для щелочно - земельных
металлов.
2)
Если
 > 1, то чем толще пленка, тем меньше
коррозия. Эта зависимость характерна
для металловFe,
Co,
Ni,
Mn,
Ti.
Кинетика окисления этих металлов имеем
параболическую зависимость:
> 1, то чем толще пленка, тем меньше
коррозия. Эта зависимость характерна
для металловFe,
Co,
Ni,
Mn,
Ti.
Кинетика окисления этих металлов имеем
параболическую зависимость:
 где
где
 —const,
D
— коэффициент диффузионного тока; CO2
—
концентрация кислорода в газе.
—const,
D
— коэффициент диффузионного тока; CO2
—
концентрация кислорода в газе.
Для ряда металлов (Zn, Al, Cr) установлена логарифмическая зависимость роста пленки во времени:
 .
.
Пленки таких металлов обладают высокими защитными свойствами.
Чтобы пленка обладала защитными свойствами, она должна быть сплошной, достаточно тонкой, прочной, эластичной, иметь хорошее сцепление с металлом и одинаковый с ним коэффициент линейного расширения.
Скорость коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии. Быстрое разрушение пленки вызывают резкие колебания температуры, что связано с различными коэффициентами расширения металла и пленки.
Электрическая коррозия. Механизм
Коррозия металла в средах с ионной проводимостью протекает через анодное окисление металла:
 и
катодное восстановление окислителя
и
катодное восстановление окислителя
 .
.
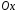 :
:
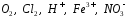 и др.
и др.
Коррозия с кислородной деполяризацией:
Чаще
всего при
 наблюдается восстановление кислорода:
наблюдается восстановление кислорода:
при
 <
7 :
<
7 :
и
выделения водорода:
 —
коррозия с водородной деполяризацией.
—
коррозия с водородной деполяризацией.

Основное отличие процессов электрохимической коррозии от процессов гальванического элемента — отсутствие внешней цепи. Электроны не входят из металла, а двигаются внутри него. Химическая энергия реакции не в виде работы, а в виде теплоты, которая рассеивается в окружающей среде.

Термодинамика электрохимической коррозии
Коррозия
металла возможна, если
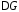 <
0.
<
0. .
.
Тогда
коррозия возможна, если
 >
0. Известно, что
>
0. Известно, что >
0, если
>
0, если
 >
> .
.
Потенциал
кислородного электрода при

 ,
,
при
 <
7 :
<
7 : ;
;
потенциал водородного электрода:

Тогда
1)
 >
> (
( )
и
)
и ,
тогда коррозия невозможно (Au,
Pt и др).
,
тогда коррозия невозможно (Au,
Pt и др).
2)
 (
( )
>
)
> >
> ,
возможно коррозия с поглощением
кислорода, но невозможна в водородной
деполяризацией; (большинствоMe:
Ni,
Co,
Fe,
Cd).
,
возможно коррозия с поглощением
кислорода, но невозможна в водородной
деполяризацией; (большинствоMe:
Ni,
Co,
Fe,
Cd).
3)
 (
( )
и
)
и >
>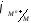 ,
возможна коррозия и с кислородной, и с
водородной деполяризацией. Щелочные и
щелочноземельные металлы,Al,
Zn
и др.
,
возможна коррозия и с кислородной, и с
водородной деполяризацией. Щелочные и
щелочноземельные металлы,Al,
Zn
и др.
