
Химсопрмат
.pdfЕсли коррозионный процесс контролируется диффузией катодного деполяризатора, то введение катодных примесей приводит к увеличению количества путей диффузии деполяризатора, т.е. росту скорости коррозии. То же наблюдается и при диффузионнокинетическом контроле, но в меньшей степени.
Если процесс коррозии протекает в условиях пассивирования анодной фазы, то катодная структурная составляющая может облегчить наступление пассивирования анодной фазы и снизить скорость коррозии.
На коррозионное поведение сплавов большое влияние оказывает механических фактор, т.е. внутренние и внешние механические напряжения, которые бывают постоянными и переменными, истирание металла или кавитационное воздействие. Механические напряжения:
–понижают термодинамическую устойчивость металла;
–вызывают пластическую деформацию и фазовые превращения;
–нарушают сплошность защитных пленок;
–усиливают электрохимическую гетерогенность металла.
Постоянные растягивающие напряжения, как внешние, так и внутренние, сильно повышают скорость общей коррозии, которая растет примерно пропорционально их величине (рис. 2.18), и переводят коррозию из общей в местную, например коррозионное растрескивание [24].
Коррозионно-механические трещины постепенно зарождаются на поверхности металла под влиянием локализации анодного процесса и растягивающих напряжений. Дальнейшее развитие коррозионных трещин происходит в результате совместного действия неоднородности структуры металла, дефектов в защитных пленках, неравномерности напряжений, расклинивающего действия адсорбированных активных веществ.
Коррозионное растрескивание усиливается при наводороживании металла. Водород, сегрегируя в областях максимальной механиче-
ской напряженности, создает дополнительные напряжения в металле.
109
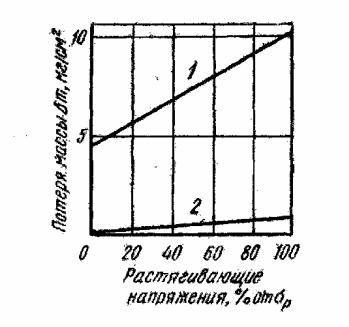
Рис. 2.18. Зависимость коррозии алюминия от напряжения в растворах:
1 – 3% NaCl + 1% HCl;
2 – 3% NaCl + 0,2% H2O2
Борьбу с этим опасным видом коррозии ведут следующим обра-
зом [24]:
1) используют металл, менее склонный к коррозионному рас-
трескиванию; 2) применяют коррозионно-стойкое легирование (например,
хромом, молибденом); 3) проводят отжиг деформированного металла для снятия внут-
ренних напряжений; 4) создают в поверхностном слое металла сжимающие напряже-
ния (например, обдувка металла дробью или обкатка роликом); 5) уменьшают механические дефекты в поверхностном слое ме-
талла; 6) обрабатывают коррозионную среду, например, вводят замед-
лители коррозии;
7)наносят защитные покрытия;
8)применяют электрохимическую защиту.
110
Переменные напряжения вызывают так называемое явление ус-
талости металла. Если металл подвержен действию переменных на-
грузок и агрессивной среды, его коррозионная стойкость резко пада-
ет. Это явление носит название коррозионной усталости. Ускоренное разрушение металла происходит в результате появления сетки мик-
роскопических трещин, переходящих в крупную трещину коррозион-
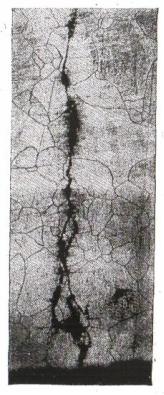
ной усталости (рис. 2.19) [14] транскристаллитного или межкристал-
литного типа.
Рис. 2.19. Усталостная трещина в образце стали 12Х18Н10Т
Борьбу с коррозионной усталостью ведут путем проведения следующих мероприятий [13, 24]:
1)устранение вредных переменных напряжений;
2)создание в поверхностном слое металла сжимающих напряжений, что снижает опасность растягивающих циклов переменных напряжений;
111
3)обработка поверхности металла для уменьшения количества дефектов;
4)нанесение защитных смазок, анодных металлических защитных покрытий;
5)азотирование стали;
6)удаление катодных деполяризаторов, например кислорода, или введение в среду замедлителей коррозии;
7)катодная поляризация от внешнего источника тока или с помощью протектора.
Коррозия при трении вызывает сильное разрушение металла.
Разновидностью такого процесса является фреттинг-коррозия. Корро-
зия при трении представляет собой два сопряженных процесса:
1)электрохимическое или химическое взаимодействие металла с агрессивной средой;
2)механический процесс износа поверхностных защитных пле-
нок и самого металла под действием напряжений.
Способом борьбы с этим явлением служит применение сплавов на медной основе, армированных стеклотканью эпоксидных покры-
тий, катодной электрохимической защиты [24].
Металл, контактирующий с жидкостью, подвергается гидравли-
ческим ударам, которые создают пульсирующие напряжения и раз-
рушают защитные пленки и даже структуру самого металла. Этот вид коррозии называют коррозионной кавитацией, которая приводит к образованию местных каверн.
Повышения коррозионной кавитационной стойкости достигают:
1)созданием оптимальной конструкции детали;
2)повышением прочности и коррозионной усталости;
3)поверхностным упрочнением металла;
112

4)нанесением различных защитных покрытий;
5)применением катодной поляризации.
2.8.2. Внешние факторы
Водородный показатель (pH) заметно влияет на скорость элек-
трохимической коррозии металлов, изменяя потенциал катодных де-
поляризационных реакций, в которых участвуют ионы H или OH .
Рис. 2.20. Влияние рН на коррозию железа в аэрированной мягкой воде при 20° С
Так как рН почти всех природных вод находится в пределах 4-10,
значит, любое железо, погруженное в пресную или морскую воду,
будь то низкоили высоколегированная сталь, ковкое железо, чугун,
холоднокатаная малоуглеродистая сталь, будет иметь практически одинаковую скорость коррозии (рис. 2.20).
113

Все металлы, согласно данным А.Я. Шаталова, по зависимости
скорости электрохимической коррозии от pH можно разбить на пять
групп (рис. 2.21) [1].
Рис. 2.21. Основные типы кривых зависимости скорости коррозии
металлов K от pH среды
1. Металлы, устойчивые в кислых и щелочных растворах, ско-
рость коррозии которых не зависит от pH среды (рис. 2.21, а).
2. Металлы, малоустойчивые в кислых, недостаточно стойкие в нейтральных и коррозионно-стойкие в щелочных растворах, стой-
кость которых обусловлена защитными гидрооксидными пленками,
растворимыми в кислотах и малорастворимыми в щелочных раство-
рах (рис. 2.21, б).
3. Металлы, неустойчивые в кислых, но коррозионно-стойкие в щелочных растворах за счет наличия защитных оксидных и гидроок-
сидных пленок (рис. 2.21, в).
4. Металлы, коррозионно-стойкие в кислых, но неустойчивые в щелочных растворах, что обусловлено кислым характером их защит-
ных пленок (рис. 2.21, г).
5. Металлы, коррозионно-стойкие в нейтральных растворах, но неустойчивые в кислых и щелочных растворах (рис. 2.21, д).
114
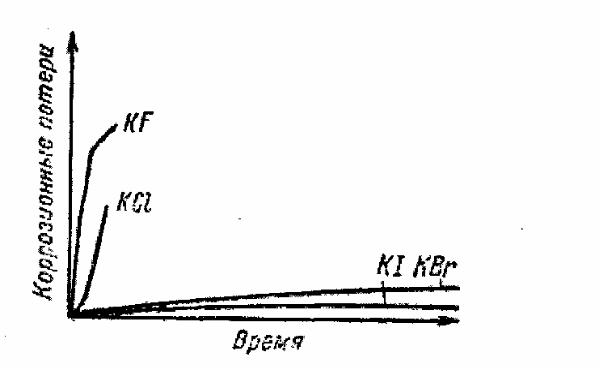
Рис. 2.22. Влияние природы аниона на кинетику коррозии
Скорость электрохимической коррозии металлов в растворах со-
лей и кислых растворах зависит от природы среды и ее концентрации
(рис. 2.22 и 2.23), причем эта зависимость может быть различной [1].
Так, например, растворы солей, обладающих окислительными свойствами, повышают скорость электрохимической коррозии метал-
лов, если эти соли являются катодными деполяризаторами. Соли, об-
разующие с ионом корродирующего металла комплексы, сильно смещают потенциалы анодного процесса в отрицательную сторону и облегчают протекание анодного процесса, уменьшая концентрацион-
ную поляризацию, что приводит к увеличению скорости коррозии
(см. рис. 2.23, 2.24).
В электролитах, затрудняющих или исключающих наступление пассивности, не наблюдается снижения скорости коррозии металлов с увеличением скорости движения электропроводной агрессивной среды (рис. 2.25) [24].
115
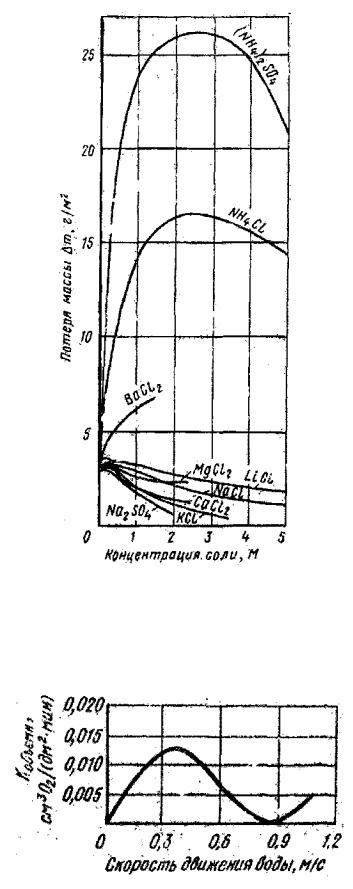
Рис. 2.23. Влияние концентрации солей на коррозию низкоуглеродистой стали
Рис. 2.24. Влияние скорости движения насыщенной кислородом водопроводной воды на скорость коррозии стали
116
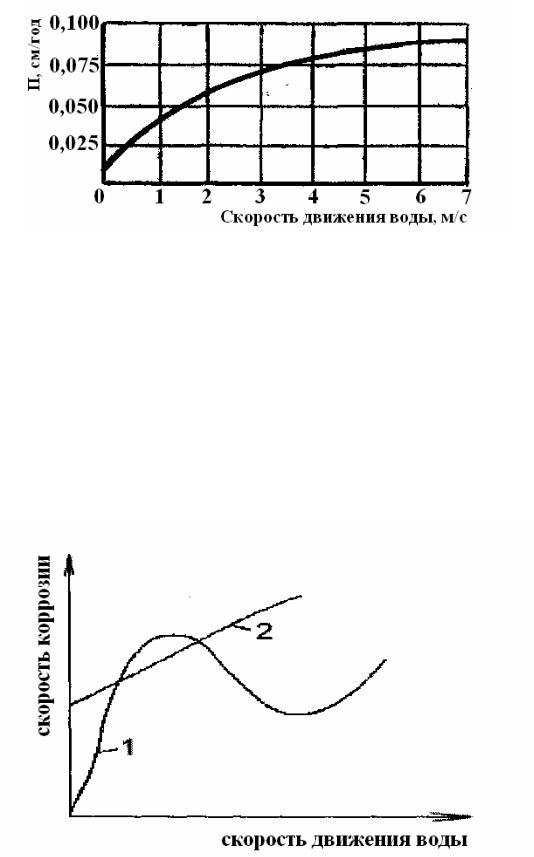
Рис. 2.25. Влияние скорости движения морской воды на скорость коррозии П низкоуглеродистой стали
Так, в работе [60] показано, что скорость движения агрессивной среды в значительной степени определяет коррозионное поведение металлов. С увеличением скорости движения водопроводной воды, не содержащей значительного количества солей, сначала происходит повышение скорости коррозии стали из-за увеличения подвода кислорода к микрокатодам поверхности стали (рис. 2.26, кривая 1).
Рис. 2.26. Зависимость скорости коррозии стали от скорости движения жидкости:
1 – водопроводная вода; 2 – морская вода
117
Последующее снижение скорости коррозии при достаточно быстром течении воды объясняется тем, что обилие кислорода приводит к пассивации анодных участков (кислород выступает как замедлитель коррозии). Наконец, при очень больших скоростях движения воды снова наблюдается увеличение скорости коррозии металла вследствие эрозии, т. е. механического разрушения защитных пленок или даже структуры самого металла. При наличии в растворе значительного количества активных анионов пассивация может не наступить, т. е. происходит постоянное возрастание скорости коррозии металла с увеличением скорости движения коррозионной среды, например в морской воде (рис. 2.26, кривая 2).
Температура среды оказывает значительное влияние на скорость электрохимической коррозии металлов [1, 4, 24], так как изменяются скорость диффузии, перенапряжение электродных процессов, степень анодной пассивности, растворимость деполяризатора и вторичных продуктов коррозии. Характер влияния температуры выражается экспоненциальным законом (1.23).
При электрохимической коррозии металлов в нейтральных электролитах, протекающей с кислородной деполяризацией, повышение температуры снижает перенапряжение ионизации кислорода и ускоряет диффузию кислорода к поверхности корродирующего металла, но уменьшает растворимость кислорода (рис. 2.27). Если кислород не может выделяться из раствора при повышении температуры, то скорость коррозии непрерывно возрастает (см. рис. 2.27, кривая 1).
Если кислород может выделяться из раствора с повышением температуры, зависимость скорости коррозии металла от температуры имеет вид кривой 2 (см. рис. 2.27) с максимумом. Первоначально, несмотря на уменьшение содержания кислорода в воде с ростом температуры, сказывается ускоряющее действие температуры, но когда концентрация кислорода становится очень низкой, скорость коррозии уменьшается.
Неодинаковая температура отдельных участков металла приводит к возникновению термогальванических коррозионных пар, в ко-
118
