
- •(ЧитГу)
- •Индивидуальные домашние задания по химии
- •1. Классы неорганических соединений
- •12,73 Г г раствора, тогда г
- •Вариант 2
- •Вариант 5
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •2. Химический эквивалент
- •Решение. Эквивалент есть количество вещества и выражается в молях.
- •Решение. Эквивалентную массу koh рассчитаем по формуле:
- •Решение. Эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
- •3. Строение атома
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 1
- •Вариант 5
- •Вариант 17
- •Вариант 18
- •5. Химическая термодинамика
- •Вариант 9
- •Вариант 1
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •11. Свойства металлов
- •Вариант 11
- •Вариант 21
- •Библиографический список
- •672039, Чита, ул. Александрово-Заводская, 30
Вариант 9
Сколько килоджоулей выделится при образовании из простых веществ 2,8 кг окиси кальция?
Как изменится энтропия при обратимом фазовом переходе:


 Твёрдое вещество
жидкое газ твёрдое вещество?
Твёрдое вещество
жидкое газ твёрдое вещество?
Вычислить изменение изобарно-изотермического потенциала для реакции: 3Fe2O3(т) + CO(г) = 2Fe3O4(т) + CO2(г) в стандартных условиях.
Вариант 10
Сколько килоджоулей выделится при образовании из простых веществ 18 г двуокиси кремния?
Не проводя расчетов, определить знак энтропии в ходе превращений:



 S(т)
S(ж)
S8(г)
S2(г)
S(т)
S(т)
S(ж)
S8(г)
S2(г)
S(т)
Стандартная энтропия ромбической серы равна 31,90 Дж/мольК, моноклинной – 32,57 Дж/мольК, а стандартные энтальпии сгорания серы соответственно равны – 297,01 и 297,35 кДж/моль. Вычислите изменение изобарно-изотермического потенциала перехода ромбической серы в моноклинную в стандартных условиях.
Вариант 11
Сколько килоджоулей выделится при образовании из простых веществ 47,8 г сульфида свинца?
Не проводя расчетов, определить знак S в ходе химической реакции: 2P(т) + 5/2O2(г) = P2O5(т).
Вычислить по справочным данным изменение изобарно-изотермического потенциала в стандартных условиях для реакции: BaCO3(т) = BaO(т) + CO2(г).
Вариант 12
Вычислить ∆H реакции: С(графит) + СО2(г) = 2СО(г).
Вычислите изменение энтропии при плавлении 3 молей уксусной кислоты CH3COOH, если температура плавления 16,6 оС, а теплота плавления 194 Дж/г.
Как изменяются основные свойства гидроксидов в ряду



 LiOH
NaOH KOH RbOH CsOH?
LiOH
NaOH KOH RbOH CsOH?
Ответ дайте, рассчитав ∆G системы Me2O + H2O = 2MeOH.
Вариант 13
Вычислить ∆H реакции: 2CO(г) + O2(г) = 2CO2(г).
Вычислить изменение энтропии при плавлении серебра 54 г, если известно, что температура плавления серебра 960 oC, теплота плавления 10,467 кДж/моль.
Используя справочные данные, определить термодинамическую возможность протекания в стандартных условиях следующих реакций:
а) 2Al(т) + 3/2O2(г) = Al2O3(т);
б) 2Au(т) + 3/2O2(г) = Au2O3(т).
Вариант 14
Вычислить ∆H реакции: CuO(т) + H2(г) = Cu(т) + H2O(ж).
Для некоторой реакции: 2A2(г) + B2(г) = 2A2B(г) So < 0. Значит ли это, что реакция термодинамически возможна?
Оценить термодинамическую возможность протекания в стандартных условиях реакции: N2(г) + 2H2O(ж) = NH4NO2(т). Может ли эта реакция протекать при высокой температуре?
Вариант 15
Вычислить ∆H реакции: 3Fe3O4(т) + 8Al(т) = 9Fe(т) + 4Al2O3(т).
Вычислить изменение энтропии в ходе химической реакции при стандартных условиях: 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Используя справочные данные, определить, какая из реакций термодинамически возможна при комнатной температуре:
а) BaCO3(т) = BaO(т) + CO2(г);
б) BaO(т) + CO2(г) = BaCO3(т);
в) Ba(OH)2(т) + CO2(г) = BaCO3(т) + H2O(ж).
Вариант 16
Вычислить ∆H реакции: 2Pb(NO3)2(т) = 2PbO(т) +4NO2(г) +O2(г).
Вычислить
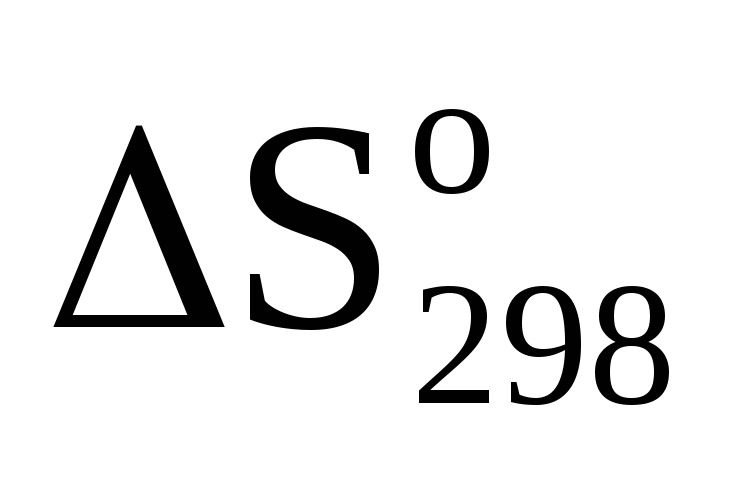 реакции (1).
реакции (1).Вычислить ∆G реакции (1).
Вариант 17
Тепловой эффект реакции SO2(г) + 2H2S(г) = 2S(ромб) +H2O(ж) равен -234,50 КДж. Определите стандартную теплоту образования сероводорода.
Вычислить изменение стандартной энтропии следующего процесса: MgO(т) + H2(г) = Mg(т) + H2O(ж).
Пользуясь справочными данными, определить, какая из приведенных реакций термодинамически предпочтительнее:
2H2S(г) + 3O2(г) = 2H2O(ж) + 2SO2(г)
2H2S(г) + O2(г) = 2H2O(г) + 2S(г).
Вариант 18
Вычислить ∆H реакции: 4Fe(OH)2(т) + O2(г) + 2H2O(ж) = 4Fe(OH)3(т).
Вычислить
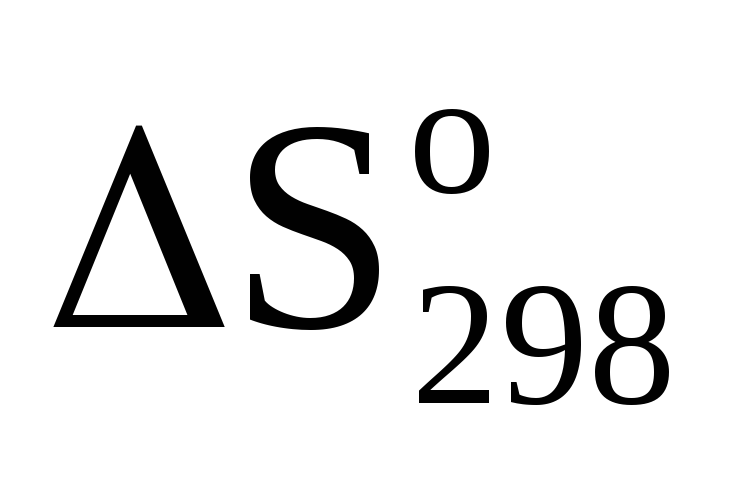 реакции (1).
реакции (1).Вычислить ∆G реакции (1).
Вариант 19
Определить стандартную теплоту образования сероуглерода CS2, если известно, что CS2(ж) + 3O2(г) = CO2(г) + 2SO3(г)
∆Но р. = -1075 кДж.
Можно ли использовать при стандартных условиях реакцию NH4Cl(т) + NaOH(т)= NaCl(т) + H2O(г)+ NH3(г) для получения аммиака?
Определить возможность протекания реакции 2С(графит) + H2(г) = C2H2(г). Подсчитать ∆G процесса.
Вариант 20
Тепловой эффект реакции SO2(г) + 2H2S(г) = 3S(ромб) + 2H2O(ж) равен -234,5 кДж. Определить стандартную теплоту образования H2S.
Определить ∆G реакции MeO(т) + CO2(г) = MeCO3(т) для Ме от Ве до Ва; на основании этого сделайте вывод об изменении основных свойств оксидов этих Ме.
Определите
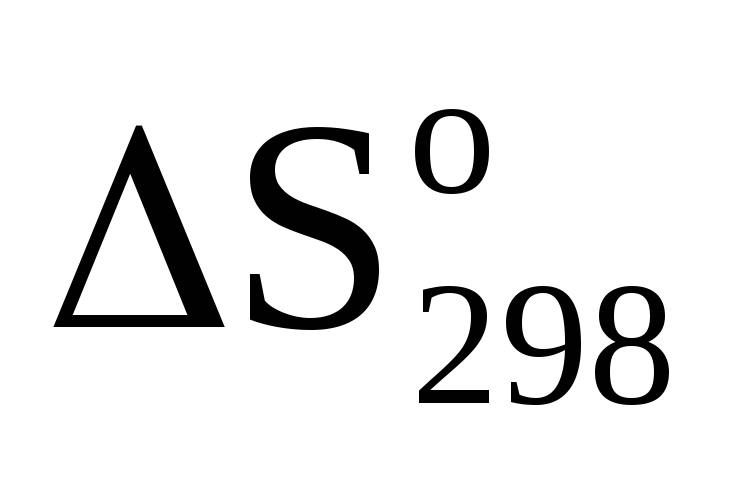 системы:H2(г)
+ S(ромб)
= H2S(г).
системы:H2(г)
+ S(ромб)
= H2S(г).
Вариант 21
Определить стандартную энтальпию ∆Hf PH3, исходя из уравнения: 2PH3(г) + 4O2(г) = P2O5(к) + 3H2O(ж); ∆Ho = -2360 кДж.
Исходя из величины ∆Gf образования соединений, участвующих в реакции, определить возможна ли реакция:
Al2O3(т) +3SO3(г) = Al2(SO4)3(т)
Удельная теплота плавления льда равна 33480 Дж/кг. Определить изменение молярной энтропии при плавлении льда.
Вариант 22
Исходя из теплового эффекта реакции 3CaO(к) + P2O5(к) = Ca3(PO4)2(к); ∆Но = -739 кДж, определить ∆Hf образования ортофосфата кальция.
Какая из приведенных реакций разложения KNO3 наиболее вероятна:
а) KNO3 = K+NO2 + 1/2O2;
б) 2KNO3 = K2O +2NO2+O2;
в) KNO3 = KNO2 + 1/2O2.
Изменение энтропии при плавлении 100 г Cu равно 1,28 Дж/К. Рассчитать удельную теплоту плавления меди, если tплав.=1083 oС.
Вариант 23
Стандартные теплоты образования ацетилена, углекислого газа и воды соответственно равны 227,3; -394,4 и -242,0 кДж/моль. Вычислить стандартную теплоту сгорания ацетилена.
Будут ли при 25 оС протекать реакции:
а) KH + H2O =KOH + H2;
б) KH = K + 1/2H2?
Вычислить изменение энтропии при испарении 250 г воды при 25 оС, если молярная теплота испарения воды при этой температуре равна 44,08 кДж/моль.
Вариант 24
Определить ∆Hf BiCl3(т), если ∆Hf BiCl3(г) =-270,70 кДж/моль, а ∆Но возгонки BiCl3(т) = 113,39 кДж/моль.
Как изменяются основные свойства гидроксидов в ряду: LiOH, NaOH, KOH, RbOH, CsOH? Ответ дать рассчитав ∆G системы Me2O + H2O = 2MeOH.
Рассчитать изменение энтропии при плавлении 3 молей уксусной кислоты, если tплав.=16,6 ОС, а теплота плавления 194 Дж/град.
Вариант 25
Определить количество теплоты, выделяющейся при взаимодействии 50г фосфорного ангидрида с водой по реакции:
P2O5 + H2O = 2HPO3, если тепловые эффекты реакции равны:
2P+ 5/2O2 = P2O5, ∆Но реакции = -1549,0 кДж.
2P + H2 + 3O2 = 2HPO3, ∆Но реакции = -1854,8 кДж.
Возможна ли следующая реакция: 2Hg2Cl2 = 2HgCl2 + 2Hg? Ответ подтвердить, рассчитав ∆G этой системы.
Теплота испарения бромбензола при 429,8 К равна 241,0 Дж/г. Определить ∆S при испарении 1,25 молей бромбензола.
Таблица. Термодинамические свойства веществ
|
Вещество (состояние) |
∆Нf, кДж/моль |
S298, Дж/мольК |
∆Gf, кДж/моль |
|
1 |
2 |
3 |
4 |
|
Al(т) |
0 |
28,34 |
0 |
|
AlBr3 (т) |
-528,4 |
205,1 |
- |
|
Al2O3 (т) |
-1676,0 |
125,60 |
-1582,0 |
|
Al2(SO4)3 (т) |
-3437,4 |
239,5 |
-3091,9 |
|
Au (т) |
0 |
47,39 |
0 |
|
Au2O3 (т) |
80,80 |
125,6 |
- |
|
В (т) |
0 |
5,9 |
0 |
|
В2О3(т) |
-1281,6 |
54,2 |
- |
|
Ва (т) |
0 |
60,9 |
0 |
|
ВаО (т) |
-558,6 |
70,6 |
528,8 |
|
Ва(ОН)2(т) |
-947,0 |
103,8 |
-856,0 |
|
ВаСО3(т) |
-1218 |
112,6 |
-1140,5 |
|
ВаSO4 (т) |
-350,2 |
31,6 |
- |
|
ВеО (т) |
-599,1 |
141,1 |
-581,6 |
|
ВеСО3(т) |
- |
- |
-944,75 |
|
С (графит) |
0 |
5,7 |
0 |
|
СО (г) |
-110,5 |
197,5 |
-137,1 |
|
СО2(г) |
-393,5 |
213,7 |
-394,4 |
|
С2Н2(г) |
226,8 |
200,8 |
209,2 |
|
СаО (т) |
-635,5 |
39,7 |
-604,2 |
|
СаСО3(т) |
-1207,0 |
88,7 |
-1127,7 |
|
Сl2O (г) |
76,6 |
266,2 |
94,2 |
|
1 |
2 |
3 |
4 |
|
Cs2O (т) |
- |
- |
-274,5 |
|
CsOH (т) |
-407,0 |
77,9 |
-355,2 |
|
Сu(т) |
0 |
33,36 |
0 |
|
CuO (т) |
-162,0 |
42,6 |
-129,9 |
|
Cu2O (т) |
-167,47 |
93,99 |
- |
|
Fe (т) |
0 |
27,174 |
0 |
|
FeO(т) |
-264,8 |
60,8 |
-244,3 |
|
Fe2O3(т) |
-822,2 |
87,4 |
-740,3 |
|
Fe3O4 (т) |
-1117,1 |
146,2 |
-1014,2 |
|
Fe(OH)2 (т) |
-568,595 |
79,553 |
- |
|
Fe(OH)3 (т) |
-824,839 |
96,301 |
- |
|
Н2(г) |
0 |
130,6 |
0 |
|
Н2О (г) |
-241,8 |
188,7 |
-228,6 |
|
Н2О (ж) |
-285,8 |
70,1 |
-237,3 |
|
Н2О2(ж) |
-187,1 |
105,9 |
-117,57 |
|
H2S (г) |
-21,0 |
205,7 |
-33,8 |
|
HgCl2 (т) |
- |
- |
-185,77 |
|
Hg2Cl2 (т) |
- |
- |
-210,66 |
|
KH (т) |
-62,8 |
70,6 |
-38,49 |
|
KOH (т) |
-426,2 |
59,4 |
-374,47 |
|
K2O (т) |
- |
- |
-103,3 |
|
KNO2 (т) |
- |
- |
-281 |
|
KNO3 (т) |
-493,0 |
133,0 |
-393,1 |
|
Li2O (т) |
-596,6 |
38,1 |
-560,2 |
|
LiOH (т) |
-488,2 |
42,7 |
-443,1 |
|
Mg(т) |
0 |
32,8 |
0 |
|
MgO (т) |
-601,8 |
26,9 |
-569,6 |
|
MgCO3 (т) |
- |
- |
-955,96 |
|
NH3 (г) |
-46,2 |
192,6 |
-16,64 |
|
NH4Cl (т) |
- |
- |
-342,64 |
|
NH4NO2 (т) |
-256 |
- |
-116,02 |
|
NO(г) |
90,3 |
210,6 |
86,6 |
|
NO2 (г) |
33,5 |
240,2 |
51,5 |
|
HNO3 (ж) |
-173,3 |
155,7 |
-80,0 |
|
Na2O (т) |
-421,6 |
71,2 |
-376,6 |
|
NaOH (т) |
-428,3 |
64,1 |
-337,0 |
|
NaCl (т) |
-412,8 |
72,85 |
-384,0 |
|
O2(г) |
0 |
205,0 |
0 |
|
О3(г) |
142,8 |
239,1 |
163,54 |
|
P2O5 (т) |
-1492 |
114,5 |
-1348,2 |
|
РвО (т) |
-219,3 |
66,1 |
- |
|
Pb(NO3)2 (т) |
-483,65 |
213,27 |
- |
|
PbS (т) |
-94,28 |
- |
- |
|
Rb2O (т) |
- |
- |
-290,79 |
|
RbOH (т) |
-414,1 |
85,0 |
-364,43 |
|
S (ромб) |
0 |
31,88 |
0 |
|
SO2 (г) |
-296,9 |
248,1 |
-300,2 |
|
1 |
2 |
3 |
4 |
|
SO3 (г) |
-395,8 |
256,7 |
-370,37 |
|
SiO2 (т) |
-910,9 |
41,8 |
-856,7 |
|
SrO (т) |
-590,3 |
54,4 |
-559,8 |
|
SrCO3 (т) |
-1218,3 |
97,1 |
-1137,6 |
ХИМИЧЕСКАЯ КИНЕТИКА
Кинетика – учение о скорости различных процессов, в том числе химических реакций. Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции).
Это определение
можно выразить уравнением
![]() ,
где знак плюс относится к изменению
концентрации вещества, образующегося
в результате реакции (DС>О),
а знак минус – к изменению концентрации
вещества, вступающего в реакцию (DС<О).
,
где знак плюс относится к изменению
концентрации вещества, образующегося
в результате реакции (DС>О),
а знак минус – к изменению концентрации
вещества, вступающего в реакцию (DС<О).
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентрации определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции типа 2А + В2 = АВ2 закон действия масс выражается следующим образом: υ = k [A]2 [B2].
В этом уравнении [A]2 и [B2] – концентрации вступающих в реакцию веществ (в степени их стехиометрических коэффициентов), а коэффициент пропорциональности k – константа скорости реакции, значение которой зависит от природы реагирующих веществ.
При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс.
Пример 1. Написать выражения закона действия масс для реакций:
а) 2NO(г) + Cl2(г) = 2NOCl(г);
б) СаСО3(к) = СаО(к) + СО2(г).
Решение.
а) υ = k
[NO]2
[Cl2];
б) поскольку
карбонат кальция – твердое вещество,
от концентрации которого скорость
гетерогенной реакции не зависит, искомое
выражение будет иметь вид: υ = k , т. е. в
данном случае скорость реакции при
определенной температуре постоянна.
Пример 2. Как изменится скорость реакции 2NO(г) + О2(г) = 2NO2(г), если уменьшить объем реакционной смеси в три раза?
Решение. До изменения объема скорость реакции выражалась уравнением υ = k [NO]2 [О2]. Вследствие уменьшения объема концентрация каждого из реагирующих веществ возрастет в три раза. Следовательно, теперь: υ1 = k (3[NO])2 3[О2] = 27 k [NO]2 [О2].
Сравнивая выражения для υ и υ1, находим, что скорость реакции возрастет в 27 раз.
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
υt + Dt/ υt = kt + Dt/ kt = gDt/10.
Пример 3. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастает скорость реакции при повышении температуры от 20 до 75 0С?
Решение.
Поскольку Dt
= 55 0С,
то обозначив скорость реакции при 20 и
75 0С
соответственно υ и υ1,
можем записать:
![]() =
2,855/10;
lg
=
2,855/10;
lg![]() = 5,5lg2,8
= 2,45.
= 5,5lg2,8
= 2,45.
Отсюда скорость реакции увеличится в 287 раз.
При протекании
химической реакции концентрации исходных
веществ уменьшаются; в соответствии с
законом действия масс это приводит к
уменьшению скорости реакции. Если
реакция обратима, т. е. может протекать
как в прямом, так и в обратном направлениях,
то с течением времени скорость обратной
реакции будет возрастать, так как
увеличиваются концентрации продуктов
реакции. Когда скорости прямой и обратной
реакции становятся одинаковыми, наступает
состояние химического равновесия и
дальнейшего изменения концентраций
участвующих в реакции веществ не
происходит. В случае обратимой химической
реакции аА + bВ
↔ сС + dD
, в состоянии химического равновесия
скорость прямой и обратной реакции
равны.
![]() ,
,
где К – константа равновесия реакции.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Константа равновесия – постоянная при данной температуре величина. Чем больше константа равновесия, тем «глубже» протекает реакция, т. е. тем больше выход ее продуктов.
В выражение константы равновесия гетерогенной реакции, как и в выражения закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Пример 4. В системе А(г) + 2В(г) = С(г) равновесные концентрации равны: [А] = 0,06 моль/л, [В] = 0,12 моль/л, [С] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение.
Константа равновесия данной реакции
выражается уравнением:
![]() ,
подставляя в него данные задачи, получаем
,
подставляя в него данные задачи, получаем![]() = 2,5. Для нахождения исходных концентраций
веществ А и В учтем, что, согласно
уравнению реакции из 1 моля А и 2 молей
В образуется 1 моль С. Поскольку по
условию задачи в каждом литре системы
образовалось 0,216 моля вещества С, то при
этом было израсходовано 0,216 моля А и
0,216*2 = 0,432 моля В. Таким образом, искомые
концентрации равны: [А0]
= 0,06 + 0,216 = 0,276 моль/л; [В0]
= 0,12 + 0,432 = 0,552 моль/л.
= 2,5. Для нахождения исходных концентраций
веществ А и В учтем, что, согласно
уравнению реакции из 1 моля А и 2 молей
В образуется 1 моль С. Поскольку по
условию задачи в каждом литре системы
образовалось 0,216 моля вещества С, то при
этом было израсходовано 0,216 моля А и
0,216*2 = 0,432 моля В. Таким образом, искомые
концентрации равны: [А0]
= 0,06 + 0,216 = 0,276 моль/л; [В0]
= 0,12 + 0,432 = 0,552 моль/л.
Вариант I
Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 200 °С, принимая температурный коэффициент скорости равным 2.
Вычислите константу равновесия для реакции: СО + Н20 ↔ С02 + Н2, исходя из того, что при состоянии равновесия [СО] = 0,04 моль/л: [Н20] = 0,064 моль/л, [С02] = [Н2] = 0,016 моль/л.
Равновесные концентрации веществ, участвующих в системе: 2NO + 02 ↔ 2N02 , были: моль/л [NO] =0,056; [02] = 0,028; [N02] = 0,044. Вычислите исходные концентрации [NO] и [O2] .
Вариант 2
Как изменятся скорость реакции 2NO + 02 ↔ 2N02, если уменьшить объем реакционного сосуда в 2 раза?
Температурный коэффициент скорости реакции равен 2. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 75 °С?
3. Реакция идет по уравнению: 4HCl + O2 ↔ 2H2O + 2Cl2 . Через некоторое время после начала реакции концентрации участвовавших в ней веществ были: (моль/л)[ HCl ] = 0,75; [02] = 0,42; [Cl2] – 0,20. Какими были концентрации этих веществ в начале реакции?
Вариант 3
1. Напишите выражение закона действия масс для реакций:
а) H2S (г) = H2 (г) + S (г);
б) N2O4 (г) = 2NO2 (г);
в) 2СО (г) + О2 (г) = 2СО2 (г).
В системе А(г) + 2В(г) ↔ 3С(г) равновесные концентрации равны: [ A ] = 0,6 моль/л; [ B ] = 1,2 моль/л: [ C ] = 2,16 моль/л. Найти константу равновесия реакции.
Найти исходные концентрации веществ А и В в задании 2?
Вариант 4
1. Определите, как изменится скорость прямой реакции 2SO2 + O2 = 2SO3 , если общее давление в системе увеличить в 4 раза?
2. Температурный коэффициент скорости некоторой реакции равен 3. Как изменится скорость этой реакции при повышении температуры от 80 до 130 С.
3. Смещается ли равновесие в системах H2(г) + Cl2(г) ↔ HCl(г), 2N2O5(г) ↔ О2(г) + 4NO2(г) при изменении давления? Напишите выражения для констант равновесия каждой из систем.
Вариант 5
1. Как изменится скорость прямой реакции ЗСН3ОН + Н3В03 = В(ОСН3)3 + ЗН20, если увеличить концентрацию метилового спирта с 0,3 до 0,6 моль/л, а концентрацию борной кислоты с 0,2 до 1,2 моль/л?
2. При повышении температуры от 10 до 50 0С скорость некоторой реакции увеличилась в 16 раз. Вычислите температурный коэффициент скорости этой реакции.
3. Написать формулу для вычисления константы равновесия реакции: 4HCl + O2 ↔ 2H2O + 2Cl2. В каком направлении сместится это равновесие в случае увеличения объёма системы в 4 раза?
Вариант 6
1. Как изменится скорость химической реакции N2 (г) + 3H2 (г) = 2NH3 (г), протекающей в закрытом сосуде, если давление в нем увеличить в 3 раза.
2. Константа равновесия реакции 2NO ↔ N2O4 при некоторой температуре равна 0,25. Вычислить концентрацию компонентов в системе при наступлении равновесия, если [NO]исх = 9,2 моль/л.
3. Как были изменены температура и давление в гетерогенной системе: СаС03 = СаО + CO2 – 43 ккал, если равновесие сместилось вправо?
Вариант 7
1. При некоторой температуре равновесные концентрации в системе: 2SO2 + O2 ↔ 2SO3 составляли соответственно [SO2 ] = 0,04моль/л, [ 02 ] = 0,06 моль/л; [ S03 ] = 0,02 моль/л. Вычислить константу равновесия и исходные концентрации [SO2] и [O2].
2. В каком направлении сместиться равновесие следующих реакций при понижении температуры: H2S (г) ↔ H2 (г) + S (г) – 4,8 ккал; N2O4 (г) ↔ 2NO2 (г) + 15,92 ккал.
3. При температуре 100 С скорость одной реакции в 2 раза больше скорости второй. Температурный коэффициент скорости первой равен 2, второй – 4. При какой температуре скорости обеих реакций выравняются?
Вариант 8
1. Реакция идет согласно уравнению: 2NO (г) + Cl2 (г) = 2NOCl (г). Концентрации исходных веществ до начала реакции составляли: [ NO ] = 0,4 моль/л; [ Cl2 ] = 0,3 моль/л, во сколько раз изменится скорость реакции по сравнению с первоначальной в тот момент, когда успеет прореагировать половина оксида азота?
2. Как можно увеличить процентное содержание PCl3 в равновесной системе: PCl5 ↔ PCl3 + Cl2 – 130ккал.
3. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 50 раз? Температурный коэффициент скорости реакции равен 1,8.
Вариант 9
1. Куда сместится равновесие вследствие уменьшения объёма в системах: 4HCl + O2 ↔ 2H2O + 2Cl2; 2NO + 02 ↔ 2N02.
2. Вычислить равновесные концентрации веществ, участвующих в реакции: СО + Н20 ↔ С02 + Н2 по следующим данным: [C0] = 0,1 моль/л; [Н20] = 0,4 моль/л, Кр = I.
3. Во сколько раз изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
Вариант 10
1. Во сколько раз необходимо увеличить концентрацию вещества А, чтобы при уменьшении концентрации вещества в 4 раза скорость реакции 2А (г) + В (г) = С (г) не изменилась?
2. Константа равновесия обратимой реакции 2А (г) + В (г) ↔ С (г) + 2D (г) равна 0,0208. Вычислить равновесные концентрации всех веществ, если известно, что вначале реакции система содержала 60 моль вещества А и 40 моль вещества В. Объем системы 10л.
3. В каком направлении сместятся равновесия: 2СО(г) + 02(г) ↔ 2С02(г) Н = 566 кДж; N2(г) + 02(г) ↔ 2NO(г) Н = 180 кДж при повышении давления и понижении температуры?
Вариант 11
1. При некоторой температуре равновесные концентрации реагентов обратимой химической реакции 2А (г) + В (г) ↔ 2С (г) составляли [ A ]=0,04 моль/л, [ B ] =0,06 моль/л, [ C ]=0,02 моль/л. Вычислить константу равновесия и исходные концентрации веществ А и В.
2. Во сколько раз надо изменить давление газовой смеси для того, чтобы увеличить скорость реакции 2SO2(г) + О2(г) = 2SO3(г) в 27 раз?
3. Напишите математические выражения закона действия масс для следующих систем:
а)2РН3(г) + 4О2(г ) = Р2О5(к) + 3Н2О(ж), Н0 = -2360 кДж;
б) 2SO2(г) + О2(г) = 2SО3(г) , Н = -198 кДж.
Как повлияют на данные системы изменения температуры и давления?
Вариант 12
1. В какую сторону сместится химическое равновесие реакции: А (г) + 2В (г) ↔ 2С (г) + Q, если давление увеличить в 3 раза и одновременно повысить температуру на 20 С, температурный коэффициент скорости экзотермической реакции равен 2, а эндотермической – 3.
2. Через некоторое время после начала реакции ЗА + В = 2С + Д концентрации веществ составляли: [ А ] = 3 моль/л, [ В ] = 1 моль/л,
[ С ] = 0,8 моль/л. Каковы исходные концентрации А и В?
3. Напишите выражение закона действия масс для реакций:
а) 4А(г) + В(г) = А4В(г);
б) С(т) + 2Д(г) = СД2(т);
в) 3В(г) + 2С(г) = Д(ж).
Вариант 13
1. Во сколько раз увеличится скорость химической реакции, протекающей в газовой фазе, если температуру изменить от 10 до 100 °С? Температурный коэффициент скорости реакции равен 2?
2. Рассчитайте, как изменится скорость прямой и обратной реакции в системе 2SO2 + O2 ↔ 2SO3, если уменьшить объём, занимаемый газами в 2 раза. Сместится ли при этом равновесие системы?
3. Почему изменение давления смещает равновесие системы N2 (г) + 3H2 (г) ↔ 2NH3 и не смещает равновесие системы N2 (г) + O2 (г) ↔ 2NO (г)? Ответы дайте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления.
Вариант 14
1. Константа равновесия в гомогенной системе N2 + 3H2 ↔ 2NH3 при температуре 400 °С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 моль/л и 0,08 моль/л. Вычислите равновесную и начальную концентрации азота.
2. Предскажите, как будет меняться окраска смеси газов, участвующих в равновесии 2NO2 ↔ N2O4, при одновременном увеличении температуры и уменьшения давления. Известно, что NO2 окрашен в бурый цвет, а N2O4 бесцветен.
3. Вычислите константу равновесия реакции N2O4(г) ↔ 2NO2(г), если исходная концентрация N2O4 составляла 0,09 моль/л, а к моменту равновесия продиссоциировало 50 % молекул N2O4.
Вариант 15
1. Равновесие в газообразном состоянии в системе 2NO2 ↔ 2NO +O2 при некоторой температуре установилось при концентрациях [NO2]=0,07 моль/л, [NO]= 0,25 моль/л, [O2] = 0,11 моль/л. Найти константу равновесия и исходную концентрацию NO2.
2. Вычислите, во сколько раз увеличится скорость реакций, протекающей в газовой фазе, при повышении температуры от 30 до 70 °С, если температурный коэффициент равен 2.
3. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г) + О2(г) ↔ 2SO3(г), если объём газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Вариант 16
1. Константа равновесия гомогенной системы CO(г) + Н2О(г) ↔ СО2(г) + Н2(г) при 850 °С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации равны [С0]исх. = 3 моль/л, [Н2О] исх. = 2 моль/л.
2. Как изменится скорость реакции, протекающей в газовой фазе при повышении температуры на 30 °С, если температурный коэффициент скорости данной реакции равен трем?
3. Как изменится скорость реакции 2NO(г) + О2(г) ↔ 2NО2(г) Н = -113 кДж, если давление в этой химической системе, находящейся в замкнутом сосуде, увеличить в 3 раза? В каком направлении сместится химическое равновесие при понижении: а) температуры; б) давления; в) концентрации кислорода?
Вариант 17
1. Как изменится скорость реакции, протекающей в газовой фазе при повышении температуры на 30 0С, если =2,7?
2. Напишите выражение для константы равновесия гетерогенной системы С(к) + 2Н2О(г) ↔ СО2(г) + 2Н2(г). Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образование водяных паров?
3. Во сколько раз изменится скорость прямой и обратной химической реакции H2(г) + I2(г) = 2HI(г), если объем газовой смеси увеличить в 3 раза?
Вариант 18
1. Температурный коэффициент скорости реакции равен 3. Во сколько раз возрастет скорость реакции при повышении температуры от 80 до 200 °С?
2. Запишите на основании закона действия масс выражения прямой и обратной реакции для следующих примеров:
2СО(г) + 02(г) = 2С02(г); С02(г) + С(т) = 2СО(г);
FеО(т) + СО(г) = Fе(т) + С02(г).
3. Во сколько раз изменится скорость прямой реакции и обратной в системе CН4(г) + 4Cl2(г) ↔ СCl4(г) + 4НСl(г)), если объём газовой смеси уменьшить в три раза, в какую сторону сместится равновесие системы?
Вариант 19
1. К некоторому моменту времени скорость реакции А(г) +В(г) = С(г) уменьшилась в 10 раз. Как изменились концентрации веществ А и В, если их исходные концентрации были равны между собой?
2. Во сколько раз изменится скорость реакции при повышении температуры на 50 0С, если =2,4?
3. Какие факторы определяют значение константы скорости химической реакции? Зависит ли константа скорости, подобно скорости реакции, от природы реагирующих веществ, их концентрации, давления, температуры, катализатора? Может ли изменяться значение константы скорости в ходе реакции?
Вариант 20
1. Как влияет на равновесие следующих реакций:
2Н2 + 02 ↔ 2Н20(г) Н = - 453,6 кДж
СаС03(т) ↔ СаО(т) + С02(г) Н = 179 кДж
а) повышение давления; б) повышение температуры; в) уменьшение концентрации Н20 и СО2.
2. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 °С скорость реакции возросла в 30 раз.
3. Через некоторое время после начала гомогенной реакции в газовой фазе 2А +2В ↔ 3С +Д равновесные концентрации составляли: [A] = 2 моль/л, [B] = 1 моль/л, [C] =0,6 моль/л. Рассчитайте исходные концентрации веществ А и В.
Вариант 21
1. Как изменится скорость реакции при увеличении концентрации первого и второго вещества в два раза для гомогенной системы: CО2(г) + Н2(г) = СО(г) + Н2О(г).
2. Из первоначально взятых 2 моль/л азота и 2 моль/л водорода после установления равновесия образовалось 0,5 моль/л аммиака. Вычислить константу равновесия системы: N2 + 3H2 ↔ 2NH3 .
3. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 20 раз, если температурный коэффициент равен 3.
Вариант 22
1. При некоторой температуре константа равновесия FeO(к) + СО(г) ↔ СО2(г) + Fe(к) равна 0,5. Записать выражение для константы равновесия и найти равновесные концентрации газообразных компонентов, если исходные концентрации [СО] = 0,05 моль/л и [СО2 ]= 0,015 моль/л.
2. Как изменится скорость реакции H2 + I2 = 2HI, если вдвое увеличить: а) давление в системе; б) объем системы (без изменения количеств веществ); в) концентрацию йода в системе?
3. Определите температурный коэффициент скорости реакции, если при понижении температуры на 50 °C реакция замедлилась в 243 раз?
Вариант 23
1. Равновесие в системе H2(г) + I2(г) ↔ 2HI(г) установилось при следующих концентрациях: [H2] = 0,23 моль/л, [I2] = 0,04 моль/л и [HI] = 0,85 моль/л. Определите исходные концентрации йода и водорода и рассчитайте константу равновесия для этой системы.
2. Записать выражения для констант равновесия следующих обратимых реакций:
а) BaO (т) + CО2 (г) ↔ ВаСО3 (т);
б) Fe3O4 (т) + 4H2 (г) ↔ 3Fe + 4H2O (г);
в) N2 (г) + 3H2 (г) ↔ 2NH3 (г).
3. Как изменится скорость прямой реакции при уменьшении давления в 2 раза: 2А + 4В2 = 2АВ3.
Вариант 24
1. Вычислите константу равновесия реакции N2O4(г) ↔ 2NO2(г), если исходная концентрация N2O4 составляла 0,14 моль/л, а к моменту равновесия продиссоциировало 50 % молекул N2O4.
2. Во сколько раз увеличится скорость реакции при повышении температуры с 20 до 120 °С, если температурный коэффициент равен трем?
3. Перечислите факторы, влияющие на скорость химической реакции.
Вариант 25
1. Как изменится скорость при увеличении концентрации первого и второго вещества в 2 раза в гомогенной системе: 2NO + Вг2 = 2NOBr; С2Н4 + Сl2 = С2Н4Сl2.
2. Определите исходные концентрации азота и водорода, если при наступлении равновесия системы N2 + 3H2 ↔ 2NH3 концентрации веществ были: азота – 0,5 моль/л, водорода – 0,3 моль/л, аммиака – 2 моль/л. В какую сторону сместится равновесие, если увеличить давление?
3. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 80 раз, если температурный коэффициент равен 3?
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Пример 1. Сколько граммов поваренной соли и воды необходимо для приготовления 2 кг 20 %-ного раствора?
Решение. 20 %-ный раствор содержит 20 г соли в 100 г раствора:
20 г_________100 г
x г_________2000 г
x = 20 • 2000 / 100 = 400 г.
Ответ. Для приготовления 2 кг 20 %-ного раствора поваренной соли необходимо 400 г соли и (2000 - 400) = 1600 г воды.
Пример 2. Сколько граммов КОН нужно взять для приготовления 500 мл 0,1М раствора?
Решение. 1 моль КОН имеет массу 39 + 16 + 1 = 56 г, 0,1 моль составляет 5,6. Следовательно, в 1000 мл 0,1М раствора содержится 5,6 г, а в 500 мл в 2 раза меньше, т. е. 2,8 г.
Ответ. Для приготовления 500 мл 0,1М раствора КОН нужно взять 2,8 г КОН, растворить в небольшом количестве воды в мерной колбе и разбавить водой до 500 мл.
Пример 3. Сколько миллилитров 96 %-ной H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1 л 0,5 н. раствора?
Решение. Эквивалент серной кислоты равен половине молекулярной массы, т. е. 98 / 2 = 49
Для приготовления 1 л 0,5 н. потребуется 0,5 моль-экв., или 49 • 0,5=24,5 г. В 1 мл 96 %-ной H2SO4 содержится 1,84 • 96 / 100 = 1,77 г,
следовательно, для приготовления 1 л 0,5 н. раствора надо взять
24,5 / 1,77 = 13,84 мл 96 %-ной H2SO4.
Пример 4. Требуется вычислить давление пара раствора, содержащего 0,2 моля сахара в 450 г воды. Давление пара чистой воды при 20 °С равно 17,5 мм рт. ст.
Решение. Вычисляем, сколько молей воды содержится в 450 г. 1 моль воды равен 18 г, отсюда число молей растворителя N = 450 / 18 = 25. Число молей растворенного вещества (п) равно 0,2. Подставляем все эти величины в формулу
ΔР = Р0 • n / N = 17,5 • 0,2 / 25 = 0,14 мм.
Отсюда давление пара раствора Δ Р = Р0 – Р =17,5 – 0,14 = 17,36 мм рт. ст.
Пример 5. Вычислить температуру замерзания раствора содержащего 54 г глюкозы С6Н12О6 в 250г воды. Криоскопическая константа воды равна 1,86 0С.
Решение. В 250 г воды содержится 54 г глюкозы, значит в 1000 г воды 54 • 1000 / 250 = 216 г, что составляет 216 / 180, или 1,2 моля (молекулярная масса глюкозы равна 180). Вычислим понижение температуры замерзания:
Δ t0= К • С= 1,86 • 1,2 = 2,23 °.
Ответ. Раствор будет замерзать при – 2,23 °С.
Вариант 1
1. Сколько граммов HCI содержится в 300 мл 10 %-ного раствора (p =1,03 г/мл)?
2. В 1 кг воды растворено 666 г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
3. Давление пара воды при 25 ° составляет 23,76 мм рт. ст. Вычислить для той же температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы С6Н12О6.
Вариант 2
1. К 400 мл 32 %-ного раствора HNO3 (p =1,8 r/мл) прибавили 1 л Н20. Чему равна процентная концентрация азотной кислоты в полученном растворе.
2. Плотность 15 %-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
3. Давление пара воды при 20 °С составляет 17,54 мм рт. ст. Сколько граммов сахара С12Н22О11 следует растворить в 720 г воды для получения раствора, давление пара которого на 0,14 мм рт. ст. ниже давления пара воды?
Вариант 3
1. Сколько граммов 30 %-ного (по массе) раствора NaCl нужно добавить к 300 г воды, чтобы получить 10 %-ный раствор соли?
2. Плотность 9 %-ного (по массе) раствора сахарозы C12H22O11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
3. Вычислить, каково будет давление пара раствора при 65 °С, содержащего 13,68 г сахара в 90 г воды, если давление водяного пара при той же температуре равно 187,5 мм рт. ст.
Вариант 4
1. В какой массе воды надо растворить 67,2 л НС1 (объем измерен при нормальных условиях), чтобы получить 9 %-ный (по массе) раствор НС1?
2. Плотность 40 %-ного (по массе) раствора HNO3 равна 1,25 г/мл. Рассчитать молярность и моляльность этого раствора.
3. При 42 °С давление водяного пара 61,5 мм рт. ст. На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы С6Н12О6.
Вариант 5
1. Какую массу 20 %-ного (по массе) раствора КОН надо добавить к 1 кг 50 %-ного (по массе) раствора, чтобы получить 25 %-ный раствор?
2. Плотность 9 %-ного (по массе) раствора сахарозы C12H22O11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
Вычислить давление пара 10 %-ного водного раствора сахара С12Н22О11 при 100°.
Вариант 6
1. Определить массовую долю вещества в растворе, полученном смещением 300 г 25 %-ного и 400г 40%-ного (по массе) растворов этого вещества.
Какой объем 2М раствора Na2CO3 надо взять для приготовления 1 л 0,25 н. раствора?
3. Каково будет давление пара 10 %-ного водного раствора мочевины CO(NH2)2 при 100 °С?
Вариант 7
1. Из 400г 20 %-ного (по массе) раствора при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
2. Сколько миллилитров концентрированной соляной кислоты (р = 1,19 г/мл), содержащей 38 % (массе) НС1, нужно взять для приготовления 1 л 2 н. раствора?
3. Давление водяного пара при 70 °С равно 233,8мм рт. ст., давление пара раствора, содержащего в 270 г воды 12г растворенного вещества при той же температуре, равно 230,68 мм рт. ст. Определить молекулярную массу растворенного вещества.
Вариант 8
1. Какой объем воды надо прибавить к 100 мл 20 %-ного (по массе) раствора H2SO4 (p =1,14 г/мл), чтобы получить 5 %-ный раствор?
2. К 100 мл 96 %-ной (по массе) H2SO4 (плотность 1,84, г/мл) прибавили 400 мл воды. Получился раствор плотностью 1,220 г/мл. Вычислить его эквивалентную концентрацию и массовую долю H2SO4.
3. Определить молекулярную массу анилина, если при 30 0С давление пара раствора, содержащего 3,09 г анилина в 370 г эфира С4Н10О, равно 643,6мм рт. ст., а давление пара чистого эфира при той же температуре равно 647,9 мм рт. ст.
Вариант 9
1. К 500 мл 32 %-ной (по массе) HNO3 (р = 1,20 г/мл) прибавили 1 л воды. Чему равна массовая доля HNO3 в полученном растворе?
2. Рассчитать нормальность концентрированной соляной кислоты (плотность 1,18 г/мл), содержащей 36,5 % (масс.) НС1.
3. Вычислить, на сколько градусов понизится температура замерзания бензола, если в 100 г его растворить 4 г нафталина C10H8.
Вариант 10
1. До какого объема надо разбавить 500 мл 20 %-ного (по массе) раствора NaCl (p =1,152 г/мл), чтобы получить 4,5 %-ный раствор (p =1,029 г/мл)?
2. Имеется раствор, в 1 л которого содержится 18,9 г HNO3, и раствор, содержащий в 1 л 3,2г NaOН В каком объемном отношении нужно смешать эти растворы для получения раствора, имеющего нейтральную реакцию?
3. На сколько градусов повысится температура кипения, если в 100 г воды растворить 9 г глюкозы C6H1206?
Вариант 11
1. Найти массовую долю азотной кислоты в paстворе, в 1 л которого содержится 224 г HNO3 (p =1,12 г/мл).
2. Какой объем 0,2 н. раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 мл 0,5 н. раствора FeCl3?
3. При какой температуре будет кипеть 50 %-ный водный раствор С12Н22О11?
Вариант 12
1. Плотность 26 %-ного (по массе) раствора КОН равна 1,24 г/мл. Сколько молей КОН находится в 5 л раствора?
2. Для нейтрализации 20 мл 0,1н. раствора кислоты потребовалось 8 мл раствора NaOH Сколько граммов NaOH содержит 1 л этого раствора?
3. Сколько граммов сахара С12Н22О11 надо растворить в 100 г воды, чтобы понизить ее точку замерзания на 1 0С?
Вариант 13
1. Для приготовления 5 %-ного (по массе) pacтвора MgSO4 взято 400 г MgSO4∙ 7H2O. Найти массу полученного раствора.
2. На нейтрализацию 40 мл раствора щелочи израсходовано 25 мл 0,5н. раствора H2SO4. Какова нормальность раствора щелочи? Какой объем 0,5н. раствора НС1 потребовался бы для той же цели?
3. В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,104 °С?
Вариант 14
1. Сколько молей MgSO4-7H2O надо прибавить к 100 молям воды, чтобы получить 10 %-ный (по массе) раствор MgSO4?
2. Для полного осаждения BaSO4 из 100 г 15 %-ного (по массе) раствора ВаС12 потребовалось 14,4 мл H2SO4. Найти нормальность раствора H2SO4.
3. Сколько граммов глюкозы С6Н12О6 следует растворить в 260 г воды, чтобы температура кипения раствора повысилась на 0,05 °?
Вариант 15
1. Определить массовую долю CuSO4 в растворе, полученном при растворении 50 г медного купороса CuSO4-5H2O в 450 г воды. Ответ: 6,4 %.
2. Найти массу воды, необходимую для приготовления раствора хлорида натрия, содержащего 1,50 моля NaCl на 1000 г Н2О, если имеется 10 г NaCl?
Раствор, содержащий 5,4 г неэлектролита в 200 г воды, кипит при 100,078 °С. Вычислить молекулярную массу растворенного вещества.
Вариант 16
1. В какой массе воды нужно растворить 25 г CuSO4∙5H2O, чтобы получить 8 %-ный (по массе) раствор CuSO4?
2. Какой объем 2 н. раствора H2SO4 потребуется для приготовления 500 мл 0,5 н. раствора?
3. Раствор, содержащий 2 г растворенного вещества в 200 г воды, замерзает при – 0,547 °С. Вычислить молекулярную массу растворенного вещества.
Вариант 17
1. Сколько граммов Na2SO4-10H2O надо растворить в 800 г воды, чтобы получить 10 %-ный (по массе) раствор Na2SO4?
2. Какой объем 0,05 н. раствора можно получить из 100 мл 1 н. раствора?
3. Раствор, содержащий 6,15 г растворенного вещества в 150 г воды, замерзает при t = 0,93 °С. Определить молекулярную массу растворенного вещества.
Вариант 18
1. Сколько граммов 2 %-ного (по массе) раствора AgNO3 дадут при взаимодействии с избытком NaCl 14,35 г осадка AgCl?
2. Вычислить молярность и нормальность 40 %-ного раствора Н3РО4 (р = 1,29 г/мл).
3. При растворении 2,76 г глицерина С3Н8О3 в 200г воды температура замерзания понизилась на 0,279 °С. Определить молекулярную массу глицерина.
Вариант 19
1. Сколько литров NH3 (объем измерен при нормальных условиях) следует растворить в 200г 10 %-ного (по массе) раствора NH4OH, чтобы получить 15 %-ный раствор NH4OH?
2. Смешаны 800 мл 3 н. КОН и 1,2 л 12 %-ного раствора КОН (р = 1,10 г/мл). Чему равна нормальная концентрация полученного раствора?
3. Раствор, приготовленный из 2 кг этилового спирта C2H5OH и 8 кг воды, залили в радиатор автомобиля. Вычислить температуру замерзания раствора.
Вариант 20
1. Сколько граммов SO3 надо растворить в 400 г Н2О, чтобы получить 15 %-ный (по массе) раствор H2SO4?
2. Сколько миллилитров 20 %-ного раствора HCI (р = 1,10 г/мл) следует добавить к 4 л 0,6 н. НС1 для получения 1 н. раствора?
3. Раствор, содержащий 2,7 г фенола С6Н5ОН в 75 г бензола, замерзает при 3,5 °С, тогда как чистый бензол замерзает при 5,5 °С. Вычислить криоскопическую константу бензола.
Вариант 21
1. Найти процентную концентрацию глюкозы в растворе, содержащем 280 г воды и 40 г глюкозы.
2. В 1 кг воды растворено 400 г КОН; плотность раствора равна 1,1 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
3. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при t = 20 0С?
Вариант 22
1. Сколько граммов Na2SO3, потребуется для приготовления 5 л 8 %-ного (по массе) раствора (p =1,075 г/мл)?
2. Для осаждения всего хлора, содержащегося в 15 мл раствора NaCl, израсходовано 25 мл 0,1 н. раствора AgNO3. Сколько граммов NaCl содержит 1 л этого раствора?
3. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (р = 0,8 г/мл). При какой самой низкой температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет?
Вариант 23
1. 1 мл 25 %-ного (по массе) раствора содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
2. Плотность раствора К2СО3 составляет 1,22. Из 1 л этого раствора при действии соляной кислоты получено 44,5 л СО2 при нормальных условиях. Вычислить процентное содержание К2СО3 в растворе и его нормальность.
3. При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при t = 1,45 0С. Определить молекулярную массу растворенного вещества.
Вариант 24
1. Из 400 г 50 %-ного (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля H2SO4 в оставшемся растворе?
2. Сколько миллилитров 30 %-ного раствора HNO3 (р = 1,205 г/мл) нужно взять для приготовления 0,5 л 1 н. раствора?
3. Сколько граммов сахарозы С12Н22О11 надо растворить в 100 г воды, чтобы: а) понизить температуру кристаллизации на 1 градус; б) повысить температуру кипения на 1 градус?
Вариант 25
1. При 25 °С растворимость NaCl равна 36 г в 100 г воды. Найти массовую долю NaCl в насыщенном растворе.
2. К 300 мл 18 %-ного раствора Na2CO3 (р = l,19 г/мл) добавили 500 мл 6 %-ного раствора H2SO4 (р = l,04 г/мл). Сколько миллилитров 2,5 н. НС1 потребуется для разложения оставшейся соды?
3. При какой приблизительно температуре будет кипеть 50 %-ный (по массе) раствор сахарозы С12Н22О11?
ИОННЫЕ РЕАКЦИИ. ГИДРОЛИЗ СОЛЕЙ
