
- •Эквивалент вещества
- •Теоретическая часть.
- •1.Эквивалент вещества. Эквивалентное число.
- •2. Расчет z(в) в окислительно-восстановительных реакциях.
- •3. Расчет z(в) в обменных реакциях.
- •4. Молярная масса и молярный объем эквивалентов вещества.
- •5. Количество вещества эквивалентов.
- •6. Закон эквивалентов.
- •7. Закон эквивалентов для реакций, протекающих в растворах.
- •Лабораторная работа №1 Определение молярной массы эквивалентов простого вещества.
- •Последовательность выполнения эксперимента.
- •Расчет экспериментального значения молярной массы эквивалентов алюминия и ошибки эксперимента.
- •Вопросы к защите лабораторной работы №1.
- •Лабораторная работа №2. Определение молярной массы сложного вещества.
- •Результаты опыта 1 записать в следующей форме:
- •Расчет Сэк(NaOh)
- •Результаты опыта 2 записать в следующей форме:
- •Расчет Mэк неизвестной кислоты
- •Вопросы к защите лабораторной работы №2.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
РОССИЙСКОЙ ФЕДЕРАЦИИ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ (СИБСТРИН)
Кафедра химии
Эквивалент вещества
Методические указания
к выполнению лабораторных работ
для студентов I курса всех специальностей
и форм обучения
НОВОСИБИРСК 2007
Методические указания переработаны
канд. хим. наук Т.А. Шершнёвой
Утверждены методической комиссией СТФ
февраля 2007 года
Рецензент:
Г.А. Маринкина, канд. хим. наук, доцент
кафедры химии НГАУ
© Новосибирский государственный
архитектурно-строительный
университет (Сибстрин), 2007
 Эквивалент
вещества.
Эквивалент
вещества.
Теоретическая часть.
1.Эквивалент вещества. Эквивалентное число.
Эквивалент – одна из важнейших характеристик простых и сложных веществ. Эквивалент вещества Э (В) – условная частица вещества в Z раз меньше, чем соответствующая формульная единица (ФЕ) этого вещества, принимающая участие в данной реакции.
 (1)
(1)
Число
Z(В)
называют эквивалентным числом или
числом эквивалентности вещества В
(буквой В обозначается формульная
единица вещества, которой может быть
химическая формула атома (S,
Fe),
молекулы (O2,
H2O),
иона (K+,
 )
и др. частиц, оно показывает во сколько
раз эквивалент данного вещества меньше
формульной единицы, а так же показывает
какое число эквивалентов вещества
условно "содержится" в одной
формульной единице этого вещества.
Следовательно, всегдаZ(В)
≥1. Если известно значение Z(В)
можно записать Э (В). (см. табл. 1)
)
и др. частиц, оно показывает во сколько
раз эквивалент данного вещества меньше
формульной единицы, а так же показывает
какое число эквивалентов вещества
условно "содержится" в одной
формульной единице этого вещества.
Следовательно, всегдаZ(В)
≥1. Если известно значение Z(В)
можно записать Э (В). (см. табл. 1)
Таблица 1
|
Вещество |
ФЕ |
Z(В) |
Э (В) |
|
Оксид алюминия |
Al2O3 |
6 |
|
|
Фосфорная кислота |
H3PO4 |
3 |
|
Значения Z(В), а, следовательно, и эквивалент для большинства веществ не являются постоянными величинами и изменяются в зависимости от реакций, в которых они участвуют. И только в тех случаях, когда Z(В) = 1 и не может иметь других значений, эквивалент вещества постоянен и идентичен формульной единице (см. табл. 2)
Таблица 2
|
В |
HCl |
KOH |
NaCl |
NH4OH |
HNO3 |
|
Z(В) |
1 |
1 |
1 |
1 |
1 |
|
Э(В) |
HCl |
KOH |
NaCl |
NH4OH |
HNO3 |
Определение эквивалентных чисел веществ неодинаково для обменных и окислительно-восстановительных реакций.
2. Расчет z(в) в окислительно-восстановительных реакциях.
В окислительно-восстановительных реакциях имеет место изменение степеней окисления атомов в результате отдачи или принятия электронов. В таких реакциях Z(В) определяют по числу отданных электронов одной формульной единицей восстановителя или принятых электронов одной формульной единицей окислителя.
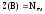 (2)
(2)
где
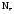 –
число отданных или принятых электронов
одной формульной единицей вещества.
–
число отданных или принятых электронов
одной формульной единицей вещества.
Например, в реакции
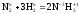 (3)
(3)
Z(N2) = 6, т.к. одна формульная единица азота N2 принимает в ходе реакции шесть электронов:
 +
6
+
6
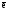 = 2N-3
= 2N-3  =
6, (4)
=
6, (4)
а Z(H2) = 2, т.к. одна формульная единица водорода H2 отдает два электрона:
 ,
(5)
,
(5)
На примере реакций (6) и (8) можно убедиться, что одно и то же вещество – углерод может иметь различные значения Z(В).
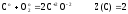 (6)
(6)
т.к.
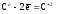
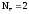 (7)
(7)
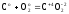 Z(C)
= 4 (8)
Z(C)
= 4 (8)
т.к.
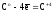
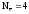 (9)
(9)
Как следует из приведенных реакций (6) и (8) эквивалентное число кислорода равно четырём, Z(O2) = 4, т.к. одна формульная единица O2 принимает четыре электрона:

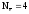 (10)
(10)
