
- •Эквивалент вещества
- •Теоретическая часть.
- •1.Эквивалент вещества. Эквивалентное число.
- •2. Расчет z(в) в окислительно-восстановительных реакциях.
- •3. Расчет z(в) в обменных реакциях.
- •4. Молярная масса и молярный объем эквивалентов вещества.
- •5. Количество вещества эквивалентов.
- •6. Закон эквивалентов.
- •7. Закон эквивалентов для реакций, протекающих в растворах.
- •Лабораторная работа №1 Определение молярной массы эквивалентов простого вещества.
- •Последовательность выполнения эксперимента.
- •Расчет экспериментального значения молярной массы эквивалентов алюминия и ошибки эксперимента.
- •Вопросы к защите лабораторной работы №1.
- •Лабораторная работа №2. Определение молярной массы сложного вещества.
- •Результаты опыта 1 записать в следующей форме:
- •Расчет Сэк(NaOh)
- •Результаты опыта 2 записать в следующей форме:
- •Расчет Mэк неизвестной кислоты
- •Вопросы к защите лабораторной работы №2.
Результаты опыта 1 записать в следующей форме:
1. Объем раствора HCl V1(HCl) = …см3
V2(HCl) = …см3
2. Концентрация раствора HCl Сэк(HCl) = …моль-эк/л
3.Объем раствора NaOH, пошедший на титрование
V1(NaOH) = …см3
V2(NaOH) = …см3
4. Средний объем раствора NaOH, пошедший на титрование
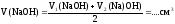
Расчет Сэк(NaOh)
1.Согласно закону эквивалентов для реакции (50)
nэк(NaOH) = nэк(HCl) (52)
2.Выразим nэк(NaOH) и nэк(HCl) через молярные концентрации эквивалентов этих растворов и их объемы (уравнение (48)):
Cэк(HCl) · V(HCl) = Cэк(NaOH) · V(NaOH) (53)
3.Из уравнения (53) выразить неизвестную величину Cэк(NaOH), используя значения соответствующих величин и произвести расчет, подставляя средний объем раствора NaOH.
Опыт 2. Определение молярной массы эквивалентов неизвестной кислоты.
1. Получите у преподавателя колбу с раствором неизвестной кислоты, на которой указана масса кислоты в граммах.
2. Добавьте в колбу с неизвестной кислотой 2 – 3 капли фенолфталеина.
3. Установите уровень раствора NaOH в бюретке на нулевую отметку, доливая раствор щелочив бюретку через воронку.
4. Оттитруйте раствор неизвестной кислоты раствором NaOH, концентрацию которого определили в опыте 1.
Раствор NaOH приливать по каплям, тщательно перемешивая раствор в колбе до перехода бесцветной окраски в неисчезающую слаборозовую.
5. Определите по бюретке объем раствора NaOH, пошедший на титрование.
Результаты опыта 2 записать в следующей форме:
1. Масса неизвестной кислоты m(к) = …г
2. Молярная концентрация эквивалентов раствора NaOH Сэк(NaOH) = …моль-эк/л
3.Объем раствора NaOH, пошедший на титрование V(NaOH) = … см3
Расчет Mэк неизвестной кислоты
1. Согласно закону эквивалентов nэк(NaOH) = nэк(кислоты).
2. Зная m(кислоты), Сэк(NaOH) и V(NaOH) количество вещества эквивалентов можно рассчитать, используя выражения (47) и (45):
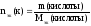 (54)
(54)
nэк(NaOH) = Cэк(NaOH) · V(NaOH) (55)
3. Записать закон эквивалентов, с учетом п.2
Cэк(NaOH)
· V(NaOH)
=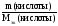 (56)
(56)
4. Из уравнения (56) выразить Мэк(кислоты), подставить соответствующие значения и рассчитать Мэк неизвестной кислоты. V(NaOH) должен быть выражен в литрах.
5. Рассчитать Мэк приведенных кислот в таблице 8.
Таблица 8.
|
Кислота |
HCl |
HNO3 |
H2SO4 |
H3PO4 |
|
M, г/моль |
36,5 |
63,0 |
98,0 |
98,0 |
|
Z(В) |
|
|
|
|
|
Мэк(В) |
|
|
|
|
6.Сравните экспериментально полученное значение Мэк(кислоты) с рассчитанными значениями Мэк кислот в п. 5 и сделайте вывод о природе неизвестной кислоты.
Вопросы к защите лабораторной работы №2.
1. Как рассчитывается эквивалентное число сложного вещества в обменных реакциях?
2. Рассчитайте Z(В) и Мэк(В) подчеркнутых веществ в следующих обменных реакциях:
а) FeCl3 + 2KOH = Fe(OH)2Cl + 2KCl
б) Na2HPO4 + NaOH = Na3PO4 + H2O
в) Cr2(SO4)3 + 6KOH = 2Cr(OH)3 + 3K2SO4
г) Al(OH)2Cl + HCl = AlOHCl2 +H2O
3. Молярная концентрация эквивалентов вещества. Определение, обозначение, единицы измерения.
4. В чем состоит сущность метода титрования?
5. На основании какого закона производят расчеты по результатам титрования? Приведите его возможные математические выражения.
6. Как устанавливают точку эквивалентности при титровании?
7. Как по показаниям бюретки производят определение объема, вылитого из неё раствора?
8. Какая масса Na2CO3 содержится в 200 см3 0,1 н раствора?
9. Вычислите молярную концентрацию раствора гидрокарбоната натрия NaHCO3, зная, что на титрование 30 см3 этого раствора израсходовано 25 см3 раствора HCl, молярная концентрация которого равна 0,08 моль-эк/л.
10. Какой объем 0,1 н раствора HCl пойдет на титрование 20 см3 раствора KOH, содержащего 0,056 г KOH?
11. Какая масса H2SO4 содержится в 1 литре раствора, если на титрование 25 см3 раствора этой кислоты израсходовано 30см3 0,2 н раствора NaOH?
12.Какой объем 0,3 н раствора H2SO4 необходимо иметь, чтобы приготовить 2 литра 0,05 н раствора этой кислоты?
13. В растворе объемом 250 см3 содержится 3,2 г H3PO4. Какова молярная концентрация эквивалентов этого раствора.
14. Какая масса K2CO3 содержится в растворе объемом 0,5 л, если его молярная концентрация эквивалентов равна 0,2 моль-эк/л?
