
- •Эквивалент вещества
- •Теоретическая часть.
- •1.Эквивалент вещества. Эквивалентное число.
- •2. Расчет z(в) в окислительно-восстановительных реакциях.
- •3. Расчет z(в) в обменных реакциях.
- •4. Молярная масса и молярный объем эквивалентов вещества.
- •5. Количество вещества эквивалентов.
- •6. Закон эквивалентов.
- •7. Закон эквивалентов для реакций, протекающих в растворах.
- •Лабораторная работа №1 Определение молярной массы эквивалентов простого вещества.
- •Последовательность выполнения эксперимента.
- •Расчет экспериментального значения молярной массы эквивалентов алюминия и ошибки эксперимента.
- •Вопросы к защите лабораторной работы №1.
- •Лабораторная работа №2. Определение молярной массы сложного вещества.
- •Результаты опыта 1 записать в следующей форме:
- •Расчет Сэк(NaOh)
- •Результаты опыта 2 записать в следующей форме:
- •Расчет Mэк неизвестной кислоты
- •Вопросы к защите лабораторной работы №2.
3. Расчет z(в) в обменных реакциях.
В реакциях обмена степени окисления атомов не изменяются и каждый из ионов сохраняет свой заряд. В таких реакциях происходит замещение одних ионов на другие.
Например, в реакции
H3PO4 + 2KOH = K2HPO4 + 2H2O (11)
в одной формульной единице H3PO4 заместилось два иона водорода, т.к. продуктом замещения является K2HPO4.
В обменных реакциях эквивалентное число по величине равно суммарному заряду замещающихся (обменивающихся) ионов в одной формульной единице данного вещества.
Z(В) = Ni · |qi|, (12)
где Ni – число заместившихся ионов в одной ФЕ вещества;
|qi| - абсолютное значение заряда заместившихся ионов.
Так
в реакции (11) в H3PO4
замещается водород, для которого
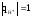 ,
аZ(H3PO4)
= 2∙1=2, т.к. заместилось два атома водорода.
,
аZ(H3PO4)
= 2∙1=2, т.к. заместилось два атома водорода.
Рассчитаем эквивалентные числа карбоната натрия Na2CO3 в реакциях (13) и (15).
В реакции
Na2CO3 + HCl = NaHCO3 + NaCl (13)
Z(Na2CO3) = 1, т.к. в одной формульной единице Na2CO3 замещается один ион натрия, заряд которого равен +1.
Z(Na2CO3)
=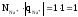 (14)
(14)
В реакции
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (15)
Z(Na2CO3) = 2, т.к. в одной формульной единице Na2CO3 замещаются два иона натрия, суммарный заряд которых по величине равен двум
Z(Na2CO3)
=
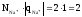 (16)
(16)
Таким образом, в реакциях (13) и (15) карбонат натрия имеет разные значения Z(Na2CO3).
Расчет Z(В) в обменных реакциях можно вести как по положительной так и по отрицательной части молекулы сложного вещества, что показано на примере реакции (17) (см. табл. 3).
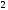
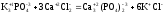 (17)
(17)
Таблица 3
|
ФЕ |
Замещающиеся частицы |
Ni |
qi |
Z(B) |
Э(В) |
|
K3PO4 |
K+ |
3 |
+1 |
3·1=3 |
|
|
|
1 |
–3 |
1·3=3 | ||
|
CaCl2 |
Ca+2 |
1 |
+2 |
1·2=2 |
|
|
Cl– |
2 |
–1 |
2·1=2 | ||
|
Ca3(PO4)2 |
Ca+2 |
3 |
+2 |
3·2=6 |
|
|
|
2 |
–3 |
2·3=6 | ||
|
KCl |
K+ |
1 |
+1 |
1·1=1 |
KCl |
|
Cl– |
1 |
–1 |
1·1=1 |
4. Молярная масса и молярный объем эквивалентов вещества.
Единица количества вещества – моль. Один моль эквивалентов любого вещества содержит 6,02·1023 эквивалентов, так же как один моль любого вещества содержит 6,02·1023 формульных единиц этого вещества.
Массу одного моль эквивалентов вещества называют молярной массой эквивалентов вещества. Обозначение – Мэк(В), единицы измерения г/моль-эк.
Мэк(В) может быть рассчитана по формуле:
![]()
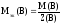 ,
(18)
,
(18)
где М(В) – молярная масса вещества, г/моль;
Z(В) – эквивалентное число вещества.
Наряду с понятием молярной массы эквивалентов используют понятие о молярном объеме эквивалентов газообразного вещества. Обозначение Vэк(В), единицы измерения л/моль-эк. Vэк(В) – это объем, который занимает один моль эквивалентов газообразного вещества при данных условиях, и он в Z раз меньше молярного объема газа.
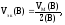 (19)
(19)
где Vм(В) – молярный объем газа, л/моль.
При нормальных условиях (н.у.: То = 273 К, ро = 1,013·105 Па) молярный объем любого идеального газа равен 22,4 л/моль, поэтому молярный объем эквивалентов газов в этих условиях вычисляют по уравнению:
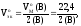 (20)
(20)
где
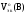 – молярный объем эквивалентов
газообразного вещества при н.у., л/моль-эк;
– молярный объем эквивалентов
газообразного вещества при н.у., л/моль-эк;
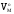 (В)
– молярный объем газа при н.у., л/моль.
(В)
– молярный объем газа при н.у., л/моль.
В
реакциях (3), (6) и (8) были определены
значения Z(H2)
и Z(O2),
зная которые можно рассчитать Мэк и
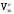 этих веществ и в дальнейшем использовать
при решении задач, как табличные величины.
этих веществ и в дальнейшем использовать
при решении задач, как табличные величины.
Таблица 4
|
Вещество |
ФЕ |
Z(В) |
М(В), г/моль |
Мэк(В), г/моль-эк |
|
|
Водород |
H2 |
2 |
2 |
1 |
11,2 |
|
Кислород |
O2 |
4 |
32 |
8 |
5,6 |
