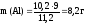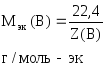- •Эквивалент вещества
- •Теоретическая часть.
- •1.Эквивалент вещества. Эквивалентное число.
- •2. Расчет z(в) в окислительно-восстановительных реакциях.
- •3. Расчет z(в) в обменных реакциях.
- •4. Молярная масса и молярный объем эквивалентов вещества.
- •5. Количество вещества эквивалентов.
- •6. Закон эквивалентов.
- •7. Закон эквивалентов для реакций, протекающих в растворах.
- •Лабораторная работа №1 Определение молярной массы эквивалентов простого вещества.
- •Последовательность выполнения эксперимента.
- •Расчет экспериментального значения молярной массы эквивалентов алюминия и ошибки эксперимента.
- •Вопросы к защите лабораторной работы №1.
- •Лабораторная работа №2. Определение молярной массы сложного вещества.
- •Результаты опыта 1 записать в следующей форме:
- •Расчет Сэк(NaOh)
- •Результаты опыта 2 записать в следующей форме:
- •Расчет Mэк неизвестной кислоты
- •Вопросы к защите лабораторной работы №2.
5. Количество вещества эквивалентов.
Обозначение nэк(В), единицы измерения моль-эк. Если известна масса вещества и молярная масса эквивалентов, то количество вещества эквивалентов рассчитывают по формуле:
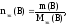 (21)
(21)
где m(В) – масса вещества, г;
Мэк(В) – молярная масса эквивалентов вещества, г/моль-эк.
Для газообразных веществ можно рассчитать nэк(В), зная объем газа, который он имеет при н.у.:
 (22)
(22)
где Vo(В) – объем газа при н.у., л;
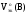 –молярный
объем эквивалентов газа при н.у., л/моль-эк
–молярный
объем эквивалентов газа при н.у., л/моль-эк
Между количеством вещества эквивалентов nэк(В) и количеством вещества n(В) существует простая зависимость :
nэк(В) = n(В) · Z(В) (23)
Пример.
Рассчитать Z(В),
Мэк(В) всех веществ, принимающих участие
в реакциях а) и б), а так же
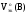 газообразных веществ в реакции а).
газообразных веществ в реакции а).
а) Fe2O3 (т) + 3CO(г) = 2Fe(т) + 3CO2(г)
б) Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4
Решение. Прежде всего необходимо определить к какому типу реакций (обменная или окислительно - восстановительная) относится данная реакция, для чего рассчитывают степени окисления атомов или групп атомов в формульных единицах всех веществ.
Реакция а)
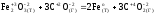
является окислительно-восстановительной.
Находим атомы, которые изменяют степени окисления, и выписываем их, с учетом числа в составе одной формульной единицы и числа отданных и принятых электронов:
а) для реагентов
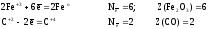
б) для продуктов
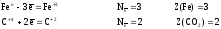
Расчеты всех величин приведены в таблице 5.
Таблица 5
|
ФЕ |
|
Z(B) |
M(B), г/моль |
|
|
|
Fe2O3 |
6 |
6 |
160,0 |
26,7 |
- |
|
CO |
2 |
2 |
28,0 |
14,0 |
11,2 |
|
Fe |
3 |
3 |
56,0 |
18,7 |
- |
|
CO2 |
2 |
2 |
44,0 |
22,0 |
11,2 |
Реакция б)

является обменной, т.к. степени окисления атомов и групп атомов в ходе реакции не изменяются. Далее необходимо выбрать те части формульных единиц (положительно или отрицательно заряженных) по которым будет производится расчет суммарного заряда замещающихся ионов, а далее – Z(B) и Мэк(В). Расчеты приведены в таблице 6.
Таблица 6.
|
ФЕ |
Замещаю- щиеся ионы |
qi |
Ni |
Z(В)= Ni·│qi│ |
М(В), г/моль |
|
|
Al2(SO4)3 |
SO4–2 |
–2 |
3 |
3·2=6 |
342,0 |
57,0 |
|
NaOH |
Na+ |
+1 |
1 |
1·1=1 |
40,0 |
40,0 |
|
Al(OH)3 |
OH– |
–1 |
3 |
3·1=3 |
78,0 |
26,0 |
|
Na2SO4 |
Na+ |
+1 |
2 |
2·1=2 |
142,0 |
71,0 |
6. Закон эквивалентов.
Согласно закону эквивалентов все вещества реагируют и образуются в эквивалентных количествах.
Например, для реакции
2CO + O2 = 2CO2 (24)
nэк(CO) = nэк(O2)=nэк(CO2) (25)
Для реакции в общем виде:
nAA + nBB = nCC + nDD , (26)
где A,B – реагенты;
C,D – продукты реакции;
nA,nB,nC,nD – стехиометрические коэффициенты,
закон эквивалентов имеет вид:
nэк(A) = nэк(B) = nэк(C) = nэк(D) (27)
Т.е. количество вещества эквивалентов всех участвующих в реакции (26) веществ (реагентов А и В и образовавшихся продуктов C и D) одинаковы. Поэтому, если количество вещества эквивалентов одного из веществ (реагента или продукта) известно по условию задачи, то определены и nэк всех остальных веществ, участвующих в реакции, и необходимость их расчета отпадает. В этом состоит преимущество проведения расчетов по закону эквивалентов.
Для любой химической реакции (см. уравнение реакции в общем виде (26)) соблюдается условие (27), которое также может быть представлено следующим образом:
n(А) · Z(A)= n(В) · Z(B)= n(С) · Z(C)= n(D) · Z(D) (28)
Условие (28) упрощает определение эквивалентного числа в сложных реакциях.
Пример. Определить Z(Cr2(SO4)3) в обменной реакции, выраженной уравнением
Cr2(SO4)3 + 12KOH = 2K3[Cr(OH)6] + 3K2SO4
Решение. Для приведенной реакции запишем условие (28):
n( Cr2(SO4)3) · Z(Cr2(SO4)3)= n( KOH) · Z(KOH)
Из уравнения реакции:
n( Cr2(SO4)3) = 1 n(KOH) = 12
Поскольку Z(KOH) = 1 (не может быть другим, см. табл. 2), то
![]()
![]()
Если известны массы веществ, участвующих в реакции, то используя уравнения (21) и (27) можно записать:
![]() (29)
(29)
или
![]() (30)
(30)
Уравнение (30) является математическим выражением закона эквивалентов.
Если одно из веществ уравнения (26), например B, находится в газообразном состоянии и известен его объем при н.у., то количество вещества эквивалентов этого газа можно рассчитать по уравнению (22), а математическая запись закона эквивалентов для веществ A и B будет иметь вид:
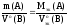 (31)
(31)
Пример. Рассчитать массу алюминия, вступившего в реакцию с разбавленной серной кислотой, если в результате реакции образуется 10,2 л водорода (н.у.).
Решение. Запишем уравнение реакции и укажем степени окисления атомов и заряды ионов:
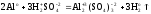
Реакция окислительно-восстановительная. Находим атомы, которые изменяют степени окисления, и выписываем их, с учетом числа в составе одной формульной единицы и числа отданных и принятых электронов:
Alo
–
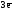 =
Al+3
=
Al+3  Z(Al) = 3
Z(Al) = 3
H2o
–
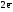 =
2H+1
=
2H+1 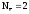 Z(H2)
= 2
Z(H2)
= 2
Согласно закону эквивалентов:
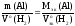 .
.
Отсюда выражаем массу алюмиия:
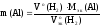
Рассчитаем
Мэк(Al)
и
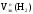 :
:

Подставив
полученные значения Мэк(Al)
и
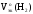 ,
а так жеVo(H2),
рассчитаем массу алюминия:
,
а так жеVo(H2),
рассчитаем массу алюминия: