- •Обмен белков и аминокислот Курс лекций для студентов специальности
- •«Биологическая химия»
- •Обмен белков и аминокислот
- •Азотофиксация. Нитрогеназа
- •Реакции биосинтеза аминокислот
- •3. Превращение одной аминокислоты в другую.
- •4. Прямое аминирование фумаровой кислоты.
- •Восстановительное аминирование-кетокислот
- •Трансаминирование кислот
- •Взаимопревращения аминокислот
- •Прямое аминирование фумаровой кислоты
- •Синтез незаменимых аминокислот
- •Биосинтез белка
- •Синтез днк – репликация
- •Синтез рнк – транскрипция
- •Биологический код
- •Биосинтез белков – трансляция
- •Понятие о мутациях
- •Переваривание белков
- •Биологическая ценность белков
- •Катаболизм аминокислот
- •Дезаминирование аминокислот
- •Декарбоксилирование аминокислот
- •Обезвреживание аммиака и биогенных аминов
- •Орнитиновый цикл мочевинообразования
- •Список используемой литературы
Катаболизм аминокислот
Аминокислоты, образовавшиеся в результате распада белков (гидролиз белков пищи, гидролиз тканевых белков), или синтезированные в организме, могут подвергаться различным превращениям. Их роль в организме определяется тем, что они служат строительными блоками для биосинтеза белков, а избыточные аминокислоты подвергаются расщеплению.
Общие пути обмена аминокислот можно представить в виде следующей схемы:
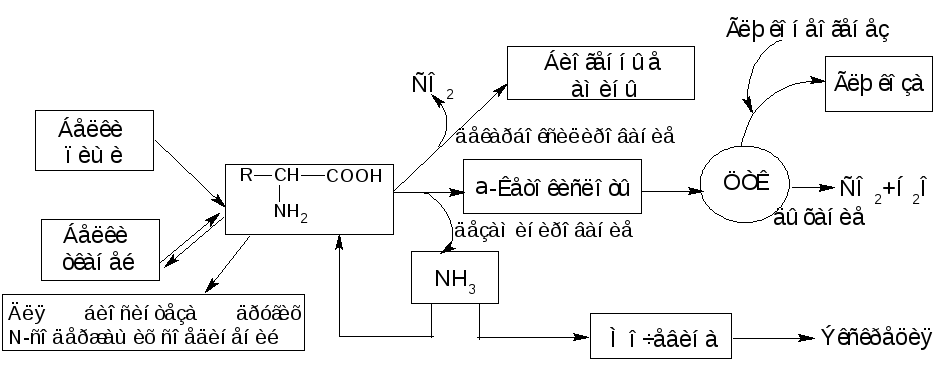
Дезаминирование аминокислот
При дезаминировании аминокислот NН2-группа освобождается в виде аммиака. Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты, кетокислоты.
Доказано существование 4 типов дезаминирования аминокислот.
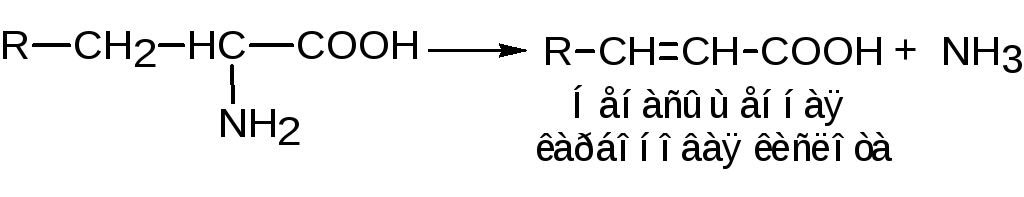
Внутримолекулярное дезаминирование:
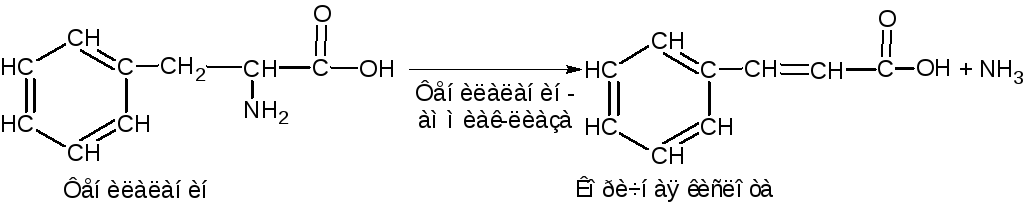
Например, в высших растениях содержится фермент фенилаланин-аммиак-лиаза, который отщепляет аммиак от фенилаланина с образованием коричной кислоты:
2. Восстановительное дезаминирование:

3. Гидролитическое дезаминирование:

4. Окислительное дезаминирование:
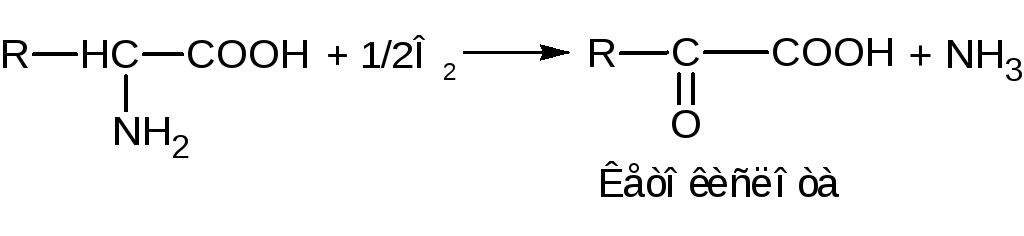
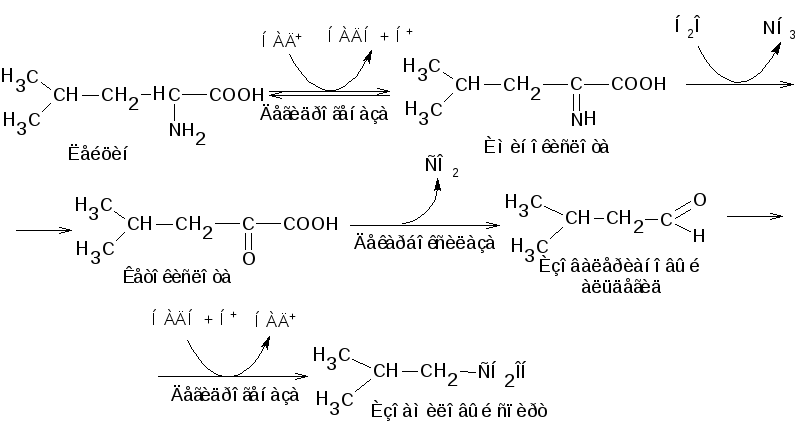
Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим является окислительное дезаминирование.
Окислительное дезаминирование аминокислот протекает в две стадии. Сначала аминокислота окисляется в иминокислоту при участии специфической дегидрогиназы с НАД+ или НАДФ+ в качестве кофермента и акцептора водорода. Затем иминокислота спонтанно гидролизуется на кетокислоту и аммиак:

В некоторых случаях дегидрогиназы аминокислот представлены флавопротеинами, т.е. содержат в качестве кофактора ФАД или ФМН.
В растениях дезаминирование аминокислот может осуществляться при участии полифенолоксидазы по следующей схеме:
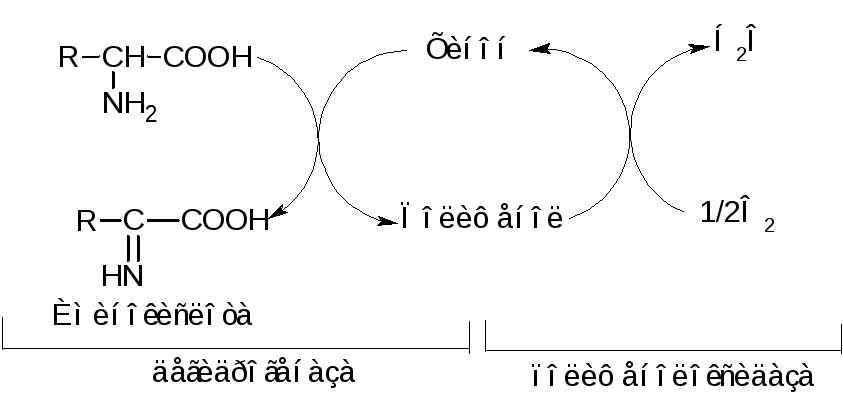
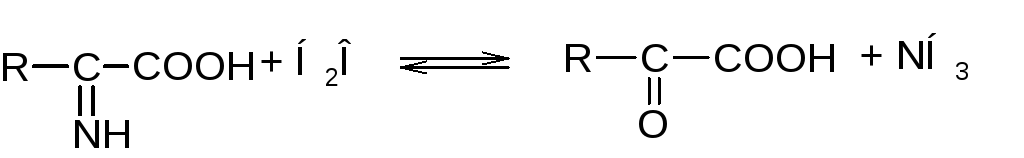
Дегидрогеназа, отнимая от аминокислоты водород, передает его хинону, который при этом превращается в полифенол. Полифенол снова окисляется полифенолоксидазой с образованием воды и хинона, который опять может вступать в реакцию. Иминокислота, присоединяя воду, дает кетокислоту и аммиак.
Окислительное дезаминирование аминокислот имеет большое положительное значение в ряде бродильных производств, основанных на использовании спиртового брожения. Именно в результате дезаминирования образуется целый ряд побочных продуктов спиртового брожения, оказывающих большое влияние на качество готовой продукции – спирта, вина, пива. При дезаминировании аминокислот дрожжами образуются кетокислоты, которые подвергаются в дальнейшем окислительно-восстановительным превращениям, в результате которых образуются так называемые сивушные масла – смесь различных одноатомных спиртов, – придающие неприятный запах и привкус этиловому спирту, вину или пиву. Так, лейцин в ходе последовательных реакций дезаминирования, декарбоксилирования и восстановления превращается в изоамиловый спирт.
Универсальными для всех живых организмов являются реакции расщепления аминокислот, в которых не происходит прямого выделения аммиака, в то время как аминогруппа от аминокислоты переносится на -кетокислоту. Эти реакции называют реакциями трансаминирования и протекают они при участии ферментов аминотрансфераз. Подробно – смотри реакции синтеза аминокислот (см. п.2).