
- •Обмен белков и аминокислот Курс лекций для студентов специальности
- •«Биологическая химия»
- •Обмен белков и аминокислот
- •Азотофиксация. Нитрогеназа
- •Реакции биосинтеза аминокислот
- •3. Превращение одной аминокислоты в другую.
- •4. Прямое аминирование фумаровой кислоты.
- •Восстановительное аминирование-кетокислот
- •Трансаминирование кислот
- •Взаимопревращения аминокислот
- •Прямое аминирование фумаровой кислоты
- •Синтез незаменимых аминокислот
- •Биосинтез белка
- •Синтез днк – репликация
- •Синтез рнк – транскрипция
- •Биологический код
- •Биосинтез белков – трансляция
- •Понятие о мутациях
- •Переваривание белков
- •Биологическая ценность белков
- •Катаболизм аминокислот
- •Дезаминирование аминокислот
- •Декарбоксилирование аминокислот
- •Обезвреживание аммиака и биогенных аминов
- •Орнитиновый цикл мочевинообразования
- •Список используемой литературы
Азотофиксация. Нитрогеназа
Превращение молекулярного азота атмосферы в аммиак осуществляется азотфиксирующими бактериями. Некоторые из этих микроорганизмов, а именно бактерии Rhizobium, проникают из почвы в корневую систему растений, главным образом зернобобовых культур (соя, горох, фасоль, люцерна), образуют на корнях клубеньки, в которых и происходит связывание атмосферного азота. Эти бактерии находятся в симбиозе с растениями. Они питаются органическими веществами, доставляемыми растениями, а сами снабжают растение азотными соединениями, поэтому зернобобовые растения не нуждаются в азотных удобрениях. Атмосферный азот могут усваивать и некоторые свободно живущие в почве микроорганизмы, например анаэробные бактерии Clostridium и аэробные, принадлежащие к роду Asotobacter. Превращение молекулярного азота в аммиак представляет собой сложный ферментативный процесс. Ферментная система, участвующая в фиксации атмосферного азота, называется нитрогеназой. Нитрогеназный комплекс состоит из белковых компонентов двух типов:
– белок 1 – молибдоферредоксин (Мо – Fe – протеин), или собственно нитрогеназа, содержащая четыре идентичные субъединицы, в каждую из которых входят два атома молибдена, негеминовое железо, лабильный сульфид;
– белок 2 – азоферредоксин, или редуктазный компонент (Fe – белок) является димером, содержит негеминовое железо и лабильный сульфид.
Нитрогеназный комплекс представляет собой ассоциацию двух димерных молекул белка 2 с одним тетрамером белка 1.
Восстановление молекулярного азота до NH3 идет в три этапа по схеме:

Для восстановления N2 в NH3 требуется 6 электронов и 6 протонов источником которых должен быть мощный восстановитель. Донором водорода для нитрогеназного комплекса является НАДФН+Н+. Для фиксации азота требуется также энергия в виде АТФ. На каждый перенесенный электрон затрачивается 1 молекула АТФ. Электроны переносятся к белкам нитрогеназы двумя различными типами белков – переносчиков электронов: ферредоксином (Fe –S белок) и флаводоксином (ФМН – содержащий белок).
Превращение азота в аммиак можно представить следующей схемой:
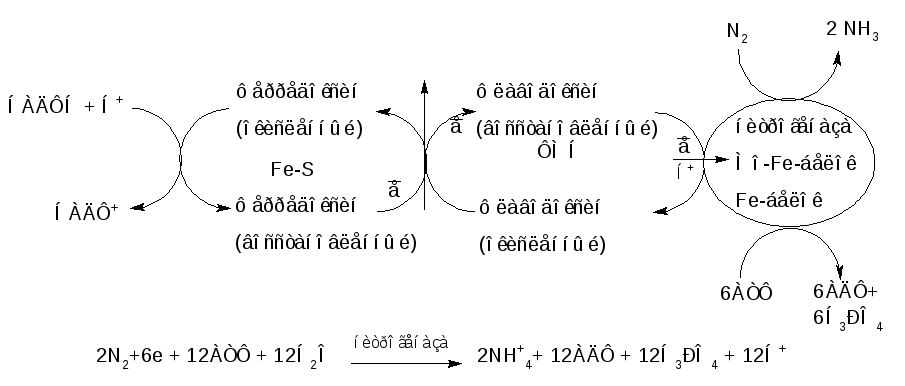 Наконец,
N2
связывается с белком 1 и восстанавливается
до NH3
– продукт фиксации азота микроорганизмами
NH3
может прямо
использоваться растениями для всех
азотосодержащих органических соединений.
Наконец,
N2
связывается с белком 1 и восстанавливается
до NH3
– продукт фиксации азота микроорганизмами
NH3
может прямо
использоваться растениями для всех
азотосодержащих органических соединений.
Реакции биосинтеза аминокислот
В синтезе аминокислот источником азота служит аммиак, источником углерода являются промежуточные продукты цикла трикарбоновых кислот, гликолиза, гексозомонофосфатного цикла, цикла Кальвина.
Существуют следующие основные пути синтеза заменимых аминокислот.
1. Восстановительное аминирование -кетокислот: по этому пути неорганический азот (NH3) превращается в органический – входит в состав аминокислот.
2. Трансаминирование – перенос аминогруппы от аминокислоты – донора этих групп – к -кетокислоте – акцептору групп.
3. Превращение одной аминокислоты в другую.
4. Прямое аминирование фумаровой кислоты.
Восстановительное аминирование-кетокислот
В ассимиляции аммиака особая роль отводится промежуточному продукту ЦТК – -кетоглутаровой кислоте. Под действием фермента глутаматдегидрогеназы, локализованной в матриксе митохондрий, из NH3 и -кетоглутаровой кислоты синтезируется глутаминовая кислота (Глу), в качестве восстановителя используется НАДФН + Н+. Реакция протекает в две стадии через образование иминокислоты:
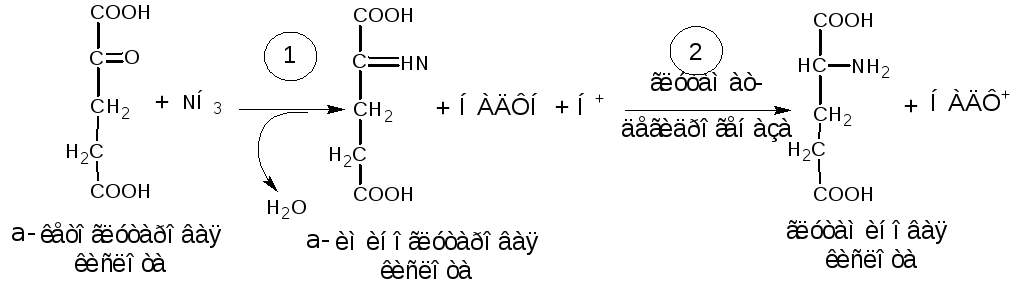
Суммарную реакцию восстановительного аминирования можно записать в следующем виде:
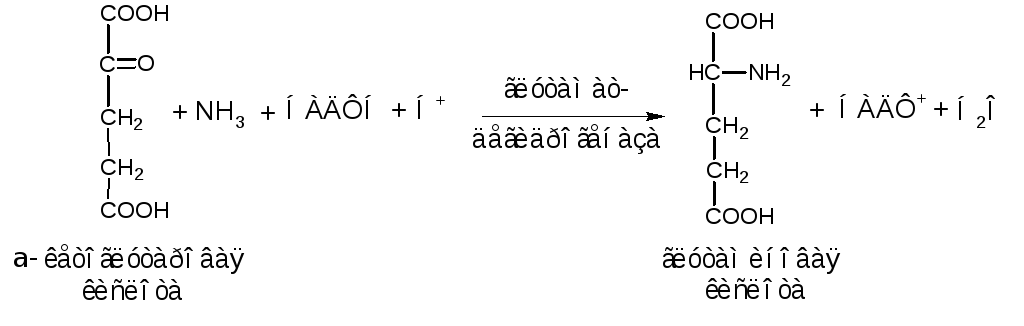
Эта реакция имеет фундаментальное значение в азотистом обмене растений, микроорганизмов, человека и животных.
Глутаминовая кислота является донором аминогрупп при биосинтезе всех белковых аминокислот. Она же – предшественник синтеза пролина и оксипролина и второго важного соединения, участвующего в ассимиляции NH3, – глутамина (Глн).
Глутамин служит затем источником азота в биосинтезе биомолекул, наиболее важными из которых являются пиримидины и пурины.
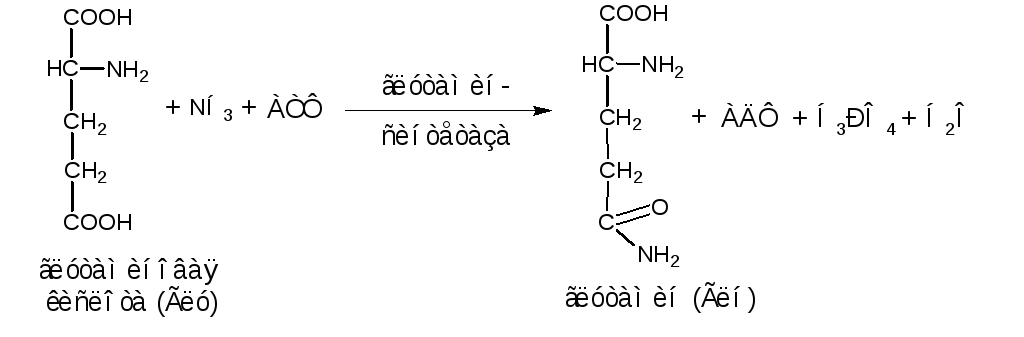
У многих бактерий аспарагиновая кислота служит предшественником амида аспарагиновой кислоты (Асн) в реакции, катализируемой аспарагинсинтетазой:

Глутаматдегидрогеназа и глутаминсинтетаза являются весьма активными ферментами и препятствуют накоплению токсичного аммиака в живой клетке в повышенных концентрациях, переводя его в связанную органическую форму – глутаминовую кислоту и глутамин.
