
- •Могилевский государственный
- •Краткая история развития учения о ферментах
- •Общие свойства ферментов и химических катализаторов небелковой природы
- •Отличительные признаки ферментативного и химического катализа
- •Строение ферментов
- •Механизм действия ферментов
- •Единицы ферментативной активности
- •Специфичность ферментов
- •Термолабильность ферментов
- •Влияние кислотности среды
- •Концентрация фермента
- •Концентрация субстрата
- •V–скорость реакции
- •Активаторы и ингибиторы ферментов
- •Аллостерические ферменты
- •Изоферменты
- •Классификация и номенклатура ферментов
- •Использование ферментных препаратов
- •Иммобилизованные ферменты
- •Витамины
- •Классификация витаминов
- •Жирорастворимые витамины
- •Витамины группы а
- •20.2 Витамины группы d (кальциферол)
- •20.3 Витамины группы е
- •20.4 Витамины группы к
- •21 Водорастворимые витамины
- •21.1 Общая характеристика витаминов группы b
- •21.1.1 Витамин b1 (тиамин; антиневритный)
- •21.1.2 Витамин b2 (рибофлавин)
- •21.1.3 Витамин b3 (пантотеновая кислота)
- •21.1.4 Витамин b6
- •21.1.5 Витамин b12
- •21.2 Витамин рp (ниацин)
- •21.3 Витамин c
- •21.4 Биотин (витамин h)
- •21.5 Витамин p (Цитрин)
- •21.6 Фолиевая кислота. Витамин Bc птероилглутаминовая кислота
- •21.7 Витамин u
- •22 Витаминоподобные вещества
- •22.1 Парааминобензойная кислота
- •22.2 Витамин в15
- •22.3 Инозит
- •22.4 Холин
- •22.5 Антивитамины
- •Рекомендуемая литература
Термолабильность ферментов
Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Установлено, что скорость большинства химических реакций повышается в два-четыре раза при повышении температуры на 10°С и, наоборот, снижается в два раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента Q10. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Так, при температуре, не превышающей 45–50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса.
a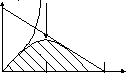 tопт
tопт
б
V
0 50 100 °C
а – повышение скорости реакции как функция температуры;
б – снижение скорости реакции как функция денатурации белка-фермента (стрелка указывает оптимум температуры)
Рисунок 2 – Зависимость скорости катализируемой ферментом реакции от температуры
Наибольшую активность ферменты проявляют в очень узком интервале температур где-то при 40-50°С для животных организмов и 40–60°С для растительных организмов, в этих условиях скорость реакции оказывается максимальной вследствие увеличения кинетической энергии реагирующих молекул. При низких температурах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля. Каждый фермент имеет свой температурный оптимум.
Следует отметить, что на термолабильность ферментов оказывают влияние время воздействия, концентрация субстрата, pHсреды, а также в каком состоянии находится фермент. В кристаллическом виде ферменты более термоустойчивы.
Влияние кислотности среды
Важнейшим фактором, влияющим на активность ферментов, является реакция среды. В клетке одновременно присутствуют сотни различных ферментов, и каждый фермент наиболее активен в определённом узком интервале pH, называемым оптимумомpH. ОптимумыpHотдельных ферментов различаются. Например, максимальная активность пепсина, катализирующего расщепление белка, наблюдается приpH1,5–2,0, а аргиназы, которая вызывает расщепление аминокислоты аргинина, – приpH9,5–9,9. С изменениемpHот оптимального значения в кислую или щелочную среду активность фермента снижается вначале медленно, а затем очень быстро, и часто такое инактивирование вскоре приобретает необратимый характер (рис. 3).
Оптимум pHдействия большинства ферментов лежит в слабокислой или нейтральной реакции среды.
Таблица 2 – Оптимальные значения pHдля некоторых ферментов
|
Фермент |
pH |
Фермент |
pH |
|
Амилаза из солода |
4,9 – 5,2 |
Катепсин B |
4,5 – 5,0 |
|
Амилаза слюны |
6,8 – 7,0 |
Папаин |
5,0 |
|
Липаза |
7,0 – 8,5 |
Уреаза |
7,3 – 7,9 |
pHопт
V
pH
V– скорость реакции
Рисунок 3 – Зависимость скорости биохимической реакции от pHсреды
Согласно современным представлениям, влияние изменений pHсреды на молекулу фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности,COOH-группы дикарбоновых аминокислот,SH-группы цистеина,NH2-группы лизина и т.д.). При резких сдвигах от оптимумаpHсреды ферменты могут подвергаться конформационным изменениям, приводящим к потере активности вследствие денатурации или изменения заряда молекулы фермента. При измененииpHнарушается оптимальное соотношение ионизируемых и не ионизируемых групп (соответствующее наибольшей активности фермента), что сказывается на третичной структуре белка и строении его активного центра. Кроме того, концентрация [H+] оказывает влияние на ионизацию субстрата и ионизацию кофактора, что также влияет на скорость течения реакции.
