
- •Глава IV. Физические основы термодинамики
- •§22. Термодинамический метод исследования систем. Исходные положения термодинамики
- •§23. Внутренняя энергия системы
- •§24. Работа и теплота
- •§25 Теплоемкость
- •§26. Первый закон термодинамики
- •§27. Применение первого закона термодинамики к основным термодинамическим процессам
- •27.1. Изохорический процесс
- •27.2. Изобарический процесс
- •27.3. Изотермический процесс
- •27.4. Адиабатический процесс
- •§28. Второй закон термодинамики
- •28.1. Обратимые и необратимые процессы
- •28.2. Второй закон термодинамики
- •28.3. Понятие энтропии
- •28.4. Тепловая машина. Коэффициент полезного действия
- •28.5. Цикл Карно
- •28.6. Границы применимости второго закона термодинамики
27.3. Изотермический процесс
Изотермическим процессом называется процесс, происходящий в системе с неизменной массой при постоянной температуре.
Примерами изотермического процесса являются процессы кипения, конденсации, плавления и кристаллизации химически чистых веществ, происходящие при постоянном внешнем давлении.
Работа, совершаемая газом в изотермическом процессе при переходе из состояния 1 в состояние 2, определится из (24.4) с учетом того, что из уравнения Клапейрона-Менделеева (14.1)
![]() ,
,
то есть
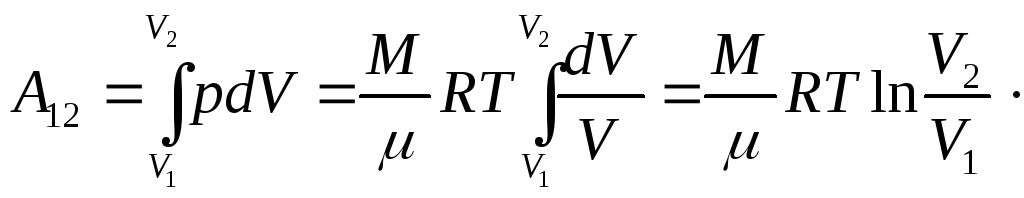 (27.24)
(27.24)
Так как в изотермическом процессе T=const и, следовательно, dT=0, то
![]() (27.25)
(27.25)
и
![]() , (27.26)
, (27.26)
то есть внутренняя энергия газа не изменяется.
Поэтому в изотермическом процессе, как следует из первого закона термодинамики (26.4), все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних тел, то есть
![]() (27.27)
(27.27)
или
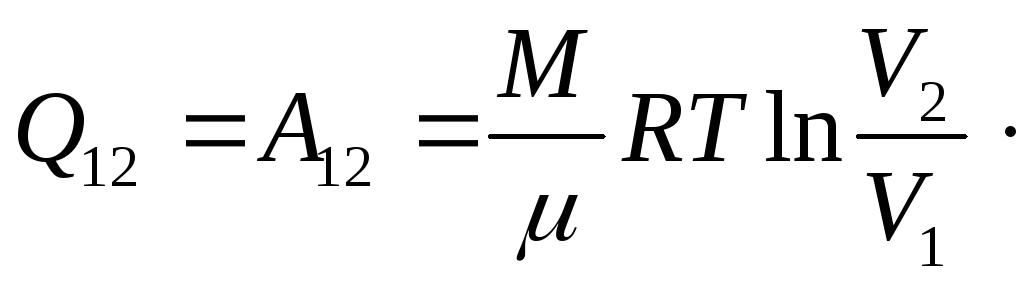 (27.28)
(27.28)
Теплоемкость идеального газа в изотермическом процессе бесконечно велика, так как Q 0, а dT = 0, поэтому
![]() . (27.29)
. (27.29)
При расширении газа Q > 0 и СT = +, а при сжатии Q < 0 и СT = -.
Бесконечная теплоемкость не является физическим абсурдом. Этот результат означает, что подводимая к газу теплота не приводит к изменению его температуры, так как она целиком расходуется на совершение газом работы.
Уравнение состояния идеального газа в изотермическом процессе выводится из уравнения Клапейрона-Менделеева при постоянных значениях величин T, M, , и R (закон Бойля-Мариотта):
![]() .
(27.30)
.
(27.30)
Линия, изображающая изотермический процесс и называемая изотермой, в координатных осях р и V имеет вид гиперболы (рис.27.3).
Рис.27.3

Как следует из (27.24), работа, совершаемая газом в изотермическом процессе, численно равна площади фигуры под соответствующим участком изотермы. Например, при изотермическом расширении газа (переход из состояния 1 в состояние 2 на рис. 27.3) эта работа численно равна площади фигуры 12V2V1.
27.4. Адиабатический процесс
Адиабатическим процессом называется процесс, происходящий в системе без теплообмена с внешней средой.
Адиабатический процесс подчиняется условию
![]() . (27.31)
. (27.31)
Отметим, что отсутствие теплообмена при адиабатическом процессе нельзя формулировать в виде условия
![]() . (27.32)
. (27.32)
В
самом деле, из равенства
![]() вовсе не следует, что на отдельных
участках рассматриваемого процесса
нет теплообмена между системой и внешней
средой. Оно означает лишь, что в целом
за весь процесс алгебраическая сумма
количества теплоты, подведенной к
системе и отведенной от нее, равна нулю.
вовсе не следует, что на отдельных
участках рассматриваемого процесса
нет теплообмена между системой и внешней
средой. Оно означает лишь, что в целом
за весь процесс алгебраическая сумма
количества теплоты, подведенной к
системе и отведенной от нее, равна нулю.
Практически адиабатический процесс может быть осуществлен в системе, окруженной теплоизолирующей оболочкой, или путем достаточно быстрого расширения, или сжатия газа, при которых теплообмен между газом и внешней средой не успевает произойти. Например, в двигателях внутреннего сгорания и при истечении газов через сопла реактивных двигателей процесс расширения газа протекает настолько быстро, что его можно считать практически адиабатическим.
Из первого закона термодинамики (26.4) с учетом условия (27.31) следует, что
![]() , (27.33)
, (27.33)
то есть в адиабатическом процессе работа совершается газом за счет убыли его внутренней энергии. Согласно выражениям (27.5) и (27.33)
![]() (27.34)
(27.34)
и
![]() . (27.35)
. (27.35)
Если газ адиабатически расширяется (dV>0), то A=pdV>0, следовательно, dU<0, то есть dT<0 - газ охлаждается. При адиабатическом сжатии (dV<0), А<0, dU>0 и, следовательно, dT>0, то есть газ нагревается.
Работу, совершаемую газом в адиабатическом процессе перехода из состояния 1 в состояние 2, найдем, интегрируя выражение (27.34):
![]() . (27.36)
. (27.36)
Следовательно,
![]() .
(27.37)
.
(27.37)
Поскольку в адиабатическом процессе нет теплообмена с внешними телами(Q=0), то в соответствии с (25.1) теплоемкость газа в этом процессе постоянна и равна нулю:
![]() . (27.38)
. (27.38)
Для вывода уравнения состояния идеального газа в адиабатическом процессе подставим в уравнение (26.4) первого закона термодинамики выражения (24.3), (27.31) и (27.34) для A, Q и dU:
![]() .
(27.39)
.
(27.39)
Выразим давление газа из уравнения Клапейрона-Менделеева (14.1):
![]()
и подставим его в (27.39), тогда получим уравнение
![]() . (27.40)
. (27.40)
Произведя интегрирование уравнения (27.40), получим
![]() , (27.41)
, (27.41)
откуда, потенцируя, получаем уравнение
![]() .
(27.42)
.
(27.42)
Для характеристики газов вводят величину , называемую показателем адиабаты:
 (27.43)
(27.43)
Из (27.43) и (27.21) находим, что
![]() ,
,
поэтому уравнение (27.42) принимает вид:
![]() .
(27.44)
.
(27.44)
Из этого уравнения следует, что адиабатическое изменение объема идеального газа влияет на его температуру.
Выражая температуру газа из уравнения Клапейрона-Менделеева
![]() ,
,
где /MR - постоянная для данной массы газа величина, и подставляя ее в (27.42), получим уравнение адиабаты в переменных P, V:
Рис.27.4.

![]() .
(27.45)
.
(27.45)
Это уравнение адиабаты идеального газа получило название уравнения Пуассона. Сплошная линия на рис. 27.4, изображающая адиабатический процесс, называется адиабатой.
Работа, совершаемая газом при адиабатическом изменении объема, числено равна площади фигуры под соответствующим участком адиабаты. В частности, при переходе из состояния 1 в состояние 2 (на рис.27.4 это соответствует адиабатическому расширению газа) газ совершает работу A12, равную площади фигуры 12V2V1.
Сравнивая
уравнения адиабаты (27.45) и изотермы
(27.30), приходим к выводу, что адиабата
(рис. 27.4) идет круче, чем изотерма (так
как
![]() ).
Объясняется это тем, что в отличие от
изотермического процесса адиабатическое
сжатие газа сопровождается повышением
температуры газа, а расширение - ее
понижением.
).
Объясняется это тем, что в отличие от
изотермического процесса адиабатическое
сжатие газа сопровождается повышением
температуры газа, а расширение - ее
понижением.
