
- •СОДЕРЖАНИЕ
- •РАЗДЕЛЫ КУРСА «ХИМИЯ»
- •ТЕМЫ ПРАКТИЧЕСКИХ ЗАНЯТИЙ
- •НАИМЕНОВАНИЯ ЛАБОРАТОРНЫХ РАБОТ
- •Пример
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Пример 1
- •Решение
- •Ответ:
- •Пример 2
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Пример 1
- •Решение
- •Ответ:
- •Пример 2
- •Решение
- •Пример
- •Решение
- •Индивидуальные задания
- •Гальванические элементы
- •Индивидуальные задания
- •Процессы электролиза
- •Катодные процессы
- •Анодные процессы
- •Пример 1
- •Решение
- •Ответ:
- •Пример 2
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Пример 1
- •Решение
- •Ответ
- •Пример 2
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Применение электрохимических процессов в технике
- •Индивидуальные задания
- •Химия конструкционных материалов
- •Химия металлов и сплавов
- •Элементарные и сложные полупроводники
- •Индивидуальные задания
- •ЛИТЕРАТУРА
- •ПРИЛОЖЕНИЕ
- •Термодинамические характеристики некоторых простых и сложных веществ
49
6. Процессы электролиза
Электрохимические системы, в которых электрическая энергия превращается в химическую, называются электролизными. Простейшая элек-
тролизная система состоит из электродов, электролита и источника постоянного тока. Электроды бывают инертные (графитовые или платиновые) и активные (из любого металла, кроме благородного). Электролиты — водные растворы
солей, кислот, оснований или расплавы указанных соединений, а также оксидов, гидридов и других соединений с ионным характером химической связи.
Электрод, подключенный к отрицательному полюсу источника тока, называется катодом, к положительному — анодом.
Количество веществ, выделившихся на электродах, разложившихся или вновь образовавшихся в электролите, рассчитывается по законам Фарадея.
1-й закон Фарадея:
|
|
|
|
m = kQ = kIτ или V = kIτ, |
(6.1) |
||||||||||||||||
где |
k — |
коэффициент пропорциональности, при этом k=m, если Q=1Кл; |
|
||||||||||||||||||
|
I — |
сила тока, A; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
τ — время прохождения тока, c; |
|
|
|
|
|
|
|
|||||||||||||
|
m (V) — массы (объемы) веществ, претерпевших превращения, г (л). |
|
|||||||||||||||||||
|
2-й закон Фарадея: одинаковые количества электричества преобразуют эк- |
||||||||||||||||||||
вивалентные количества веществ: |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
m |
|
Э |
|
V0 |
|
|
VЭ0(1) |
|
|
|||||||
|
|
|
|
|
|
1 |
= |
|
|
|
1 |
|
или |
1 |
= |
|
|
|
|
, |
(6.2) |
|
|
|
|
|
m |
|
|
Э |
|
|
0 |
V |
0 |
|
|||||||
|
|
|
|
|
2 |
|
|
2 |
|
|
V |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
Э(2) |
|
|
||||
где |
m1 и m2 |
( V0 и V0 ) — |
|
|
|
массы (объемы, н.у.) веществ, претерпевающих |
|||||||||||||||
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
превращения; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Э и Э |
2 |
( V0 |
и V0 |
) — эквивалентные массы (объемы, н.у.) веществ. |
|
|||||||||||||||
|
1 |
Э(1) |
Э(2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Из 2-го закона Фарадея следует |
|
|
|
|
|
|
|
|
||||||||||||
|
Q = F = 96500 А с = 26,8 А ч, |
m = Э |
или V0 = V0 . |
(6.3) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Э |
|
Отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Э |
|
|
|
|
|
|
V0 |
|
(6.4) |
||||
|
|
|
|
|
k = |
|
|
|
|
|
или |
k = |
|
|
Э |
, |
|
||||
|
|
|
|
|
F |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|||||
где k — электрохимический эквивалент, г/Кл или л/Кл.
50
Уравнение, объединяющее 1-й и 2-й законы Фарадея будет иметь вид
m = |
ЭIτ |
или V0 = |
VЭ0 |
Iτ. |
(6.5) |
|
F |
|
F |
|
|
Следует заметить, что массы веществ, практически полученных ( mпр ), всегда меньше рассчитанных по законам Фарадея ( mр ) или количество электричества, рассчитанное ( Qр ), меньше практически необходимого для электролиза ( Qпр ), что количественно характеризуется величиной выхода по току ( Вт ), при этом Вт <1:
Вт = |
mпр |
или Вт = |
Qр |
. |
(6.6) |
|
mр |
Qпр |
|||||
|
|
|
|
С учетом выхода по току уравнения (6.5) будут иметь вид:
m = |
Э Iτ Вт |
или V0 = |
VЭ0 |
Iτ Вт . |
(6.7) |
|
F |
|
F |
|
|
Одной из важнейших причин снижения выхода по току является поляризация электродов при прохождении тока. Накопление на них продуктов электролиза изменяет их природу и величину электродных потенциалов. Внутри элек-
тролизной системы возникает внутренний гальванический элемент, ЭДС которого направлена противоположно внешней ЭДС, тормозит анодно-
катодные процессы и называется ЭДС поляризации (Eполяр ). Для преодоления
поляризации необходимо дополнительное напряжение — перенапряжение на катоде (ηк) и на аноде (ηа). Численное значение η зависит от природы электродов, природы веществ, осаждаемых на их поверхности, от плотности тока (i = I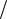 S ) и других факторов. При этом
S ) и других факторов. При этом
ηH2 >>ηMe , ηO2 >>ηCl2 . |
(6.8) |
С учетом вышесказанного ЭДС разложения электролита ( Eразл ) равна
Eразл = Eполяр +ηк +ηа . |
(6.9) |
Характер и скорость процессов электролиза (восстановления на катоде и окисления на аноде) зависят:
51
1)от активности частиц в электролите, численно определяемой величиной φ0 или φр . Чем больше значение φ, тем быстрее идет процесс восстановления на катоде; чем меньше φ, тем быстрее идет процесс окисления на аноде;
2)от концентрации частиц в электролите;
3)от величены перенапряжения η.
Катодные процессы
С учетом названных факторов (при сопоставимой концентрации) ряд напряжений металлов по восстановительной способности их ионов условно делится на три группы:
1) ионы металлов повышенной химической активности от Li до Al
включительно из водных растворов не восстанавливаются, а восстанавливается H2 по уравнениям:
2H+ +2e = H2 (pH < 7) или 2H2O +2e = H 2 +2OH− (pH ≥ 7) ; Вт (Me) = 0.
2) ионы металлов средней химической активности от Mn до H восстанавливаются вследствие большого перенапряжения H2 (ηH2 >> ηMe ). Частич-
ное выделение H2 снижает выход по току этих металлов. Электродные реакции имеют вид:
Men+ +ne = Me — основная реакция, 2H+ +2e = H2 (pH < 7) — побочная реакция,
Вт (Me) <100 % ;
3) ионы малоактивных металлов, стоящие в ряду напряжений после Н,
восcтанавливаются без участия водорода по уравнению
Men+ +ne = Me , Вт (Me) ≈100 % .
Анодные процессы
Характер анодных процессов зависит от природы электродов.
