
- •СОДЕРЖАНИЕ
- •РАЗДЕЛЫ КУРСА «ХИМИЯ»
- •ТЕМЫ ПРАКТИЧЕСКИХ ЗАНЯТИЙ
- •НАИМЕНОВАНИЯ ЛАБОРАТОРНЫХ РАБОТ
- •Пример
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Пример 1
- •Решение
- •Ответ:
- •Пример 2
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Пример 1
- •Решение
- •Ответ:
- •Пример 2
- •Решение
- •Пример
- •Решение
- •Индивидуальные задания
- •Гальванические элементы
- •Индивидуальные задания
- •Процессы электролиза
- •Катодные процессы
- •Анодные процессы
- •Пример 1
- •Решение
- •Ответ:
- •Пример 2
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Пример 1
- •Решение
- •Ответ
- •Пример 2
- •Решение
- •Ответ:
- •Индивидуальные задания
- •Применение электрохимических процессов в технике
- •Индивидуальные задания
- •Химия конструкционных материалов
- •Химия металлов и сплавов
- •Элементарные и сложные полупроводники
- •Индивидуальные задания
- •ЛИТЕРАТУРА
- •ПРИЛОЖЕНИЕ
- •Термодинамические характеристики некоторых простых и сложных веществ

17
Ответ:
∆Sпл = 42,2 Дж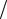 К.
К.
Пример 2
Вычислить изменение энтропии для реакции, протекающей по уравнению 2Н2S(г)+3О2(г) = 2SО2(г)+2Н2О(ж) при стандартном давлении ( P =101 кПа ) и T =500 K .
Решение
Для расчета изменения энтропии воспользуемся соотношением (2.6)
∆S5000 = ∆S0298 +∆C0P 298 ln 500298 .
Рассчитаем ∆S0298 , пользуясь выражением (2.2)
∆S0298 = 2SSO0 2 + 2S0H2O(æ) −2S0H2S(ã) −3SO0 2 .
Подставим значения стандартных энтропий веществ ( S0298 ), исходя из прил., табл. 1
∆S0298 = 2 248,07 +2 69,95 −2 205,7 −3 205,04 = −390,28 Дж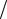 К.
К.
Рассчитаем изменение теплоемкости, пользуясь выражением (1.9) и справочными данными (прил., табл. 1).
∆C0P 298 = 2C0P SO2 + 2C0P H2O(æ) −2C0P H2S −3C0P O2 =
= 2 39,87 +2 75,30 −2 33,44 −3 29,37 = 74,95 Дж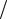 К.
К.
0 |
|
500 |
|
= −351,5 Дж К. |
Тогда ∆S500 |
= −300,28 +74,95 ln |
298 |
|
|
|
|
|
|
Ответ:
Изменение энтропии при 500 К для данной реакции равно
∆S5000 = −351,5 Дж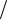 К.
К.
