
3 курс 1 часть / 0079436_7441E_eremin_v_v_kargov_s_i_uspenskaya
.pdfГ л а в а 1. Основы химической термодинамики |
27 |
1-10. Используя вириальные разложения (1.8), найдите связь между вириальными коэффициентами B2, B3 и B2', B3'.
1-11. Найдите критические параметры и приведенные уравнения состояния для газов:
а) Ван-дер-Ваальса; б) Бертло.
1-12. Предложено следующее уравнение состояния (для одного моля):
p = |
RT |
− |
B |
+ |
C |
. |
V |
V 2 |
|
||||
|
|
V 3 |
||||
Выразите критические параметры через постоянные B и C и найдите фактор сжимаемости pV/RT в критической точке.
1-13. При 250 K и 15 атм мольный объем газа на 12 процентов меньше величины, рассчитанной по уравнению состояния идеального газа. Рассчитайте:
а) фактор сжимаемости при этих условиях; б) мольный объем газа. Какие силы преобладают в этом случае –
притяжения или отталкивания?
1-14. В некотором промышленном процессе азот нагревают до температуры 500 K в реакторе постоянного объема 1.000 м3. Масса газа равна 92.4 кг. Используя уравнение Ван-дер-Ваальса, определите приблизительное давление газа в реакторе при рабочей температуре 500 K. Параметры уравнения Ван-дер-Ваальса см. в табл. П-1.
1-15. Плотность водяного пара при 327.6 атм и 776.4 K равна 133.2 г л–1: а) определите мольный объем воды, Vm, и фактор сжимаемости, Z; б) рассчитайте Z из уравнения Ван-дер-Ваальса. Параметры уравне-
ния Ван-дер-Ваальса см. в табл. П-1.
1-16. Предположим, что 10.0 моль C2H6 поместили в сосуд объемом 4.860 л при 27 °C. Оцените величину давления, создаваемого этаном, исходя из уравнения состояния:
а) идеального газа; б) газа Ван-дер-Ваальса.
Используя результаты расчетов, определите значение фактора сжимаемости. Параметры уравнения Ван-дер-Ваальса см. в табл. П-1.
1-17. Некоторый газ подчиняется уравнению состояния газа Ван-дер- Ваальса с a = 0.76 м6 Па моль–2. Объем газа равен 4.00 10–4 м3 моль–1 при 288 K и 4.0 МПа. Используя эти данные, рассчитайте значение параметра b в уравнении Ван-дер-Ваальса. Чему равен фактор сжимаемости этого газа при температуре 298 К и давлении 1 атм?
1-18. Критические объем и давление некоторого газа равны 160 см3 моль–1 и 40 атм соответственно. Оцените критическую темпе-

28 |
Г л а в а 1. Основы химической термодинамики |
ратуру, считая, что газ подчиняется уравнению состояния Бертло. Оцените радиус газообразной молекулы, если она имеет сферическую форму. (Параметр b в уравнении Бертло равен учетверенному собственному объему молекул).
1-19. |
Покажите, что уравнение Ван-дер-Ваальса приводит к Z < 1 и |
Z > 1, |
и укажите условия, при которых выполняются эти неравенства. |
§ 2. Первый закон термодинамики
Первый закон (первое начало) термодинамики – это фактически закон сохранения энергии. Он утверждает, что:
Существует аддитивная функция состояния термодинамической системы, называемая энергией, U. Энергия изолированной системы постоянна. В закрытой системе энергия может изменяться за счет:
а) совершения работы W над окружающей средой (или среды над системой);
б) обмена теплотой Q с окружающей средой.
(2.1.а) |
dU = δQ + δW (дифференциальная форма), |
(2.1.б) |
∆U = Q + W (интегральная форма). |
Буква δ в уравнении (2.1.а) отражает тот факт, что Q и W – функции перехода и их бесконечно малое изменение не является полным дифференциалом. В системе СИ размерность работы, теплоты и энергии – [Дж].
Согласно рекомендациям ИЮПАК, принято считать положительной теплоту, полученную системой, и работу, совершенную над ней. То есть действует «эгоистический» принцип: положительно то, что увели-
чивает внутреннюю энергию системы. Мы будем придерживаться именно этой системы знаков.1
Эквивалентность теплоты и работы установлена экспериментально. Первый закон справедлив для любых систем и процессов, но в случае открытых систем использовать его в форме уравнения (2.1.а) нельзя, так как в процессах, сопровождающихся переносом вещества от системы к окружению или обратно, наблюдаемые изменения энергии не удается разделить на теплоту и работу. Причиной этого является тот
1 В некоторых изданиях придерживаются другой системы знаков: работа считается положительной, если она совершается системой над окружающей средой.
Г л а в а 1. Основы химической термодинамики |
29 |
факт, что при внесении в систему некоторого количества вещества изменяется объем системы, т.е. совершается работа расширения (сжатия), и при этом вместе с веществом поступает некоторое количество связанной с ним энтропии.
Иногда для открытых систем первый закон записывают в виде:
dU = δQ + δW + ∑µi dni , |
(2.2) |
i |
|
где последняя сумма характеризует процесс обмена веществом между системой и окружением. Эту сумму условно называют «химической работой», имея в виду работу переноса вещества из окружения в систему. Функция µ получила название «химический потенциал» (подробно о химическом потенциале см. § 5, 6).
Энергия любой системы определяется с точностью до постоянной величины. Однако практического неудобства это не вызывает, так как результатом термодинамического процесса является изменение энергии, поэтому уровень отсчета можно выбрать условно. В общем случае энергия системы складывается из:
•кинетической энергии движения системы как целого;
•потенциальной энергии, обусловленной положением системы во внешнем силовом поле;
•внутренней энергии.
Обычно в химической термодинамике рассматриваются неподвиж-
ные системы в отсутствие внешних полей. В этом случае полная энергия системы равна ее внутренней энергии, которая является суммой
•кинетической энергии молекулярного движения;
•энергии межмолекулярных взаимодействий (притяжения и отталкивания составляющих систему частиц);
•энергии, эквивалентной массе покоя всех частиц согласно уравнению Эйнштейна;
•энергии излучения.
При термодинамическом описании систем рассматривают не все
виды энергии, а только некоторые из них. Так, при химической реакции не изменяется энергия взаимодействия нуклонов в ядрах, поэтому в качестве компонентов системы можно выбирать атомы химических элементов. Если же приходится учитывать ядерные превращения, то в качестве компонентов выбирают элементарные частицы. Внутренняя энергия неизменных структурных единиц принимается за условный уровень отсчета внутренней энергии и входит как константа во все термодинамические соотношения.
В отличие от внутренней энергии, теплота и работа не являются функциями состояния, их значения зависят от типа процесса. Работа – это упорядоченная форма передачи энергии, а теплота – неупорядоченная, связанная с хаотическим движением частиц.
30 |
Г л а в а 1. Основы химической термодинамики |
Работа
(2.3)
(2.4)
(2.5)
(2.6.а)
Работа W – форма передачи энергии от одного тела к другому, не связанная с переносом теплоты и (или) вещества. Существуют разные виды работы: механическая, электрическая, магнитная, изменения поверхности и др. Бесконечно малую работу любого вида можно представить как произведение обобщенной силы на изменение обобщенной координаты, например:
δWмех = – pdV |
механическая работа (работа расширения); |
δWэл = ϕdq |
работа переноса заряда; |
δWпов = σdΩ |
работа изменения площади поверхности; |
δWмагн = VHdМ |
работа намагничивания вещества; |
где ϕ – электрический потенциал, q – заряд, σ – поверхностное натяжение, Ω – площадь поверхности, H – напряженность магнитного поля, М – удельная намагниченность.
Понятие «обобщенный» подразумевает, что силы и координаты могут иметь произвольные размерности, но их произведение имеет размерность энергии.
Сумму всех видов работ за исключением механической работы называют полезной (немеханической) работой:
δWпол.= ϕdq + VHdМ + ∑µi dni +….
i
С учетом (2.3), дифференциальное выражение первого закона можно представить в виде:
dU = δQ – pdV + δWпол.
Механическую работу, производимую при расширении против внешнего давления pe, рассчитывают по формуле:
V2
W = – ∫ pe dV .
V1
Если процесс расширения обратим, то внешнее давление отличается от давления системы (например, газа) на бесконечно малую величину: pe = pi – δp и в формулу (2.5) можно подставлять давление внутри системы, которое определяется по уравнению состояния.
В адиабатическом процессе отсутствует теплообмен с окружающей средой (Q = 0, δQ = 0), поэтому работа может совершаться только за счет убыли внутренней энергии: W = ∆U. При обратимом адиабатическом расширении идеального газа давление и объем связаны соотноше-
нием (уравнением адиабаты):
pV γ = const.
где γ = Cp / CV, Cp и CV – изобарная и изохорная теплоемкости (см. далее).
Г л а в а 1. Основы химической термодинамики |
31 |
В уравнении (2.6.а) важны два момента: во-первых, это уравнение процесса, а не уравнение состояния; во-вторых, оно справедливо только для обратимого адиабатического процесса. Это же уравнение можно записать в эквивалентных формах:
TV γ–1 = const, |
(2.6.б) |
T γ p1–γ = const. |
(2.6.в) |
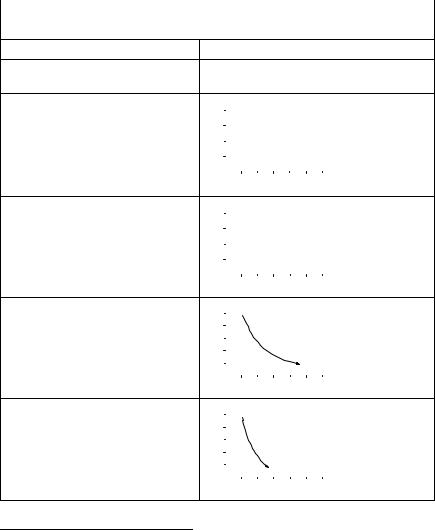
В табл. 2.1 приведены формулы для расчета работы, совершаемой идеальным газом в различных процессах. При обратимом процессе совершаемая работа всегда больше, чем при любом необратимом процессе между теми же состояниями.
Работа идеального газа в различных процессах |
|
Таблица 2.1 |
||
|
|
|
|
|
Процесс |
Графическое |
–W |
|
|
изображение процесса1 |
|
|
||
|
|
|
|
|
Расширение в вакуум
Расширение против постоянного внешнего давления pe
Изохорное обратимое расширение
p
Изобарное обратимое расширение
p
Изотермическое обратимое расширение
p
Адиабатическое обратимое расширение
p
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
pe(V2 – V1) |
||
|
|
|
1 |
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
p |
(V2 – V1) |
||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
nRT ln(V2/V1) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1V1 − p2V2 |
|
|
|
|
|
2 |
|
|
|
|
|
γ −1 |
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 Графики приведены только для обратимых процессов.

32 |
Г л а в а 1. Основы химической термодинамики |
Теплота. Калорические коэффициенты
(2.7)
(2.8.а)
(2.8.б)
(2.8.в)
(2.8.г)
(2.8.д)
(2.8.е)
(2.9)
Теплота Q – форма передачи энергии от более нагретого тела к менее нагретому, не связанная с переносом вещества и совершением работы. Зависимость теплоты от термодинамических переменных можно выразить с помощью уравнения (2.1.а), рассматривая внутреннюю энергию как функцию температуры и объема:
δQ = –δW + dU =
= |
|
∂U |
|
∂U |
|
∂U |
|
|
∂U |
|
pdV + |
|
dT + |
|
dV = |
|
dT + p + |
|
dV . |
||
|
|
∂T V |
|
∂V T |
|
∂T V |
|
|
∂V T |
|
Входящие в это уравнение частные производные называют калорическими коэффициентами системы, они характеризуют:
•теплоемкость системы при постоянном объеме (или изохорную теп-
лоемкость)
|
δQ |
|
∂U |
CV = |
|
= |
|
|
∂T V |
|
∂T V |
•и скрытую теплоту изотермического расширения
|
|
|
|
δQ |
|
∂U |
|
|
|
l = |
|
= p + |
. |
|
|
|
|
∂V T |
|
∂V T |
Помимо этих частных производных, к калорическим коэффициен- |
||||||
там системы относятся: |
|
|
|
|||
δQ |
|
|
|
|
|
|
C p = ∂T p |
– изобарная теплоемкость; |
|||||
h = δQ |
|
– скрытая теплота изотермического сжатия; |
||||
∂p |
T |
|
|
|
|
|
χ = δQ |
|
– скрытая теплота изобарного расширения; |
||||
∂V |
p |
|
|
|
|
|
λ = δQ |
|
– скрытая теплота изохорного сжатия. |
||||
∂p |
V |
|
|
|
|
|
Кроме изобарной и изохорной теплоемкостей в термодинамике используют также истинную и среднюю теплоемкости. Истинная теплоемкость:
C = δdTQ .

Г л а в а 1. Основы химической термодинамики |
33 |
Средняя теплоемкость численно равна количеству теплоты, которое надо сообщить веществу, чтобы нагреть его на 1 К:
|
|
|
|
|
Q |
(2.10) |
|
C = |
|
|
|||||
|
|
|
. |
||||
T |
2 |
− T |
|||||
|
|
|
|
1 |
|
|
|
Если величины C, C , CV, Cp относятся к одному молю вещества, то говорят о мольных значениях теплоемкостей Cm. Размерность теплоемкости [Дж К–1], мольной теплоемкости [Дж моль–1 К–1]. Истинная и средняя мольные теплоемкости связаны между собой соотношениями:
|
|
|
|
|
|
|
|
1 |
T |
|
|
|
|
|
|
|
|
|
∫2 |
CmdT . |
|
Cm = (limC |
m )T2 |
−T1 |
→0 , Cm = |
|
||||||
T |
− T |
|||||||||
|
|
|
|
2 |
1 T |
|
||||
|
|
|
|
|
|
|
|
|
1 |
|
Соотношение между Cp и CV можно вывести, например, с помощью уравнения (2.7). Если разделить правую и левую части уравнения (2.7) на dT при p = const и учесть определение изобарной и изохорной теплоемкости, то получим:
|
∂Q |
= CV |
|
|
∂U |
|
∂V |
C p = |
|
+ p + |
|
|
. |
||
|
∂T p |
|
|
|
∂V T |
∂T p |
|
На основании опытов Джоуля было установлено, что при изотермическом расширении идеального газа его внутренняя энергия не зависит от объема, то есть
|
∂U |
= 0 . |
|
|
|
|
∂V T |
|
В изотермических процессах с участием идеального газа внутренняя энергия не изменяется, и работа расширения происходит только за счет поглощаемой теплоты. Так как для идеального газа
|
|
∂V |
|
= |
nR |
, |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
p |
|
|
|||||
|
|
∂T p |
|
|
|
|
|||
то |
|
|
|
|
|
|
|
|
|
C p = CV |
|
∂U |
|
|
∂V |
= CV |
+ nR |
||
+ p + |
|
|
|
|
|
||||
|
|
∂V |
T |
∂T p |
|
|
|||
и для одного моля идеального газа
C p,m = CV ,m + R .
(2.11)
(2.12)
(2.13)
(2.14)
(2.15)
(2.16)
34 |
Г л а в а 1. Основы химической термодинамики |
Для конденсированной фазы второе слагаемое в выражении (2.12) обычно мало, поэтому
(2.17) |
C p CV , C p,m CV ,m . |
Изохорная теплоемкость определяется через теплоту, переданную системе при постоянном объеме. Так как при постоянном объеме механическая работа не совершается, теплота равна изменению внутренней энергии δQV = dU = CVdT. При постоянном давлении теплота равна изменению другой функции состояния, которую называют эн-
тальпией:
(2.18) |
δQp = dU + pdV = d (U + pV) = dH, |
где H = U + pV – энтальпия системы.
Из последнего равенства следует, что изобарная теплоемкость Cp определяет зависимость энтальпии от температуры.
(2.19) |
Cp = |
∂H |
. |
|
|
∂T |
p |
Зависимость теплоемкости от давления или объема
(2.20)
(2.21)
(2.22)
Для определения вида зависимости изохорной теплоемкости некоторого вещества от объема необходимо найти производную CV по объему:
|
∂CV |
|
∂ |
∂U |
|
|
∂ |
∂U |
|
|||
|
|
|
= |
|
|
|
|
= |
|
|
|
. |
∂V |
|
|
||||||||||
|
T |
|
∂V |
∂T V T |
|
∂T |
∂V T V |
|||||
Аналогично, зависимость изобарной теплоемкости от давления можно выразить через производную:
∂C p |
|
∂ |
∂H |
|
|
∂ ∂H |
|
|||||
|
|
|
= |
|
|
|
|
= |
|
|
|
. |
|
|
|
||||||||||
∂p |
|
|
|
|
|
|
||||||
|
T |
|
∂p |
∂T p T |
|
∂T |
∂p T p |
|||||
Внутренняя энергия (энтальпия) идеального газа не зависит от объема (давления), поэтому
∂CV |
= 0 и |
|
∂C p |
= 0 , |
|||
|
|
T |
|
|
T |
||
∂V |
∂p |
||||||
т.е. теплоемкость идеального газа не зависит от V и p. Для реальных газов и конденсированной фазы эта зависимость становится заметной только при очень больших давлениях.

Г л а в а 1. Основы химической термодинамики |
35 |
ПРИМЕРЫ
Пример 2-1. Рассчитайте изменение внутренней энергии гелия (одноатомный идеальный газ) при изобарном расширении от 5 до 10 л под давлением 196 кПа.
Решение. p1 = p2 = 196 кПа, V1 = 5 л, V2 = 10 л. Начальная и конечная температуры: T1 = p1V1 / nR, T2 = p2V2 / nR. Изменение внутренней энергии идеального газа определяется только начальной и конечной температурами (CV = 3/2 nR – идеальный одноатомный газ):
∆U = CV (T2 – T1) = 3/2 nR (T2 – T1) =
=3/2 (p2V2 – p1V1) = 3/2 (196 103) (10 – 5) 10–3 = 1470 Дж.
Ответ. 1470 Дж.
Пример 2-2. Один моль ксенона, находящийся при 25 °С и 2 атм, расширяется адиабатически:
а) обратимо до 1 атм, б) против давления 1 атм.
Какой будет конечная температура в каждом случае? Решение. а) Исходный объем ксенона (n = 1):
V1 = nRT1 / p1 = 0.082 298 / 2 = 12.2 л.
Конечный объем можно найти из уравнения адиабаты (для одноатомного идеального газа γ = Cp / CV = 5/3):
p1V15/3 = p2V25/3
V2 = V1 (p1/p2)3/5 = 12.2 23/5 = 18.5 л.
Конечную температуру находим по уравнению состояния идеального газа (p2 = 1 атм):
T2 = p2V2 / nR = 18.5 / 0.082 = 225 К.
б) При необратимом расширении против постоянного внешнего давления уравнение адиабаты неприменимо, поэтому надо воспользоваться первым законом термодинамики. Работа совершается за счет убыли внутренней энергии:
–W = –∆U = nCV (T1 – T2),
где n = 1, CV = 3/2 R (одноатомный идеальный газ).
Работа расширения против постоянного внешнего давления p2 равна:
–W = p2 (V2 – V1) = nRT2 – p2V1.
Приравнивая последние два выражения, находим температуру T2:
T2 = (nCVT1 + p2V1) / (nCV + nR) = 238 К.

36 |
Г л а в а 1. Основы химической термодинамики |
Температура выше, чем при обратимом расширении, т.к. в обратимом случае совершается бόльшая работа, расходуется больше внутренней энергии и температура понижается на бόльшую величину.
Ответ. а) 225 К; б) 238 К.
Пример 2-3. Один моль водяных паров обратимо и изотермически сконденсировали в жидкость при 100 °С. Рассчитайте работу, теплоту, изменение внутренней энергии и энтальпии в этом процессе. Удельная теплота испарения воды при 100 °С равна 2260 Дж г–1.
Решение. В процессе
H2O(г) → H2O(ж)
произошло обратимое сжатие газа при постоянном давлении p = 1 атм от объема
V1 = nRT / p = 0.082 373 = 30.6 л
до объема одного моля жидкой воды V2 ≈ 0.018 л. Работа сжатия при постоянном давлении равна:
W = –p (V2 – V1) ≈ pV1 = 101.3 кПа 30.6 л = 3100 Дж.
При испарении одного моля воды затрачивается теплота
2260 Дж г–1 18 г = 40700 Дж,
поэтому при конденсации одного моля воды эта теплота, напротив, выделяется в окружающую среду:
Q = –40700 Дж.
Изменение внутренней энергии можно рассчитать по первому закону:
∆U = Q + W = –40700 + 3100 = –37600 Дж,
а изменение энтальпии – через изменение внутренней энергии:
∆H = ∆U + ∆(pV) = ∆U + p∆V = ∆U – W = Q = –40700 Дж.
Изменение энтальпии равно теплоте, т.к. процесс происходит при постоянном давлении.
Ответ. W = 3100 Дж, Q = ∆H = –40700 Дж, ∆U = –37600 Дж.
ЗАДАЧИ
2-1. Газ, расширяясь от 10 до 16 л при постоянном давлении 101.3 кПа, поглощает 126 Дж теплоты. Определите изменение внутренней энергии газа.
