
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
α → α′ при понижении (или α′ → α при повышении) температуры сопровождается изменением составов и относительных количеств этих растворов. Например, в сплаве х2 превращение неупорядоченного α в упорядоченный α′-раствор происходит в интервале температур T3–T4 и сопровождается изменением их составов.
На кривой охлаждения этот сплав имеет четыре критических точки, из которых две верхние T1 и T2 отвечают температурам ликвидуса и солидуса, а T3 – температура начала превращения беспо- рядок–порядок, а T4 – температура конца превращения беспорядок– порядок. Только сплав состава х1 упорядочивается скачкообразно при постоянной температуре Tk, отвечающей максимуму на кривых akd и bkc, поэтому на его кривой охлаждения видны три критические точки, нижняя из которых – горизонтальная площадка при Tk. В сплавах состава участков a–b и c–d упорядочение α-раствора при понижении температуры вплоть до комнатной до конца не доходит, поэтому они имеют двухфазную структуру α + α′, а на кривых охлаждения – по три критических точки (все перегибы). Сплаву х1 в области bkc упорядоченных α′-растворов отвечает максимальная степень дальнего порядка. При переходе от этого сплава к границам α′-области (точкам b и c) степень порядка уменьшается.
5.2.4. Диаграммы с наличием трехфазного равновесия (их классификация)
Как уже отмечалось в п. 5.2.2 в равновесии могут находиться три фазы: жидкая и две твердых. Если мы применим правило фаз Гиббса к двухкомпонентной системе при постоянном давлении, то увидим, что максимальное число фаз, одновременно участвующих в равновесии, равно трем. Это ограничивает число возможных трехфазных равновесий по следующим соображениям. При любом фазовом превращении в r-фазной системе число превращающихся фаз может быть равно 1, 2, ..., r – 1, а число образующихся – соответственно r – 1, r – 2, ..., 2, 1. Очевидно, что в трехфазной системе может быть максимум две превращающиеся фазы, чему отвечает одна образующаяся фаза. Соответственно, и образующихся фаз может быть максимум две, чему соответствует только одна пре-
252
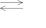
вращающаяся фаза. В двухкомпонентной системе в простейшем случае возможными фазами являются твердые растворы α и β, образующиеся на основе компонентов А и В, соответственно, а также жидкий раствор L. Тогда в соответствии с изложенным относительно числа и характера возможных трехфазных равновесий в двухкомпонентной системе можно записать два возможных варианта равновесия:
L |
|
|
α + β; |
(5.16) |
|
|
|||||
|
|||||
L + β |
|
α. |
(5.17) |
||
|
|||||
|
|||||
Фазовые равновесия (5.16) и (5.17) называют соответственно
эвтектическим и перитектическим. В соответствии с нонвариант-
ным характером трехфазного равновесия в двухкомпонентной изобарической системе равновесия (5.16) и (5.17) наблюдаются при постоянной температуре, соответственно эвтектической Te или перитектической Tp. Концентрационные пределы этих превращений ограничены пределами областей гомогенности на основе компонентов А и В при эвтектической температуре или протяженностью устойчивого состояния жидкой фазы, с одной стороны, и протяженностью области твердого раствора на основе одного из компонентов, с другой стороны, при перитектической температуре.
Чтобы зафиксировать положение эвтектической либо перитектической горизонтали на диаграмме фазового равновесия в координатах Τ–x, можно воспользоваться тем же приемом геометрической термодинамики, что и в случае установления двухфазного равновесия (рис. 5.17).
Из общего условия фазового равновесия для эвтектического и перитектического превращений в системе А–В имеем:
μαA = μβA = μLA; μαB = μβ B = μLB. |
(5.18) |
Кроме того, как было показано при рассмотрении двухфазного равновесия, эти выражения являются условиями проведения общей касательной к кривым концентрационной зависимости изобарноизотермического потенциала сосуществующих фаз. Следовательно, геометрической интерпретацией условия трехфазного равновесия в двухкомпонентной системе является общая касательная а'е'b' или р'а'b' к кривым G = f (хB) для соответствующих трех фаз. При этом фиксируются совершенно строго составы равновесных фаз xαB, xβB и xLB, а проектирование этих составов на диаграмму Т–х к темпера-
253
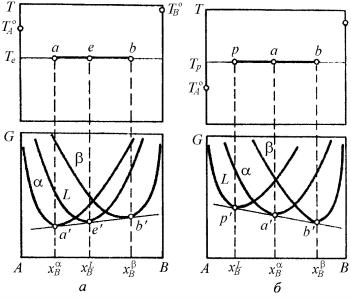
турам Te или Tp позволяет установить фиксированное положение эвтектической (аеb рис. 5.17,а) или перитектической (pab, рис. 5.17,б) горизонтали.
Рис. 5.17. Построение линий эвтектического (а) и перитектического (б) равновесия в двухкомпонентной системе при помощи кривых концентрационной зависимости изобарно-изотермического потенциала
Заметим, что уже из выражений (5.16) и (5.17) вытекает совершенно четкое положение эвтектической и перитектической горизонталей относительно температур плавления компонентов А и В для конденсированных систем. В самом деле, поскольку превращающейся фазой при эвтектическом превращении в процессе охлаждения является жидкость, а образуются при этом две твердые фазы α и β, можно заключить, что левая ветвь кривой Gα= f (хB) будет всюду ниже левой ветви кривой G(L) = f (хB), а это означает, что
GSA < GLA. (5.19)
Точно так же приходим к выводу, что правая ветвь кривой Gβ = f (хB) должна быть всюду ниже правой ветви кривой GL= f (xB). Откуда следует
GSB < GLB. |
(5.20) |
254
Из сопоставления с кривыми температурной зависимости изо- барно-изотермического потенциала для однокомпонентной системы (см. рис. 5.3) на основании выражений (5.19) и (5.20) будем иметь
T o >T |
; T o > T . |
(5.21) |
A e |
B e |
|
В соответствии с этим результатом наклоны правых и левых ветвей на кривых концентрационной зависимости изобарноизотермического потенциала должны быть выбраны не случайно, а вполне определенно. Обе ветви кривой для жидкости – наиболее крутые. Левая ветвь для фазы α идет круче, чем для фазы β, поскольку обе ветви должны прийти в общую точку, отвечающую значению изобарно-изотермического потенциала компонента А
при эвтектической температуре, т. е. в точку GAo(S ) . Аналогично правая ветвь для фазы β круче, чем для фазы α, поскольку обе ветви должны встретиться в общей точке GBo(S ) при данной темпера-
туре. Таким образом, можно вполне обоснованно установить фиксированное положение кривых зависимости G = f (хB) для всех трех фаз, опираясь на значения изобарно-изотермических потенциалов твердой и жидкой фаз компонентов А и B при рассматриваемой температуре. Относительное расположение этих потенциалов на ординатах компонентов устанавливается из графика G = f (T) при учете соотношений (5.21).
Рассуждая аналогично о перитектическом превращении при по-
ложении точки р, как показано на рис. 5.17, б, получим: |
|
|
GLA < GSA |
(5.22) |
|
и |
|
|
GLB > GSB, |
(5.23) |
|
откуда следует (см. рис. 5.3), что |
|
|
T o |
<Τp<T o . |
(5.24) |
A |
B |
|
Кривые концентрационной зависимости изобарно-изотерми- ческого потенциала при температуре трехфазного равновесия расположены в общем случае на разных уровнях, однако ко всем трем кривым можно провести единую касательную. Как мы видели, для установления условий трехфазного равновесия не требуется при-
255
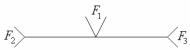
влекать никакие дополнительные представления о характере двухфазных равновесий и о том, какой из компонентов является растворителем, а какой растворенным веществом. Важно только правильно зафиксировать параметры и четко представлять, концентрация какого компонента является независимой переменной, а какого – зависимой.
Рассмотренные выше эвтектическое и перитектическое трехфазные равновесия в двухкомпонентной системе носят общий характер, поскольку характеризуют принципиальную возможность течения процесса превращения одной фазы с образованием двух других или превращения двух фаз, сопровождающегося образованием третьей фазы. Однако от того, в каком агрегатном состоянии находятся взаимодействующие фазы, возможны и другие виды трехфазных равновесий в двухкомпонентной системе, в частности, когда три фазы – твердые или две фазы – жидкие и одна – твердая.
Поэтому целесообразно классифицировать все трехфазные равновесия. Равновесие всех фаз при постоянной температуре изображается совокупностью трех точек на нонвариантной горизонтали. Две из этих точек всегда являются концами горизонтали, а третья точка располагается между ними. Трехфазная реакция, в которой участвуют три фазы, всегда протекает при постоянной температуре
ипостоянном составе фаз. Возможны только два варианта:
-одна фаза промежуточного состава распадается на две другие фазы крайних на горизонтали составов – это реакция эвтектического типа;
-при взаимодействии двух крайних на горизонтали фаз образуется третья, промежуточная по составу фаза – это реакция перитектического типа.
Эвтектический тип реакции можно условно изобразить, как:
|
F1 F2 + F3 |
(5.25) |
или графически |
|
|
К эвтектическому типу относятся следующие реакции: |
|
|
- эвтектическая |
L α + β; |
|
- эвтектоидная |
γ α + β; |
|
256
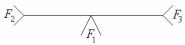
- монотектическая L1 L2 + α;
- монотектоидная |
γ1 γ2 + α; |
- метатектическая |
γ α + L. |
(Направление стрелки в правую сторону соответствует охлаждению, а в левую – нагреванию)
Перитектический тип реакции можно условно изобразить, как:
F1 + F2 F3 |
(5.26) |
или графически
К перитектическому типу относятся следующие реакции:
- перитектическая |
α + L β ; |
- перитектоидная |
γ + α β ; |
- синтектическая |
L1 + L2 α . |
Вполне очевидно, что агрегатное состояние фаз не накладывает никаких дополнительных ограничений на условия трехфазного равновесия и поэтому термодинамическое обоснование приведенных выше трехфазных равновесий в принципе ничем не отличается от приведенного выше обоснования эвтектического и перитектического равновесий (см. рис. 5.17).
Анализируя физико-химическую сущность трехфазного эвтектического равновесия, нетрудно заключить, что оно является соче-
танием трех двухфазных равновесий L α, L β и α β. Этот вывод вытекает из рассмотрения общей касательной к кривым концентрационной зависимости изобарно-изотермического потенциала трех рассматриваемых фаз при эвтектической температуре.
В самом деле, отрезок касательной а'e' (см. рис. 5.17) указывает на первое из трех указанных двухфазных равновесий, отрезок е'b' – на второе и, наконец, а'b' – на третье. Следовательно, эвтектическую горизонталь можно рассматривать как совокупность трех конод, символизирующих наличие трех указанных двухфазных равновесий. И, таким образом, любое из приведенных выше трехфазное равновесие может рассматриваться как сочетание трех двух-
фазных равновесий F1 F2, F1 F3, F2 F3.
257
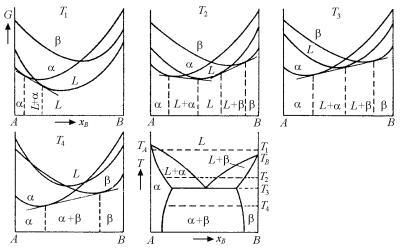
Сочетание различных видов двух- и трехфазных равновесий приводит к разным фазовым соотношениям в системе и, следовательно, к разным видам диаграмм фазового равновесия. Возможные видоизменения характера кривых моновариантного равновесия при сочетании различных фазовых областей в пределах одной диаграммы фазового равновесия весьма многообразны. На вышеописанных принципах обоснования двухфазных и трехфазных равновесий при помощи кривых концентрационной зависимости изобар- но-изотермического потенциала базируется вывод основных вариантов диаграмм фазового равновесия двухкомпонентных систем.
5.2.5. Диаграммы с эвтектическим и эвтектоидным равновесием
Рассмотрим систему с трехфазным эвтектическим равновесием, используя термодинамические принципы построения диаграмм фазового равновесия на основе концентрационной зависимости изобарно-изотермического потенциала при фиксированной температуре, изложенные в пп. 5.2.1 и 5.2.4.
Рис. 5.18. Кривые изобарно-изотермического потенциала жидких и твердых растворов при температурах Т1, Т2, Т3, T4 и диаграмма фазового равновесия двухкомпонентной системы с эвтектическим равновесием
258
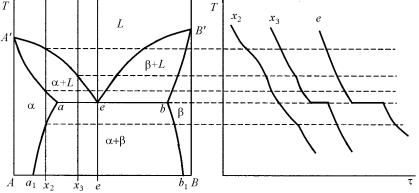
На рис. 5.18 приведены этапы построения диаграммы фазового равновесия двухкомпонентной системы с эвтектическим равновесием с ограниченной взаимной растворимостью компонентов в твердом состоянии.
Диаграмма с эвтектическим равновесием. Наиболее часто встречаемый на практике вид диаграммы фазового равновесия с эвтектическим равновесием представлен на рис. 5.19. Это диаграмма с эвтектическим равновесием и с полной взаимной растворимостью компонентов в жидком состоянии и ограниченной растворимостью – в твердом, при этом растворимость компонента В в А и А в В уменьшается с понижением температуры.
Рис. 5.19. Типичная диаграмма фазового равновесия двухкомпонентной системы с эвтектическим равновесием и кривые охлаждения некоторых сплавов
Кривые aa1 и bb1, ограничивающие положение областей твердого раствора на основе компонентов А и В, носят название линий ограниченной растворимости, или сольвуса. Диаграмма фазового равновесия эвтектического типа полностью описывает поведение смесей и дает ясное понятие о фазовом составе в различных темпе- ратурно-концентрационных диапазонах. Нетрудно видеть, что участки диаграммы, характеризующие двухфазное равновесие между твердыми растворами на основе А и В, с одной стороны, и жидкостью – с другой, представляют собой части диаграммы с непрерывным рядом твердых и жидких растворов (см. рис. 5.12), а участок, ограниченный линиями сольвуса, можно трактовать как срезанный
259
купол расслоения, показанный на рис. 5.15. Подробно описание переходов из одной фазовой области в другую, а также процесса кристаллизации или плавления сплавов различного состава будет приведен ниже. Особый интерес представляет сочетание линий солидуса и сольвуса. На рис. 5.19 показано, что это сочетание осуществляется в точке максимальной протяженности твердых растворов на основе компонентов А и В; в литературе такие точки называются
точками предельного насыщения (или сольвуса).
Следует отметить, что термодинамика не накладывает никаких ограничений на направленность кривых солидуса и сольвуса, поэтому максимальная протяженность областей твердого раствора необязательно должна наблюдаться именно при эвтектической температуре. В принципе максимум растворимости может располагаться и выше и ниже эвтектической температуры. Тем не менее представленная картина отражает достаточно распространенный случай, когда каждая кривая моновариантного равновесия меняется так, как показано на рис. 5.18, и поэтому естественно, что максимальная растворимость отвечает точке их встречи. Рассматриваемый случай, хотя и достаточно распространенный, все же является частным. Максимальная протяженность области твердого раствора на основе одного из компонентов ниже линии эвтектического (или другого трехфазного равновесия) встречается довольно редко. Значительно более распространен случай максимальной растворимости выше температуры трехфазного равновесия, получивший название ретроградного солидуса, который будет рассмотрен несколько ниже.
При температуре Te жидкая фаза L состава точки e – Le оказывается в эвтектическом равновесии с α-кристаллами состава точки a – αa и β-кристаллами состава точки b – βb, что записывается как Le  αa + βb. Это равновесие наблюдается во всех сплавах, расположенных между точками a и b. В соответствии с этим горизонталь ab и точку e на этой горизонтали также называют эвтектическими, а жидкую фазу Le (состава точки e) или смесь кристаллов (αa + βb), которая выделяется из этой жидкости при кристаллизации по реакции Le → αa + βb, – эвтектикой. По-гречески эвтектика дословно переводится как «хорошо, легко плавящийся», т.е. эвтектический
αa + βb. Это равновесие наблюдается во всех сплавах, расположенных между точками a и b. В соответствии с этим горизонталь ab и точку e на этой горизонтали также называют эвтектическими, а жидкую фазу Le (состава точки e) или смесь кристаллов (αa + βb), которая выделяется из этой жидкости при кристаллизации по реакции Le → αa + βb, – эвтектикой. По-гречески эвтектика дословно переводится как «хорошо, легко плавящийся», т.е. эвтектический
260
сплав – это легкоплавкий сплав с минимальной температурой плавления. Температуры начала кристаллизации граничных α- и β- растворов изображаются кривыми ликвидуса A′e и eB′, а температуры конца кристаллизации – кривыми солидуса A′a и bB′. Сплавы участка a – b заканчивают кристаллизацию при температуре Te по эвтектической реакции Le → αa + βb .
Сплавы, расположенные в α-области, т.е. левее и выше кривой aa1, представляют собой ненасыщенные твердые растворы компонента В в компоненте А, а сплавы, расположенные в β-области, т.е. правее и выше кривой bb1, – ненасыщенные растворы компонента А в компоненте В. Если фигуративная точка сплава попадает на кривые aa1 и bb1, то α- и β-растворы становятся насыщенными. При понижении температуры из этих растворов выделяются вторичные β- или α- кристаллы.
Сплавы, расположенные между точками a и e, т.е. левее эвтектической точки e, принято называть доэвтектическими, сплавы между точками e и b – заэвтектическими, а сплав, отвечающий по составу эвтектической точке e – эвтектическим. Такое деление сплавов является условным, поскольку доэвтектические сплавы могут оказаться заэвтектическими и наоборот, если компоненты А и В поменять местами.
Вид диаграмм фазового равновесия двухкомпонентной системы с эвтектическим равновесием достаточно многообразен, что следует из рис. 5.20.
На рис. 5.20,а приведена наиболее часто встречающаяся диаграмма фазового равновесия с эвтектическим равновесием и ограниченной растворимостью компонентов в твердом состоянии, характеризуемая тем, что растворимость В в А и А в В уменьшается с понижением температуры. На рис. 5.20,б дана эвтектическая диаграмма с ограниченной растворимостью компонентов А в В и В в А без изменения взаимной растворимости в твердом состоянии при изменении температуры. На рис. 5.20,в показана диаграмма, которая имеет в основном теоретический характер: растворимость В в А и А в В увеличивается с понижением температуры. Надо иметь в виду, что из термодинамических соображений следует, что все границы двухфазных областей при своем продолжении там, где они
261
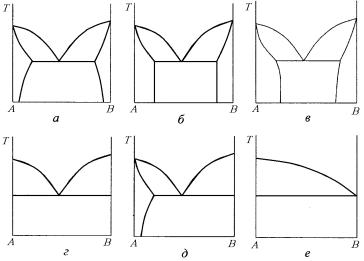
примыкают к эвтектической линии, должны попадать в двухфазные поля и никогда не попадать в однофазные поля. На рис. 5.20,г приведена эвтектическая диаграмма с отсутствием взаимной растворимости компонентов в твердом состоянии, т.е. на ней отсутствуют видимые области граничных твердых растворов на основе компонентов А и В.
Рис. 5.20. Виды диаграмм фазового равновесия двухкомпонентной системы с эвтектическим равновесием
На самом деле в большинстве случаев существует малая взаимная растворимость компонентов в твердом состоянии, но которую нельзя изобразить на диаграмме в принятом масштабе. Поэтому всегда следует ознакомиться с комментариями к таким диаграммам фазового равновесия. На рис. 5.20,д дана эвтектическая диаграмма
сналичием растворимости компонента В в компоненте А в твердом состоянии и отсутствием растворимости компонента В в А. На рис. 5.20,е показана диаграмма фазового равновесия с так называемой вырожденной эвтектикой, где состав эвтектической точки совпадает
ссоставом одного из компонентов, в данном случае компонента В. Структурные составляющие. Надо строго разграничивать, чем
фазы отличаются от структурных составляющих. Для этой цели,
262

а также, чтобы подробно рассмотреть процессы кристаллизации и структурообразования, проанализируем эти процессы на примере эвтектической диаграммы, представленной на рис. 5.21, а особенность этой диаграммы состоит в том, что растворимость компонента В в А уменьшается с понижением температуры, а растворимость компонента А в В постоянна при изменении температуры.
б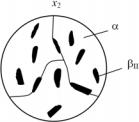
ав 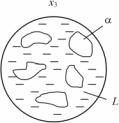
г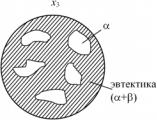 д
д 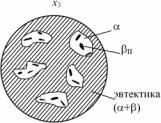
Рис. 5.21. Диаграмма фазового равновесия двухкомпонентной системы
сэвтектическим равновесием (а) и схематические структуры некоторых сплавов:
б– структура сплава х2 в точке 4; в – структура (виртуальная) сплава х3 в точке l;
г – структура сплава х3 в точке 2; д – структура сплава х3 в точке 3
Рассмотрим сплав состава х1, охлаждение которого начинается от температуры T1 с точки 0. Процессы, происходящие в этом сплаве, протекают так же, как у сплавов, описываемых диаграммой фа-
263
зового равновесия с неограниченной растворимостью компонентов в жидком и твердом состояниях. При охлаждении от точки 0 до точки 1 происходит охлаждение сплава в жидком состоянии. В точке 1 начинается кристаллизация с выделением α-кристаллов. При охлаждении в интервале температур от точки 1 до точки 2 происходит кристаллизация сплава с выделением α-кристаллов состава линии солидус. В точке 2 кристаллизация заканчивается. При охлаждении в интервале температур от точки 2 до точки 3 происходит охлаждение сплава в твердом состоянии. На кривой охлаждения этот сплав имеет две критические точки (перегибы), отвечающие соответственно температурам начала и конца кристаллизации (см. рис. 5.12).
Рассмотрим сплав состава х2, охлаждение которого начинается от температуры T1 (рис. 5.21,а). При охлаждении от точки 0 до точки 1 происходит охлаждение сплава в жидком состоянии. В точке 1 начинается кристаллизация с выделением α-кристаллов. При охлаждении в интервале температур от точки 1 до точки 2 происходит кристаллизация сплава с выделением α-кристаллов состава линии солидус, что можно записать, как L → α. В точке 2 кристаллизация заканчивается. При охлаждении в интервале температур от точки 2 до точки 3 происходит охлаждение сплава в твердом состоянии. Как только фигуративная точка сплава окажется на кривой сольвуса aa1, граничный α-раствор состав точки 3 станет насыщенным относительно другого граничного β-раствора. Поэтому при дальнейшем понижении температуры до температуры точки 4 из α- кристаллов, изменяющих свой состав по кривой aa1 в направлении от точки 3 к точке a1, выделятся вторичные β-кристаллы, состав которых будет постоянен и соответствовать точке b1, что можно записать, как α→βII. При комнатной температуре α-кристаллы окажутся в равновесии с β-кристаллами. Относительные количества эти фаз можно определить по правилу отрезков. Количество α- кристаллов равно отношению отрезков 4b1/а1b1, а количество β- кристаллов определится отношением а14/а1b1. На кривой охлаждения сплава х2 видны три точки (рис. 5.19): две верхние точки отвечают температурам начала и конца кристаллизации α-твердого раствора, а третья (нижняя) критическая точка – соответственно тем-
264
пературе начала выделения вторичных β-кристаллов. В структуре этого сплава под микроскопом можно различить кристаллы двух видов или две структурные составляющие: первичные α-кристаллы (основа сплава) и вторичные βII-кристаллы (см. рис. 5.21,б). Следует отметить, что в результате охлаждения в точке 4 имеются: фазы α и β и структурные составляющие α и βII. В данном конкретном случае имеется совпадение понятия фаз и структурных составляющих, поскольку каждая из его структурных составляющих – это одновременно α- и β-фазы. Однако это бывает не всегда, что и будет продемонстрировано на примере следующего сплава х3.
Достаточно сложные превращения протекают в до- и заэвтектических сплавах, в которых помимо первичных α- или β-кристаллов, выделяется эвтектика Le → αa + βb, а при охлаждении в твердом состоянии в интервале температур от Te до комнатной из α- кристаллов выделяются вторичные β-кристаллы (это справедливо для данной диаграммы). Рассмотрим сплав состава х3, охлаждение которого начинается от температуры T1 (рис. 5.21,а). При охлаждении от точки 0 до точки 1 происходит охлаждение сплава в жидком состоянии. В точке 1 начинается кристаллизация с выделением α- кристаллов. При охлаждении в интервале температур от точки 1 до точки 2 происходит кристаллизация сплава с выделением α- кристаллов состава линии солидус, что можно записать, как L → α.
В точке 2 кристаллизация заканчивается. Но мы рассмотрим состояние сплава при температуре точки l (на несколько градусов выше температуры эвтектики Te ). Проведя коноду klm в этой точке, мы получим, что состав α-твердой фазы определяется точкой k (точнее ее проекцией на ось концентраций), а состав жидкой фазы
– точкой m. Используя эту коноду как отрезок, применим правило отрезков для определения количества жидкой и твердой фаз в сплаве х3 при температуре точки l. Количество α-твердой фазы равно отношению lm/km и численно составляет около 30 % сплава, а количество жидкой фазы равно отношению kl/km и соответственно составляет около 70 % сплава (см. рис. 5.21,в).
При охлаждении сплава х3 до температуры эвтектики Te происходит эвтектическая реакция Le → αa + βb, и выделяется эвтектическая смесь кристаллов, однако в реакции принимает участие не
265
весь сплав, а только его 70 %, которые находятся в жидком состоянии. В результате после прохождения эвтектической реакции структура сплава в твердом состоянии представляет собой кристаллы α-твердого раствора (30 %) и эвтектику (α + β) в количестве 70 %. Схематически структура сплава х3 в точке 2 при температуре Te представлена на рис. 5.21,г. На схематических изображениях структур эвтектика обычно изображается мелкой штриховкой.
При охлаждении сплава х3 от точки 2 до точки 3 происходит выделение β-кристаллов из α-кристаллов, т.е. βII – вторичная кристаллизация. Это будет определяться увеличением количества β- фазы по правилу отрезков при охлаждении от точки 2 до точки 3. Структура сплава х3 в точке 3 представлена на рис. 5.21,д. Под микроскопом в структуре этого сплава можно увидеть три структурные составляющие: первичные α-кристаллы, эвтектическую смесь (α + β) и выделения βII-вторичных кристаллов внутри первичных α-кристаллов. Выделения βII-фазы заметны в поле зрения металлографического микроскопа только внутри зерен α-фазы, хотя теоретически эти выделения должны иметь место также и в эвтектике (α + β). Вторичные кристаллы на фоне дисперсной эвтектической смеси α + β заметны не будут, поскольку они сольются с α- и β-кристаллами, образующими эвтектику. Однако их можно рассмотреть при исследованиях с использованием электронного микроскопа.
Таким образом, при комнатной температуре для данного сплава имеем:
-фазы: α и β;
-структурные составляющие: α, βII и эвтектику (α+β).
На кривой охлаждения доэвтектического сплава х3 (рис. 5.19) видны две критические точки: верхняя точка (перегиб) отвечает температуре начала кристаллизации α-твердого раствора, а нижняя (горизонтальная площадка) – соответствует температуре Te кристаллизации эвтектики (α + β) и началу выделения βII – вторичных кристаллов из α-кристаллов разного происхождения.
На кривой охлаждения эвтектический сплав e (рис. 5.19) имеет одну критическую точку (горизонтальную площадку) при температуре Te, а в структуре одну – структурную составляющую эвтектику
266
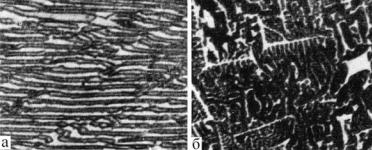
(α + β). Выделения вторичных фаз будут также не видны, так как их сравнительно немного, и они сольются с эвтектическими α- и β- кристаллами. На рис. 5.22 приведены типичные микроструктуры литых эвтектических сплавов на примере сплавов Ag – Cu и Pb – Bi.
Рис. 5.22. Типичные микроструктуры литых эвтектических сплавов
Ag–Cu (а) и Pb–Bi (б)
Если сравнить кривые охлаждения разных сплавов (см. рис. 5.19), то максимальную по величине горизонтальную площадку при температуре Te, пропорциональную времени кристаллизации эвтектики Le → αa + βb, имеет сплав эвтектического состава e. При переходе от этого сплава к сплавам, отвечающим по составу точкам максимальной растворимости, длина горизонтальных площадок на кривых охлаждения уменьшается до нуля, поскольку также до нуля уменьшается количество жидкости Le в сплавах.
Треугольник Таммана. Если для нескольких до- и заэвтектических сплавов, например, c, d, f и g (рис. 5.23,а), отложить отрезки c1c2, d1d2, f1f2 и g1g2 (рис. 5.23,б), пропорциональные длинам горизонтальных площадок на кривых охлаждения, то через концы этих отрезков или точки c1 и d1, f1 и g1 можно провести прямые a1e1 и b1e1, которые пересекутся между собой в точке e1, а с эвтектической горизонталью – соответственно, в точках a1 и b1. Вершина e1 полученного треугольника отвечает сплаву с площадкой максимальной длины на кривой охлаждения, т.е. сплаву эвтектического состава, а вершины a1 и b1 – сплавам, соответствующим максимальной взаимной растворимости компонентов А и В в твердом состоянии.
267
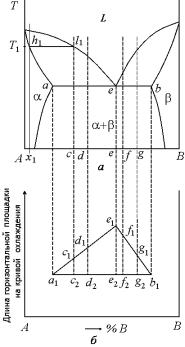
|
Полученный треугольник часто |
|||||
|
называют |
в |
научной |
литературе |
||
|
треугольником Таммана (по имени |
|||||
|
известного немецкого ученого). По- |
|||||
|
строение этого треугольника можно |
|||||
|
использовать для ускоренного опре- |
|||||
|
деления |
положения эвтектической |
||||
|
точки e на горизонтали ab и концов |
|||||
|
горизонтали a и b. Точность по- |
|||||
|
строения такого треугольника зави- |
|||||
|
сит от многих факторов, в первую |
|||||
|
очередь от количества исследован- |
|||||
|
ных сплавов и аппаратурных усло- |
|||||
|
вий снятия их кривых охлаждения. |
|||||
|
Правило фаз. Применим прави- |
|||||
|
ло фаз к диаграмме фазового равно- |
|||||
|
весия с эвтектикой и ограниченной |
|||||
|
взаимной |
растворимостью |
компо- |
|||
|
нентов А и В в твердом состоянии. В |
|||||
|
однофазных |
областях α, β и L чис- |
||||
Рис. 5.23. Схематическое |
||||||
ло степеней свободы С = К – Ф + 1 = |
||||||
построение треугольника |
||||||
Таммана: |
= 2 – 1 + 1 = 2, т.е. можно изменять |
|||||
а – эвтектическая диаграмма, |
концентрацию сплавов |
и |
одновре- |
|||
б – треугольник Таммана |
менно температуру и |
оставаться в |
||||
|
||||||
пределах однофазных областей.
В двухфазных областях L+α, L+β и α+β С = 2 – 2 + 1 = 1, это – моновариантное равновесие, т.е. можно менять только один из параметров (состав одной из фаз или температуру), а другой параметр будет от него зависим. Выберем состав твердой фазы x1 (рис. 5.23,а), что будет соответствовать точке h1 на кривой солидус при температуре T1. Проведя коноду l1h1, получим состав твердой фазы, который определяется точкой l1. Таким образом, задавая определенный состав одной из фаз, мы фиксируем строго определенные температуру и состав другой фазы. Изменение состава одной из фаз приводит к изменению температуры фазового равновесия и состава другой фазы, находящейся в равновесии с первой. Соответ-
268
ственно, задавая температуру фазового равновесия, мы фиксируем составы твердой и жидкой фаз, находящихся в равновесии при данной температуре. Изменяя значение температуры, мы тем самым изменяем составы фаз, находящихся в равновесии.
На горизонтальной эвтектической линии aeb в равновесии находятся три фазы и С = 2 – 3 + 1 = 0 (нонвариантное равновесие). Это означает, что нельзя изменять ни один параметр, не нарушив трехфазное равновесие.
Ретроградный солидус. Рас-
смотрим случай максимальной растворимости выше температуры трехфазного равновесия, получив-
ший название ретроградного солидуса.
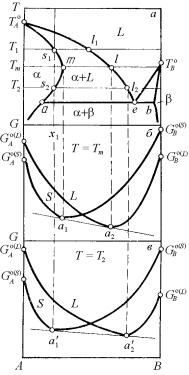
Вид участка фазовой диаграммы с ретроградным солидусом при трехфазном эвтектическом равновесии показан на рис. 5.24. Как видим, максимальная протяженность области твердого раствора на основе компонента А, отмеченная на кривой солидуса буквой m, отвечает температуре Тm, которая выше температуры трехфазного эвтектического равновесия. Необычность представленной картины заключается в том, что если рассматривать процесс охлаждения из жидкости, например, сплава состава х1, то оказывается, что после полного затвердевания жидкости состава l1 при температуре T1 в точке s1 он в процессе дальнейшего охлаждения плавится при более низкой температуре в точке s2 с выделением жидкости состава l2, сопряженной с s2 при температуре Т2.
Рис. 5.24. Ретроградный солидус
всистеме эвтектического типа (а)
иотносительное расположение кривых концентрационной
зависимости изобарноизотермического потенциала твердой и жидкой фаз при
различных температурах (б, в)
269
С позиций геометрической термодинамики принципиальная возможность существования ретроградного солидуса никаких возражений не вызывает. На рис. 5.24,б и в показано положение кривых концентрационной зависимости изобарно-изотермического потенциала твердой и жидкой фаз при температурах Тm и Т2 (при-
чем Тт > Т2 > Те).
Как видим, положение фигуративных точек равновесных фаз на диаграмме Τ–x фиксируется однозначно путем проведения общих касательных a1a2 и а′1а'2 к кривым G = f (xB) фаз, находящихся в равновесии при каждой температуре. Понижение температуры от Тm до Т2 лишь смещает соответствующие кривые в область более высоких значений изобарно-изотермического потенциала в связи с общим ходом его температурной зависимости и увеличивает интервал концентраций между точками касания к кривым Gα = f (xB) и GL = f (xB). Однако видимых причин смещения кривых изобарноизотермического потенциала вдоль оси концентраций на основании только геометрической термодинамики указать нельзя. Следует отметить, что ретроградный характер солидуса возможен не только при эвтектическом, но и при других возможных трехфазных равновесиях в двухкомпонентной системе, так как характер трехфазного равновесия в принципе не связан с сущностью рассматриваемого явления. Важно только, чтобы область двухфазного равновесия между твердым и жидким растворами была нисходящей.
Диаграмма фазового равновесия с эвтектоидной реакцией.
Как указывалось в п. 5.2.4, возможна реакция типа γ α + β, которая называется эвтектоидная. Типичные диаграммы фазового рав-
новесия с нонвариантным эвтектоидным равновесием γe αa + βb приведены на рис. 5.25.
Как правило, для того, чтобы наблюдалась эвтектоидная реакция, необходимо, чтобы хотя бы один компонент А фазовой диаграммы (рис. 5.25,б) обладал полиморфизмом, т.е. способностью при разных температурах иметь различную кристаллическую структуру. На рис. 5.25,а представлена фазовая диаграмма, оба компонента А и В которой обладают полиморфизмом. Высокотемпературные модификации компонентов А и В образуют полную
270

взаимную растворимость в твердом состоянии (γ-твердый раствор), который затем распадается по эвтектоидной реакции, образуя эвтектоид (α + β). Терминология, которая применяется к сплавам, лежащим слева и справа от эвтектоидного состава, аналогична той, которая применялась для сплавов в эвтектических системах. Сплавы, лежащие слева от эвтектоидной точки, называются доэвтекто-
идными, а справа – заэвтектоидными.
а б
Рис. 5.25. Типичные диаграммы фазового равновесия с эвтектоидным равновесием
Рассмотрим охлаждение доэвтектоидного сплава состава х1 (рис. 5.25,б) с температуры T0, предполагая что при этой температуре было достигнуто фазовое равновесие и сплав состоит только из равновесных кристаллов γ-фазы. Снижение температуры до значения T1 приведет к выделению первых кристаллов α-фазы. Поскольку зарождение выделяющихся фаз обычно стимулируется готовыми поверхностями и, в частности, границами зерен, следует ожидать, что первые α-кристаллы будут появляться преимущественно на границах зерен исходной γ-фазы, что и наблюдается на практике. По мере охлаждения кристаллы α-фазы растут, а их состав изменяется вдоль α-границы α + γ области до тех пор, пока не будет достигнут состав α3 при эвтектоидной температуре T3. Одновременно γ-фаза, если она полностью отвечает требованиям равновесия, должна изменять свой состав вдоль γ-границы α + γ области,
271
пока не будет достигнут эвтектоидный состав e. Все оставшееся по правилу отрезков количество γ-фазы должно теперь превратиться в эвтектоидную составляющую. Следует отметить, что скорость реакций в твердом состоянии чрезвычайно мала, что делает достаточно сложным достижение равновесного состояния при прохождении таких реакций. Это надо учитывать при рассмотрении для практических целей диаграмм фазового равновесия с эвтектоидной реакцией.
Зависимость свойств эвтектических и изоморфных сплавов от состава. На рис. 5.26,a приведены физические свойства сплавов для диаграммы фазового равновесия с полной взаимной растворимостью компонентов в жидком и твердом состояниях, которые могут быть разделены на две группы: структурно чувствительные и структурно нечувствительные. Структурно нечувствительные свойства (например, плотность) изменяются только в зависимости от условий, регулируемых извне: температуры, давления и состава. В идеальном случае изменение этих свойств линейно, однако в неидеальных изоморфных системах встречаются и положительные и отрицательные отклонения.
Структурно чувствительные свойства (твердость, предел прочности или электропроводность) изменяются с изменением величины зерна, степени ликвации и других структурных характеристик. Можно видеть, что изменение свойств не линейно, оно переходит через максимум или минимум. Свойства изменяются наиболее быстро с первыми добавками легирующего элемента к одному из компонентов; это изменение уменьшается с увеличением легированности и меняет направление, проходя через максимум или минимум. Хотя абсолютные величины различных свойств у разных систем отличаются, форма кривых остается в общем-то одинаковой у всех бинарных изоморфных систем.
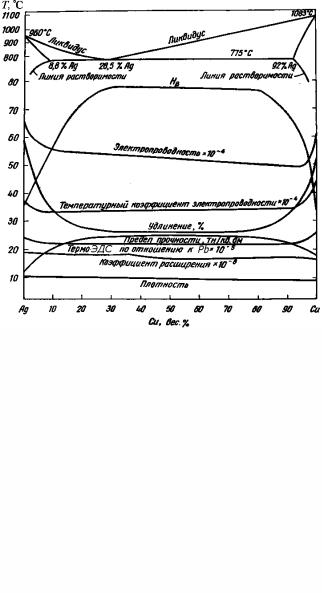
На рис. 5.26,б приведены физические свойства сплавов эвтектической системы Ag – Cu при комнатной температуре. Свойства сплавов, принадлежащих к эвтектическим системам, зависят от индивидуальных характеристик фаз и от характера распределения их в микроструктуре. Это верно и для любого многофазного сплава.
272
а
б
Рис. 5.26. Свойства отожженных сплавов систем Ag–Au (а) и Ag–Cu (б) при комнатной температуре
273
Каждая из фаз ведет себя как твердый раствор, свойства которого изменяются с составом в соответствующих концентрационных пределах, как и свойства изоморфных твердых растворов. В соответствии с этим свойства фазы изменяются быстрее всего при первых добавках растворяемого вещества к растворителю, а каждая последующая добавка ведет ко все меньшему изменению свойств. С увеличением добавки твердость и предел прочности возрастают, а электропроводность понижается.
При двух сосуществующих фазах состав, а следовательно, и физические свойства отдельных фаз в принципе должны оставаться постоянными во всей области двухфазного равновесия. Свойства же сплава должны получаться аддитивно, как свойства смеси из двух фаз с постоянными характеристиками. Отклонения от равновесия во многих случаях мешают реализации этого условия, однако существует также множество случаев, когда это правило осуществляется полностью или в достаточной степени. Могут существовать и в действительности существуют большие различия между свойствами двух твердых фаз. Если фаза – промежуточный твердый раствор (о них будет сказано ниже), она часто бывает или твердой или хрупкой, или и той и другой одновременно. Первичные твердые растворы большинства распространенных металлов бывают обычно сравнительно мягкими и пластичными.
Если в структуре сочетаются две фазы, результирующие свойства смеси будут ближе всего к свойствам фазы, которая образует матрицу, в которую включены частицы второй фазы. По мере увеличения второй фазы с изменением состава сплава она приближается к состоянию пространственной непрерывности, а свойства сплава
– к свойствам этой фазы. Таким образом, свойства изменяются более или менее равномерно с составом двухфазного сплава от свойства первой насыщенной фазы к свойствам второй. В некоторых сплавах (рис. 5.26,б) эта зависимость является почти линейной, тогда как в других она значительно отклоняется от линейной.
Эти отклонения могут быть вызваны одной или несколькими из следующих причин:
- негомогенностью отдельных фаз, приводящей к тому, что индивидуальные свойства фаз в двухфазной области изменяются с составом сплава;
274
-особенностями формы кристаллитов, благодаря которым одна из фаз остается непрерывной в очень большом диапазоне концентраций;
-вариациями размеров зерен в пределах двухфазной зоны. Последний фактор имеет две разновидности: размер отдельных
кристаллитов (фаз) и размер зерен эвтектики. В литых сплавах зерна большей частью единичные кристаллы, но механическая и термическая обработки могут вызвать их перекристаллизацию и образование поликристаллических зерен. Малые размеры зерен соответствуют высокой твердости и пониженной пластичности; на немеханические свойства размер зерен влияет меньше, хотя при малых частицах магнитные и электрические свойства очень сильно зависят от размеров зерен. Часто при эвтектическом составе наблюдается наличие максимума или минимума свойств. Предполагается, что это связано с минимальным размером зерен или входящих в них кристаллитов, что отмечается у сплавов эвтектического или близкого к нему состава.
Влияние термической обработки на свойства должно быть связано с соответствующими изменениями микроструктуры. При гомогенизации первичного твердого раствора растворимость возрастает, и раствор становится более твердым. Обратный эффект имеет место при выделении из раствора, если при этом не происходит дисперсионного твердения. Сфероидизация увеличивает геометрическую непрерывность матричной фазы и усиливает ее влияние на механические свойства. Изменения в размерах зерна или кристаллита могут приводить к повышению или понижению твердости (соответственно при измельчении или укрупнении). Если в результате оплавления при термической обработке фаза, содержащаяся в меньшем количестве, распределяется в виде пленки по границам зерен основной фазы, то свойства сплава становятся сходными со свойствами пограничной фазы, хотя количество ее невелико. Если, например, пограничная фаза является хрупкой, то сплав также становится хрупким.
Эти принципы зависимости свойств от структуры приложимы и к много фазным сплавам. Различия, наблюдаемые у разных сплавов, можно объяснить неодинаковой ролью различных структур-
275

ных факторов в металлических системах разного типа. Свойства эвтектических сплавов только иногда бывают чувствительными к размерам частиц, тогда как эвтектоидные сплавы чрезвычайно чувствительны к этому фактору.
Процессы, происходящие в сплавах при ускоренном охлаж-
дении. Условия равновесного затвердевания на практике достаточно часто не соблюдаются, поскольку для восстановления равновесных составов фаз при каждом понижении температуры требуется весьма большое время. Это восстановление равновесия может быть достигнуто только при диффузии атомов А и В в обеих фазах и через поверхность, разделяющую твердую и жидкую фазы. Поскольку диффузия, особенно в твердом состоянии, протекает медленно, истинное равновесие может устанавливаться при охлаждении лишь при условии, что скорость охлаждения бесконечно мала.
Поэтому если охлаждение протекает с обычными скоростями,
следует ожидать определенных отклонений от равновесного за-
твердевания. При рассмотрении приведенной ниже части диаграммы фазового равновесия с областями существования фаз: L, α, L+α (рис. 5.27) принимается, что однородность, соответствующая равновесию, поддерживается только в жидкой фазе, но не в твердой, где скорость диффузии много меньше.
Рис 5.27. Изменение положения линии солидус при ускоренной кристаллизации сплава x
Рассмотрим сплав состава х при температуре T1, при которой начинается кристаллизация с выделением кристаллов α. Проведя
276
коноду при этой температуре, получим, что состав первых кристаллов α-фазы определяется точкой α1 на кривой солидус, а ее проекция на ось концентраций даст значение х1. Состав жидкой фазы в начале кристаллизации будет определяться точкой L1 на кривой ликвидус. При последующем охлаждении сплава состав жидкости изменится до L2, а состав твердой фазы, образовавшейся при охлаждении от температуры T1 до T2, должен определяться на линии солидус точкой α2 и на оси концентраций иметь значение х2, т.е. х1 → х2. Однако отдельные порции твердой фазы, которые образовывались при температурах, превышающих T2, фактически не изменили своего первоначального состава, и средний состав всей твердой фазы будет соответствовать точке α′2. Таким образом, значение состава твердой фазы х′2 должно находиться между значениями х1 и х2, т.е. х1 > х′2 > х2. При падении температуры до T3 средний состав твердой фазы все более и более будет отклоняться от равновесного и при T3 станет α′3, а не α3. В идеальных условиях затвердевание должно было бы закончиться при T4. Однако при этой температуре состав твердой фазы еще не достиг среднего состава сплава, и некоторая часть жидкости должна остаться. Относительные количества жидкости могут быть получены, если при температуре T4 мы проведем коноду, которую используем для применения правила отрезков:
%твердой фазы = (х4L4 / α′4L4)·100 = 80 %,
%жидкой фазы = (α′4х4 / α′4L4)·100 = 20 %.
Поэтому затвердевание продолжается до более низких температур, и выделяющаяся при этом твердая фаза богаче компонентом В, чем первоначальный сплав состава х. Наконец, при T5 средний состав твердой фазы α′5 совпадает со средним составом сплава х, и затвердевание сплава завершается.
Для неравновесного затвердевания характерно увеличение температурного интервала, в котором присутствуют одновременно твердая и жидкая фазы, а также сохранение в затвердевшем сплаве концентрационной неоднородности. Если уменьшить скорость охлаждения, то отклонения составов твердой фазы от среднего будут меньше. Увеличение скорости диффузии в твердом состоянии так-
277
же приведет к уменьшению отклонения от равновесия. Началу затвердевания сплавов обычно предшествует переохлаждение: жидкость охлаждается без затвердевания до температуры ниже L1. Когда это происходит, первые порции твердой фазы могут иметь состав, близкий к среднему составу сплава, т.е. α1. Однако выделе-
ние скрытой теплоты кристаллизации обычно снова повышает температуру (происходит явление рекалесценции), так что сравнительно небольшая степень начального переохлаждения имеет повидимому слабое влияние на общий ход затвердевания.
Затвердевание сплава начинается с появления малых твердых частиц – зародышей, которые содержат больше тугоплавкого компонента, чем все последующие порции твердой фазы. Вокруг этих кристаллитов – зародышей последовательно отлагаются слои твердой фазы, причем каждый следующий слой несколько богаче более легкоплавким компонентом, чем предыдущий. После полного затвердевания сплав имеет ликвационную структуру, состоящую из участков, центральная часть которых, имеющая более высокую температуру плавления, окружена низкоплавким материалом. Большинство металлов затвердевает с образованием древовидных кристаллов, называемых дендритами, ветви которых по мере затвердевания утолщаются, и число этих ветвей увеличивается до тех пор пока весь объем сплава не заполнится твердой фазой. Ликвационная структура в большинстве сплавов повторяет строение дендритов. Такую ликвацию иногда называют дендритной ликвацией
(см. п. 6.3.2).
Если мы проводим охлаждение сплавов в эвтектической системе с высокой скоростью, сходной с теми значениями, которые использовали при рассмотрении случая на рис. 5.27, то изменению подвергнется не только солидус (рис. 5.28).
За счет кристаллизации α-фазы при более низких температурах ее окончательное затвердевание будет происходить при температурах, близких к температуре эвтектики, и левая граница эвтектической линии сдвинется влево в положение а1. Кроме этого следует учитывать, что в случае вторичной неравновесной кристаллизации наблюдается значительное переохлаждение и запаздывание диффузионных процессов. С увеличением скорости охлаждения выделе-
278
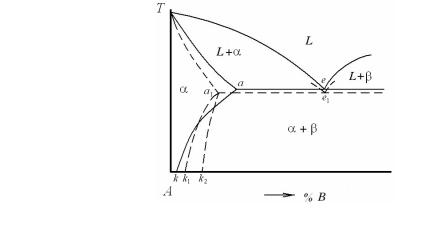
ние избыточной фазы будет начинаться при более низкой температуре и количество выделяющихся кристаллов избыточной β-фазы будет меньше. Можно говорить, что твердый раствор оказывается пересыщенным. Линия ограниченной растворимости компонента В в компоненте А при этом переместится в положение a1k1. При повышении скорости охлаждения можно добиться, чтобы не было выделений второй β-фазы, т.е. чтобы не происходила вторичная кристаллизация. Линия ограниченной растворимости компонента В в А в этом случае может переместиться в положение a1к2 и диаграмма фазового равновесия примет вид, показанный на рис. 5.28. Эти возможные видоизменения диаграмм фазового равновесия при их построении в неравновесных условиях или при их использовании в неравновесных условиях необходимо учитывать на практике.
Рис. 5.28. Вид диаграммы фазового равновесия эвтектического типа при ускоренном охлаждении сплавов
5.2.6. Диаграммы с монотектическим и монотектоидным равновесиями
Важными реакциями эвтектического типа является монотекти-
ческая реакция L1 L2 + α, в которой жидкая фаза при понижении температуры распадается на твердую фазу и новую жидкую фазу и
монотектоидная γ1 γ2 + α, в которой все три фазы твердые. В некотором интервале температур и концентраций две жидкости,
279

например масло и вода, не смешиваются и являются отдельными фазами.
Соответствие монотектической системы правилу фаз и другим термодинамическим принципам обосновывается так же, как это было сделано для диаграммы фазового равновесия с эвтектическим равновесием, поскольку рассмотрение возможных вариантов равновесия с учетом иного агрегатного состояния фаз в двухкомпонентной системе с позиций геометрической термодинамики практически ничего принципиально нового не содержит. Это положение наглядно иллюстрируется на примере трехфазных равновесий с участием двух жидких фаз.
Наличие двух жидких фаз в двухкомпонентной системе сопряжено с разрывом растворимости в определенном концентрационном диапазоне и появлением
двухфазного равновесия L1 L2, которое характеризуется на диаграмме фазового равновесия Τ – x куполом расслаивания, показан-
ным на рис. 5.10. В случае, когда превращающейся является одна жидкая фаза, а образующимися твердая и другая жидкая фазы, формируется монотектическое трехфазное равновесие (рис. 5.29). В случае монотектического равновесия жидкая фаза L1 занимает промежуточное положение по составу между твердым раствором α (или β) и жидкой фазой L2. Если температура плавления компонента A выше, чем у компонента В, то температура трехфазного монотек-
280
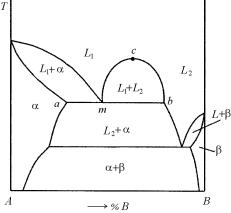
тического равновесия ТM занимает промежуточное положение между этими температурами плавления.
Рассматривая горизонталь монотектического трехфазного равновесия amn по аналогии с описанными выше эвтектическим равновесием как сочетание трех конод, получим картину относительного расположения кривых концентрационной зависимости изобарноизотермического потенциала трех равновесных фаз, аналогичную показанной на рис. 5.17. Следовательно, увеличение температуры выше монотектической, должно приводить к стабилизации двух
двухфазных равновесий L α и L1 L2. Понижение температуры ниже монотектической горизонтали должно способствовать стаби-
лизации равновесия α L2.
Принимая во внимание расслоение в жидкости и учитывая, что при определенном перегреве две жидкие фазы перейдут в одну, вместо двух кривых концентрационной зависимости G, использованных для эвтектической системы, в данном случае достаточно одной кривой для жидкой фазы – типа показанной на рис. 5.10. При этом относительные перемещения соответствующих участков этой кривой и кривой Gα = f(хB) при изменении температуры полностью аналогичны наблюдаемым в эвтектической системе. Таким образом, с позиций геометрической термодинамики монотектическое трехфазное равновесие аналогично эвтектическому.
Рассмотрим некоторые процессы, происходящие в сплавах диаграммы с монотектическим равновесием
(рис. 5.30).
Рис. 5.30. Диаграмма фазового равновесия монотектического типа
281
