
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
могут влиять на морфологию продуктов реакции. Имеются доказательства, что состав низкотемпературной β-фазы так мало отличается от состава одной из высокотемпературных фаз, что роль диффузии в процессе превращения становится очень малой. Все это способствует образованию ликвационных структур.
5.2.9. Диаграмма с синтектическим равновесием
Аналогично монотектической разновидности эвтектики существует являющаяся разновидностью перитектики синтектическая
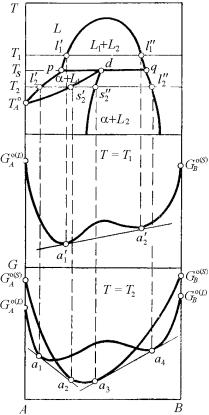
реакция L1 + L2 α. Построение диаграммы фазового равновесия синтектического типа с использованием концентрационной зависимости изобарно-изотермичес- кого потенциала приведено на рис. 5.38.
Фиксированное положение линий фазового равновесия в этой системе устанавливается в принципе так же, как в случае систем эвтектического и перитектического типов, при помощи кривых концентрационной зависимости изобарно-изотермичес- кого потенциала при различных температурах.
Рассмотрим точно так же синтектическое трехфазное равновесие, когда две жидкие фазы L1 и L2 являются превращающимися, а α-твердый раствор – образующийся. Приходим к заключению, что, во-первых, гори-
Рис. 5.38. Диаграмма фазового равновесия синтектического типа и концентрационная зависимость изобарно-изотермического потенциала жидких и твердых растворов
при температурах Т1 и Т2
291
зонталь трехфазного синтектического равновесия pdq расположена выше температуры плавления наиболее тугоплавкого компонента (например, A), а во-вторых, нагрев выше температуры синтектического трехфазного равновесия Ts приводит к стабилизации двух-
фазного равновесия L1 L2, а охлаждение ниже Ts стабилизирует
двухфазные равновесия L1 α и L2 α.
При этом относительное расположение кривой Gα = f(хB) и соответствующих участков единой кривой GL = f(хB) при cинтектической температуре аналогично показанному на рис. 5.17, б. И расположение кривых выше и ниже этой температуры воспроизводит картину, представленную на рис. 5.33,б и в для перитектической системы. Таким образом, синтектическое трехфазное равновесие с позиций геометрической термодинамики является аналогом перитектического. Отличие заключается только в агрегатном состоянии одной из трех фаз, участвующих в равновесии. В итоге общая картина фазового равновесия в окрестностях синтектической горизонтали pdq может быть представлена так, как показано на рис. 5.38.
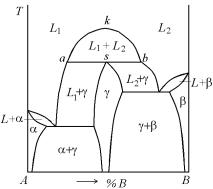
На рис. 5.39 представлен пример реальной диаграммы фазового равновесия с синтектиче-
ской реакцией L1 + L2 γ на линии аsb, в результате которой образуется промежуточное соединение γ переменного состава. Диаграмма дополнена двумя эвтектическими реакциями, это сделано произвольно и с синтектическим равновесием никак не связано. Ограниченная растворимость компонентов А и В в жидком состоянии изображается ветвями аk и bk кривой расслое-
ния аkb.В реальных металлических сплавах синтектическая реакция встречается достаточно редко, однако следует отметить, что на основе компонентов А и В образуются граничные α- и β-растворы
292
небольшой протяженности. Точка k на вершине купола расслоения называется критической. Анализ процессов кристаллизации различных сплавов не должен представлять особых трудностей, если читатель внимательно ознакомился с процессами кристаллизации сплавов, разобранными в пп. 5.2.1–5.2.8. Следует, однако, отметить, что при кристаллизации γ-фаза будет образовываться на межфазовой границе между жидкими слоями и будет препятствовать дальнейшей реакции, в результате чего заметный γ слой сможет образоваться только при очень длительной выдержке. Поэтому следует ожидать, что сплав будет затвердевать в основном в виде двух независимых частей с небольшим реакционным слоем между ними. L1 будет затвердевать как заэвтектический сплав в эвтектической системе α + γ, а L2 – как доэвтектический сплав в эвтектической системе γ + β. При изменении состава сплава от одного конца синтектической линии до другого будут изменяться только относительные количества двух жидкостей. Поэтому отличить синтектический сплав от сплавов, составы которых лежат по обе его стороны, невозможно, за исключением случая достижения истинного равновесия. Наиболее известный пример относительно редкой синтектической реакции – это система Na–Zn.
5.2.10. Диаграммы с промежуточными фазами
Промежуточными фазами называют все твердые фазы, которые образуются в интервале концентраций между граничными твердыми растворами на основе компонентов А и В (см. п. 3.3.3). Образование промежуточных твердых фаз в двухкомпонентной системе должно отразиться на диаграмме фазового равновесия. Как правило, промежуточные твердые фазы формируются на основе определенных химических соединений, которые могут плавиться конгруэнтно или распадаться в результате перитектического превращения. Построение комплексной диаграммы фазового равновесия с образованием промежуточной фазы по перитектической реакции с использованием кривых зависимости изобарноизотермического потенциала от концентрации при различных температурах показано на рис. 5.34. Когда образуются стабильные
293
промежуточные фазы, дополнительные кривые изобарно-изотерми- ческого потенциала появляются при построении диаграммы фазового равновесия.
Если в результате взаимодействия между компонентами А и В образуется химическое соединение АmBn, то оно обладает своей собственной кристаллической структурой, совершенно иной, чем у компонентов А и В. На основании этого устойчивое химическое соединение в двухкомпонентной системе следует рассматривать как самостоятельный компонент, расчленяющий данную систему на самостоятельные подсистемы.
Промежуточные фазы могут иметь постоянный или переменный состав. Промежуточные фазы постоянного состава – это определенные химические соединения компонентов (АВ, АВ2, А2В, А3В4 и т.д.), для которых характерны очень узкие области гомогенности (области существования однородного твердого раствора на основе данного химического соединения) или их отсутствие. При отсутствии области гомогенности промежуточные фазы на фазовой диаграмме изображаются вертикальными прямыми. Промежуточные фазы переменного состава имеют сравнительно широкие области гомогенности. В любом случае для промежуточной фазы характерна своя кристаллическая решетка, отличная от кристаллических решеток компонентов. При образовании областей гомогенности (т.е. твердых растворов на основе химических соединений) число атомов, приходящихся на элементарную ячейку, может быть постоянным (растворы замещения) или переменным (растворы внедрения и вычитания). Промежуточные фазы, при плавлении которых составы твердой и жидкой фаз совпадают, называются конгру-
энтно плавящимися фазами (иногда их называют фазами с от-
крытым максимумом). На рис. 5.40 приведены примеры диаграмм фазового равновесия с конгруэнтно плавящимися промежуточными фазами.
Если в качестве промежуточной фазы выступает химическое соединение АmBn постоянного состава (без области гомогенности) и между ним и компонентами А и В имеются изотермы звтектических реакций, то диаграмма фазового равновесия будет выглядеть, как на рис. 5.40,а. Обычно такие диаграммы характерны для сис-
294
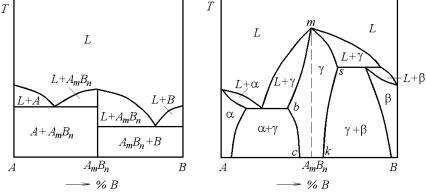
тем, образованных металлами и элементами, которые обладают и металлическими и неметаллическими свойствами. От компонентов или граничных твердых растворов на фазовой диаграмме промежуточные фазы всегда отделены двухфазными областями. Если компоненты образуют несколько промежуточных фаз, то двухфазные области имеются и между соседними промежуточными фазами.
а б
Рис. 5.40. Диаграммы фазового равновесия с конгруэнтно плавящимися промежуточными фазами, (а) без области гомогенности, (б) с наличием области гомогенности
Для другого варианта фазовой диаграммы с конгруэнтно плавящейся промежуточной γ-фазой (рис. 5.40,б) характерны сравнительно широкие области граничных α- и β-твердых растворов и растворимость компонентов А и В в химическом соединении АmBn. В результате промежуточная γ-фаза имеет переменный состав или область гомогенности cbmsk. Между α- и γ-фазами есть изотерма эвтектической реакции, а между γ- и β-фазами – изотерма перитектической реакции. Пунктиром в области гомогенности промежуточной γ-фазы показана ордината химического соединения АmBn, строго соответствующая его стехиометрическому составу. Сплавы, расположенные в γ-области левее этой ординаты, представляют собой твердые растворы компонента А в химическом соединении АmBn (иногда это трактуется как отдельная γ1-фаза), а сплавы, расположенные правее ординаты, – твердые растворы компонента В в АmBn (это иногда трактуется как вторая γ2-фаза). Как и в случае
295
промежуточной фазы постоянного состава (рис. 5.40,а) соединение АmBn, способное растворять компоненты А и В, плавится или кристаллизуется при постоянной температуре, отвечающей точке температурного максимума m.
Врассмотренных фазовых диаграммах (рис. 5.40,а и б) конгру-
энтно плавящееся химическое соединение АmBn независимо от того, образуются на его основе твердые растворы компонентов А и В или нет, выступает как самостоятельный компонент. Таким образом диаграммы фазового равновесия с конгруэнтно плавящимися промежуточными фазами можно рассматривать как комбинированные, т.е. состоящие из двух (если образуется одна промежуточная фаза) или большего числа (если образуется несколько промежуточных фаз) простых диаграмм фазового равновесия (эвтектического и перитектического типов, например, для диаграммы, приведенной на рис. 5.40,б).
Всоответствии с рис. 5.40 сплавы системы А–АmBn, расположенной слева, можно получить, беря за исходные не только компо-
ненты А и В, но и компонент А и химическое соединение АmBn. Сплавы системы АmBn–В, расположенной справа, можно получить, беря за исходные вместо компонентов А и В химическое соедине-
ние АmBn и компонент В. Таким образом каждую из простых фазовых диаграмм А–АmBn или АmBn–В можно изображать отдельно и анализировать независимо друг от друга.
Следует объяснить понятия: дальтониды и бертоллиды. По предложению известного русского ученого Н.С. Курнакова промежуточные фазы, в основе которых лежат диссоциированные химические соединения, называют химическими соединениями переменного состава или бертоллидами (в честь французского химика К.Л. Бертолле, который в свое время отрицал постоянство химического состава химических соединений). И наоборот, промежуточные фазы на основе недиссоциированных химических соединений, состав которых подчиняется закону простых (или кратных) стехиометрических соотношений, были названы дальтонидами (в честь английского ученого Д. Дальтона, утверждавшего и обосновавшего постоянство и кратность отношений в химическом составе соединений). В работах Н.С. Курнакова было показано, что для
296
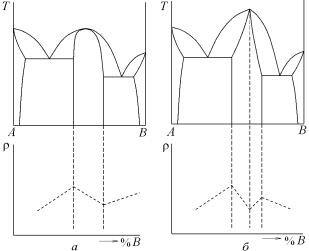
бертоллидов характерно отсутствие резких изменений свойств сплавов в области гомогенности химического соединения (рис. 5.41,а).
Рис. 5.41. Диаграммы фазового равновесия с конгруэнтно плавящимися промежуточными фазами (а) дальтониды, (б) бертоллиды и изменение свойств в области гомогенности
Бертоллидные фазы характеризуются плавным, сглаженным максимумом на кривых ликвидуса и солидуса. Максимальная точка на кривых ликвидуса и солидуса не отвечает какому-либо простому стехиометрическому отношению компонентов, характерных для дальтонидов. В этом случае к кривым ликвидуса и солидуса можно провести одну касательную. Бертоллидные фазы всегда имеют переменный состав, т.е. заметные области гомогенности.
В отличие от бертоллида характерным признаком дальтонида является сингулярная точка или резко выраженный максимум на кривых ликвидуса и солидуса промежуточной γ-фазы с острой вершиной (рис. 5.41,б ). В этом случае в вершине к линиям солидуса и ликвидуса можно провести две касательные. Сингулярные точки обнаруживаются не только на кривых плавкости, но и на диаграммах состав – свойство (например, твердость, удельное электросопротивление), построенных при разных температурах. В
297
случае недиссоциированного химического соединения АmBn сплавы, расположенные в области гомогенности промежуточной γ-фазы левее и правее стехиометрического состава химического соединения, могут заметно отличаться один от другого по своим свойствам. Эта разница в свойствах объясняется тем, что сплавы слева от состава АmBn представляют собой твердые растворы компонента А, а сплавы правее АmBn – твердые растворы компонента В в соедине-
нии АmBn.
Химический состав дальтонидных фаз подчиняется простым и кратным стехиометрическим соотношениям компонентов (1:1, 1:2, 2:3, 3:4 и др.) По рентгеновским данным дальтонидные фазы характеризуются упорядоченным расположением разноименных атомов в кристаллической решетке.
Если дальтониды – это или конгруэнтно плавящиеся промежуточные фазы, или фазы, образующиеся в твердом состоянии (упорядоченные растворы), то бертоллиды относятся как к конгруэнтно, так и к инкогруэнтно (см. далее) плавящимся промежуточным фазам. В ряде случаев отдельные бертоллидные фазы могут образовываться в твердом состоянии по перитектоидной реакции.
Промежуточные фазы, при плавлении которых состав образующейся жидкой фазы отличается от состава твердой фазы, называют
инконгруэнтно плавящимися фазами (иногда их называют некон-
груэнтно плавящимися фазами). При плавлении таких фаз, образуется новая твердая фаза, состав которой также отличается от состава исходной твердой фазы. Обычно плавление инконгруэнтно плавящейся фазы происходит по реакции, обратной перитектической.
Если химическое соединение образуется по перитектической реакции, то обоснование фазовых соотношений в окрестности изотермы перитектической реакции проводится на основе концентрационных зависимостей изобарно-изотермического потенциала (см. рис. 5.34). Принцип построения такой системы принципиально не отличается от построения простой перитектической системы, однако, когда образуется промежуточная фаза, наблюдается большее количество кривых изобарно-изотермического потенциала.
На рис. 5.42 приведены примеры диаграмм фазового равновесия с инконгруэнтно плавящимися промежуточными фазами. Инкон-
298
