
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
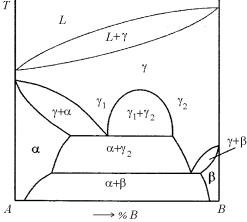
На данной диаграмме введена эвтектическая реакция при низких температурах для того, чтобы довести диаграмму до температур, где все фазы являются твердыми. Терминология, применяемая для монотектических систем, аналогична применяемой для описания эв-
тектических: точка m называется монотектической, линия amb- изотермой монотектической реакции, или монотектической лини-
ей. Граница области существования L1 + L2 называется границей жидкой несмешиваемости (или расслоения), а точка с, находящаяся на вершине купола, – критической точкой.
Процессы, происходящие в сплавах этой системы, а также монотектоидной системы при охлаждении, принципиально не отличаются от аналогичных процессов, происходящих в диаграмме эвтектического типа (см. рис. 5.21).
Пример диаграммы фазового равновесия с монотектоидным равновесием приведен на рис. 5.31.
Рис. 5.31. Диаграмма фазового равновесия с монотектоидной реакцией
5.2.7. Диаграмма с метатектическим равновесием
Реакция на линии amb (рис. 5.32) называется метатектической и записывается в виде: γ  α + L. Метатектический переводится по-гречески дословно как «плавящийся после». Очень редко это равновесие называют кататектическим, что в переводе означает «плавящийся ниже».
α + L. Метатектический переводится по-гречески дословно как «плавящийся после». Очень редко это равновесие называют кататектическим, что в переводе означает «плавящийся ниже».
282
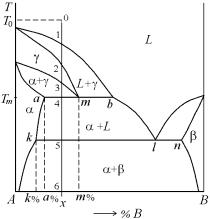
Особенность диаграммы с метатектической реакцией состоит в том, что при охлаждении некоторые сплавы этой системы (в интервале концентраций компонента В в % от k до m) вначале переходят в твердое состояние, а затем частично в жидкое. В интервале концентраций от а до m это происходит за счет метатектической реакции, а в интервале концентраций от k до m за счет наклона линии ограниченной растворимости.
Подробнее остановимся на структурообразовании в сплаве х при охлаждении из жидкого состояний от точки 0 (температура T0). При охлаждении от точки 0 до точки 1 будет происходить охлаждение сплава в жидком состоянии. В точке 1 начнется процесс кристаллизации с выделением кристаллов γ-фазы, в интервале температур от точки 1 до точки 2 будет продолжаться процесс кристаллизации с выделением кристаллов γ-фазы, и в точке 2 процесс кристаллизации будет завершен. При охлаждении от точки 2 до точки 3 будет происходить охлаждение твердого сплава, состоящего из кристаллов γ-фазы. В точке 3 при охлаждении начнется выделение кристаллов α-фазы из γ-фазы. При охлаждении от точки 3 до точки 4 будет происходить вторичная кристаллизация с выделением твердых кристаллов α-фазы из γ-фазы: γ → αII. Перед началом метатектической реакции можно подсчитать количество α- и γ-фаз.
При температуре Tm происходит метатектическая реакция γm → →αa + Lb, в которую вовлекается все существующее количество γ-фазы, т.е. сплав частично расплавляется. Количество образовавшейся жидкости L нетрудно рассчитать, поскольку мы знаем количество γ-фазы перед началом метатектической реакции и количество жидкости, образовавшейся по этой реакции. В нашем случае количество жидкости будет не менее 20 % от массы сплава. При ох-
283
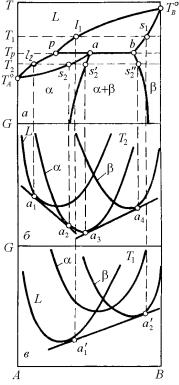
лаждении сплава в интервале температур от точки 4 до точки 5 будет происходить охлаждение сплава х с кристаллизацией и незначительным выделением α-фазы из жидкости, что обусловлено взаимными наклонами кривых bl и ak. При температуре точки 5 происходит эвтектическая реакция L → α + β, в результате которой заканчивается процесс кристаллизации, и далее при охлаждении от точки 5 до точки 6 происходит процесс охлаждения сплава в твердом состоянии. При этом возможны процессы вторичной кристаллизации α → βII и β → αII, вследствие различных наклонов линий ограниченной растворимости компонентов В в А и А в В.
5.2.8. Диаграммы с перитектическим и перитектоидным равновесиями
Эвтектическое превращение в двойной системе заключается в распаде раствора при охлаждении на две другие фазы; перитектическое пре-
вращение, наоборот, представляет собой процесс образования одной фазы за счет взаимодействия двух других фаз, полностью или частично исчезающих при этом. Эта реакция записывается следующим образом:
α + L β или β + L α.
Построение диаграммы фазового равновесия с перитектической реакцией будет рассмотрено на примере двух диаграмм перитектического типа
(рис. 5.33 и 5.34).
Рис. 5.33. Диаграмма фазового равновесия перитектического типа (а) и концентрационная зависимость изобарно-изотермического потенциала жидких и твердых растворов при температурах Т1 и Т2 (б и в)
284
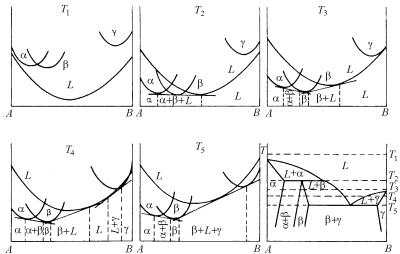
Рис. 5.34. Кривые изобарно-изотермического потенциала жидких и твердых растворов при температурах Т1, Т2, Т3, T4, Т5 и диаграмма фазового равновесия с образованием промежуточной фазы по перитектической реакции
Если в системе имеется трехфазное перитектическое превращение, то можно конкретно судить об его расположении по температуре относительно точек плавления компонентов, т.е. температура трехфазного перитектического превращения будет занимать промежуточное положение между температурами плавления A и В. Следовательно, рассматривая вопрос о фазовых соотношениях в двухкомпонентной системе при трехфазном перитектическом превращении, мы можем нанести на диаграмму Τ–x положение перитектической горизонтали и обозначить температуры плавления компонентов A и В. Положение перитектической горизонтали обосновано при помощи кривых концентрационной зависимости изобарно-изотермического потенциала (см. рис. 5.17).
Анализ физико-химической сущности трехфазного перитектического равновесия дает основание считать, что оно так же, как и эвтектическое трехфазное равновесие, представляет собой сочетание
тех же трех двухфазных равновесий L α, L β и α β, однако в данном случае промежуточное по составу положение занимает α- фаза, тогда как в случае эвтектического превращения это положе-
285
ние занимала жидкая фаза. Естественно, что роль α-фазы при перитектическом превращении существенно иная, поскольку жидкая фаза в случае эвтектического превращения является превращающейся, а α-фаза – образующейся. Поэтому при охлаждении ниже температуры перитектического превращения α-фаза стабилизируется, тогда как жидкая фаза при охлаждении ниже температуры эвтектики исчезает. Это, по существу, обусловливает характер смещения концентрационной зависимости кривой изобарноизотермического потенциала α-фазы при изменении температуры относительно перитектической горизонтали.
Учитывая сказанное, перитектическую горизонталь раb можно рассматривать как совокупность трех конод pb, ра и ab, что отчетливо видно по наличию общей касательной к кривым изобарноизотермического потенциала всех трех фаз на рис. 5.17.
Можно сделать заключение, что с ростом температуры выше Тр
будет стабилизироваться двухфазное равновесие L β, тогда как при понижении температуры ниже Тр в соответствующих концентрационных диапазонах стабильными будут два других двухфаз-
ных равновесия L α и α β.
На диаграмме изобарно-изотермический потенциал – состав (см. рис. 5.33) это будет выражаться в относительном смещении кривых концентрационной зависимости G для каждой из рассматриваемых фаз. Поскольку α-фаза является образующейся при охлаждении, кривая изобарно-изотермического потенциала этой фазы в случае понижения температуры, например до Т2 (рис. 5.33,а), сместится вниз, так что минимум этой кривой окажется ниже минимума, по крайней мере, одной из кривых концентрационной зависимости G для двух других фаз (рис. 5.33,б). При повышении температуры, например, до T1 (рис. 5.33,а), кривая Gα = f (xB) сместится вверх так, как это показано на рис. 5.33,в. Учитывая изложенные соображения об относительном расположении кривых G = f (xB) для трех фаз, составляющих перитектическое равновесие, при повышении и понижении температуры следует в каждом случае для определения составов равновесных фаз проводить возможные общие касательные к кривым концентрационной зависимости изобарно-изотермических потенциалов соответствующих фаз. Проектируя составы, отвечающие точкам
286
касания а′1 и a′2 к температуре T1 на диаграмме Τ – x, получим фиксированное положение коноды 11s1, определяющей сопряженные точки на кривых ликвидуса и солидуса при данной температуре. Аналогич-
но при других температурах в интервале Тр–TBo можно воспроизвести целиком кривые ликвидуса и солидуса, ограничивающие область
двухфазногоравновесия L β.
При температуре T2 < Тр относительное расположение кривых концентрационной зависимости изобарно-изотермического потенциала таково (см. рис. 5.33,б), что к ним можно провести две общие касательные а1–а2 и а3–а4. Проектируя общую касательную а3 –a4 к температуре Т2 на диаграмме Τ–x, получим положение коноды s′2– s′′2, определяющей составы равновесных фаз α и β при данной температуре. Изменяя температуру в пределах между Тр и ТА, можно описанным путем воспроизвести кривые ликвидуса и солидуса, ограничивающие интервал устойчивости двухфазного равновесия
α L, и соответствующие участки кривых сольвуса, ограничи-
вающие положение области двухфазного равновесия α β. В результате описанных построений на плоскости Τ–x воспроизводится диаграмма фазового равновесия перитектического типа (рис. 5.33,а), которая наряду с эвтектической является важнейшей типовой диаграммой, поскольку иллюстрирует одно из главных типовых сочетаний трехфазного равновесия с соответствующими двухфазными.
На рис. 5.34 показано построение комплексной диаграммы фазового равновесия с образованием промежуточной фазы по пери-
тектической реакции L + α β. На этом рисунке хорошо представлена связь между перитектической реакцией и кривыми изобарноизотермического потенциала, особенно при температурах Т3 и Т4.
Рассмотрим процессы при охлаждении сплавов в диаграмме перитектического типа (рис. 5.35). В частности, рассмотрим ход затвердевания перитектического сплава состава х2. При охлаждении из полностью жидкого состояния кристаллизация начинается по достижении кривой ликвидус при температуре T2, при которой на чинают образовываться кристаллы α-фазы.
287
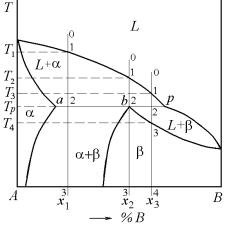
Состав жидкости по мере уменьшения температуры перемещается вниз по линии ликвидус. Состав α-фазы, изменяющейся вдоль линии солидус, достигает точки а, а состав жидкой фазы будет определяться точкой p. При температуре Tp происходит перитектическая реакция: αa + Lp → βb. В условиях равновесия затвердевание должно быть завершено изотермически, и вся α-фаза, равно как и жидкость, будут исчерпаны.
Рис. 5.35. Диаграмма фазового равновесия перитектического типа
Если состав сплава взят левее перитектической точки, например х1, то в этом случае α-фаза не будет полностью израсходована на образование β-фазы. Если состав сплава лежит правее перитектической точки, например сплав состава х3, то после перитектической реакции будет оставаться избыток жидкости, количество которой легко рассчитывается по правилу отрезков. В интервале температур происходит полная кристаллизация с выделением кристаллов β- фазы.
Следует отметить, что при затвердевании в реальных условиях перитектических сплавов отмечаются существенные отклонения от равновесия. Это вызвано тем, что продукт реакции β-фаза обязательно образуется на поверхности раздела между α-фазой и жидкостью, становясь препятствием для диффузии, которая необходима для продолжения реакции (рис. 5.36).
288
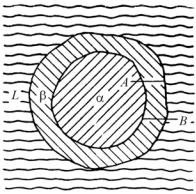
Чтобы превратить α-фазу в β- фазу, атомы должны диффундировать из α-фазы и заменяться атомами В, которые по необходимости должны поступать из жидкости. Все эти атомы должны пройти через β-зону. По мере утолщения β-слоя расстояние, на которое должны транспортироваться эти атомы, увеличивается. Таким образом, первый слой β- фазы образуется быстро, но его рост идет с убывающей скоростью, так что часто реакция оказывается незавершенной даже после того, как температура упала ниже перитектической и стала
Рис. 5.36. Схема перитектической реакции между первичной α-фазой и жидкостью L с образованием оболочки β-фазы. Реакция развивается благодаря диффузии атомов А наружу, а атомов В – внутрь, сквозь оболочку
настолько низкой, что дальнейшая диффузия практически исключена. Поэтому сплавы, участвующие в перитектической реакции, чрезвычайно склонны к ликвации и химическая неоднородность наблюдается и в α-, и в β-фазах.
Нужно отметить, что хотя и эвтектические и перитектические структуры состоят из двух фаз, они легко различаются по внешнему виду, так как перитектика не имеет двухфазных составляющих, и в перитектическом сплаве ликвированными могут быть обе фазы.
Перитектоидная реакция относится к перитектической так же, как эвтектоидная реакция относится к эвтектической. В перитекто-
идной реакции участвуют только твердые фазы: γ + α β. Приме-
ры диаграмм с перитектоидным превращением приведены на рис. 5.37.
На рис. 5.37,а приведена диаграмма с перитектоидной реакцией при температуре T1, обязательным условием существования которой является полиморфизм компонентов А и В. На рис. 5.37,б при-
ведена диаграмма с перитектической реакцией γ + L α при температуре T1 и перитектоидной реакцией γ + α β при температуре
289
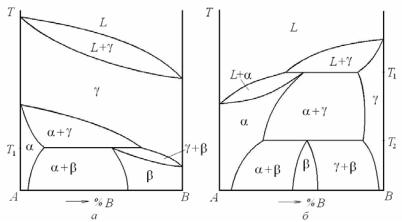
T2. В результате перитектоидной реакции образуется промежуточное соединение с областью гомогенности β. (О промежуточных соединениях и связанной с ними терминологией будут приведены данные в п. 5.2.10 этой главы).
Рис. 5.37. Примеры диаграмм фазового равновесия с перитектоидным превращением при температуре Т1 (а) и Т2 (б)
Хотя перитектоидная реакция является обычной для металлических систем, среди технических сплавов она встречается достаточно редко и опытных данных о ее поведении мало. Основываясь на подобии перитектоидной и перитектической реакций можно ожидать, что перитектоидное превращение будет очень медленным. Реакция между высокотемпературными α- и γ-фазами при охлаждении должна протекать на межфазовой границе, где должен образовываться слой низкотемпературной β-фазы. Для продолжения реакции необходима диффузия через растущий слой β при относительно низкой температуре, где скорости диффузии малы. Поэтому можно ожидать, что по достижении комнатной температуры превращение будет неполным. Имеющиеся экспериментальные данные указывают на существование ряда дополнительных трудностей при прохождении перитектоидной реакции. Во-первых, превращение может проходить через серию нестабильных состояний, которые меняют его механизм и скорость. Во-вторых, кристаллографические факторы, влияющие на направление диффузии и рост фаз,
290
