
- •Учебник подготовлен в рамках Инновационной образовательной программы
- •ISBN 978-5-7262-0821-3
- •5.1. Однокомпонентные диаграммы фазового равновесия,
- •5.2.1. Диаграмма с полной взаимной растворимостью
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.5. Диаграммы с эвтектическим и эвтектоидным
- •5.2.6. Диаграммы с монотектическим и монотектоидным
- •5.2.8. Диаграммы с перитектическим и перитектоидным
- •7.1. Физико-химические основы взаимодействия
- •7.1.4. Роль термодинамики и химической кинетики
- •7.2.3. Пленки на металлах как продукты химической
- •7.2.9. Формирование защитных жаростойких пленок
- •7.2.10. Влияние внешних и внутренних факторов
- •7.3.3. Механизм электрохимической коррозии. Работа
- •7.3.4. Гетерогенность поверхности и микрогальванические
- •7.3.7. Термодинамика процессов электрохимической
- •7.4.3. Влияние примесей в жидких металлах
- •7.4.4. Основные пути снижения взаимодействия
- •конструкционных материалов с жидкометаллическими
- •7.5. Защита от коррозии на стадии проектирования и разработки
- •Предисловие к тому 2
- •Глава 4. ТЕРМОДИНАМИКА В МАТЕРИАЛОВЕДЕНИИ
- •Введение.
- •4.1. Основные понятия термодинамики
- •4.2. Метод термодинамических потенциалов
- •4.3. Прикладная термохимия
- •4.4. Фазовые равновесия
- •4.5. Термодинамика растворов
- •4.6. Физическая химия неидеальных растворов
- •4.7. Термодинамическая теория диаграмм состояния
- •Список использованной литературы
- •Глава 5. ДИАГРАММЫ ФАЗОВОГО РАВНОВЕСИЯ
- •Введение
- •5.2.2. Диаграмма с расслоением твердого раствора
- •5.2.3. Диаграмма с наличием упорядочения
- •5.2.4. Диаграммы с наличием трехфазного равновесия
- •5.2.7. Диаграмма с метатектическим равновесием
- •5.2.9. Диаграмма с синтектическим равновесием
- •5.2.10. Диаграммы с промежуточными фазами
- •5.3. Диаграмма железо – углерод
- •5.4. Анализ сложных диаграмм фазового равновесия
- •Контрольные вопросы
- •Список использованной литературы
- •6.4. Закономерности сегрегации примесей
- •Контрольные вопросы
- •Список использованной литературы
- •Глава 7. СОВМЕСТИМОСТЬ И КОРРОЗИЯ МАТЕРИАЛОВ
- •7.1.1. Совместимость материалов со средой
- •7.1.2. Коррозия. Основные понятия и определения
- •7.1.3. Коррозионные проблемы
- •7.1.5. Классификация процессов коррозии
- •7.2. Химическая коррозия металлов
- •7.2.1. Химическая газовая коррозия
- •7.2.4. Состав и структура оксидов. Эпитаксия
- •7.2.5. Толщина и защитные свойства пленок
- •7.2.7. Механизм химической газовой коррозии
- •7.2.8. Оксидные пленки на поверхности железа
- •7.2.11. Химическая коррозия в газовых теплоносителях
- •7.3. Электрохимическая коррозия
- •7.3.1. Основные признаки и причины
- •7.3.2. Электролиты
- •7.3.6. Электродные потенциалы
- •7.3.8. Диаграммы Пурбе
- •7.3.9. Кинетика электрохимических процессов коррозии
- •7.3.10. Электрохимическая защита
- •7.4. Коррозия в жидкометаллических средах
- •7.4.1. Типы процессов
- •7.4.2. Растворение твердого металла в жидком
- •7.5. Защита от коррозии на стадии проектирования
- •7.5.1. Коррозия и вопросы конструирования
- •7.5.2. Выбор материалов и их совместимость
- •7.5.3. Выбор рациональной формы элементов
- •7.5.4. Учет влияния механических нагрузок
- •7.5.5. Рациональные способы сборки конструкций
- •Контрольные вопросы
- •Список использованной литературы
ориентированные молекулы растворителя. Строение д.э.с. существенно влияет на электрохимические реакции при электролизе, в коррозионных процессах и химических источниках тока.
7.3.6. Электродные потенциалы
Переход металла в раствор и обратно создает на границе между ними разность потенциалов, что связано с образованием д.э.с. Систему металл–раствор, содержащий его ионы, принято называть электродом, а разность (скачок) потенциалов между металлом и раствором – электродным потенциалом.
По мере перехода ионов металла в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует окислению металла и появлению обратного процесса – восстановления ионов металла до атомов. При некотором значении электродного потенциала, когда скорость процесса окисления будет равна скорости обратного процесса – восстановления, установится равновесие
Me Mez + + ze− . |
(7.31) |
Потенциал, устанавливающийся в условиях динамического равновесия электродной реакции, называется равновесным или обра-
тимым электродным потенциалом. При этом плотность анодного тока (ja) становится равной плотности катодного тока (jk):
ja = jk= j0,
где j0 – плотность тока обмена, которая характеризует скорость процесса постоянного обмена ионами между металлом и раствором. Она зависит от материала электродов и реакций на них.
Равновесный электродный потенциал зависит от природы металла и растворителя, температуры электролита, активности ионов металла. Величину такого потенциала (φ) можно рассчитать по
уравнению Нернста: |
RT |
|
|
|
|
ϕ = ϕo + |
ln a |
|
z+ , |
(7.32) |
|
|
Me |
||||
|
zF |
|
|
||
где φ° – стандартный потенциал металла, В; z – степень окисления металла; aMe z+ – активность ионов металла, г-ион/л.
517
Подставив в приведенное уравнение (7.32) значения всех кон-
стант при 25 ºС (R = 8,314 Дж/(моль·К), T = 298,2 К и F = 96500 Кл)
и переходя от натуральных логарифмов к десятичным, получим:
ϕ = ϕo + |
0,059 lg a |
|
z+ , |
(7.33) |
|
z |
Me |
|
|
При активности ионов металла в растворе равной единице второй член уравнения Нернста превращается в нуль, и электродный потенциал становится равным стандартному потенциалу.
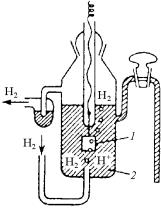
Измерить абсолютное значение любого электродного потенциала в настоящее время технически невозможно, но можно определить разность потенциалов (ЭДС) измеряемого электрода и электрода сравнения, потенциал которого равен нулю. За основной электрод сравнения принят стандартный водородный электрод
(рис. 7.31) из платинированной платины (на поверхность платины для увеличения ее площади наносится слой высокодисперсной платины, называемой платиновой чернью), погруженный в раствор кислоты с активностью ионов H+, равной 1 г-ион/л.
Через раствор под давлением в 1 атм продувается водород, адсорбирующийся на поверхности платиновой пластины. Взаимодействуя с молекулами воды, водород переходит в раствор в виде ионов, оставляя в платине электроны. Платина при этом заряжается отрицательно, а раствор – положительно. Между платиной и раство-
ром возникает скачок потенциала. Одновременно идет обратный процесс восстановления ионов H+ с образованием молекул водорода, который в виде пузырьков газа удаляется из системы. За величину стандартного электродного потенциала металла (металлоида) принимают ЭДС, возникающую в цепи (гальваническом элементе) «водородный электрод»–металл, погруженный в раствор своей соли с активностью одноименных ионов металла (металлоида), рав-
518
ной единице. Стандартный электродный потенциал представляет собой частный случай равновесного потенциала.
Гальванический элемент принято записывать так, чтобы электрод сравнения всегда был слева, а за ЭДС ячейки принимать разность потенциалов правого и левого электродов, т.е. E = ϕп −ϕл .
Если левым служит стандартный водородный электрод ( pH 2 = 1 атм, аH + =1 ), то ЭДС элемента равна по величине и по знаку электрод-
ному потенциалу правого (исследуемого) электрода по «водородной шкале», т.е. E = ϕп .
ЭДС элемента считают положительной, если положительные заряды внутри цепи перемещаются слева направо, при этом
Emax = − |
GT /(mnF) , |
(7.34) |
а при противоположном направлении – отрицательной. |
|
|
Emax = + |
GT /(mnF) , |
(7.35) |
Реакции, приводящие к возникновению электродного потенциала, всегда записывают так, чтобы в левой части уравнения находились окисленные компоненты (переходные вещества), а в правой части – восстановленные (продукты реакции), т.е. как реакции вос-
становления, например: H+ + e− → H или Zn2+ + 2e− → Zn . Это согласуется с тем, что потенциал определяется как работа, необходимая для перенесения единичного положительного заряда в точку, потенциал которой определяют.
Если, например, исследуемым электродом является цинк, то он имеет отрицательный потенциал восстановления и является отрицательным полюсом гальванического элемента, где в качестве второго электрода использован стандартный водородный электрод.
В реальных условиях коррозии металла в обменных реакциях на электродах участвуют не только ионы металла, но и другие компоненты раствора, которые могут образовывать на поверхности металла пленки труднорастворимых соединений (например, гидроксидов, фосфатов, сульфатов и др.), затрудняющих доступ электролита к металлу. Это приводит к установлению неравновесных или необратимых потенциалов, которые с течением времени могут устанавливаться на вполне определенном значении. Они в отличие от
519
стандартных называются стационарными. В этом случае скорости переноса зарядов с металла в электролит и в обратном направлении равны, однако баланс вещества при этом не соблюдается и уравнение Нернста для их определения неприменимо. Значения неравновесных электродных потенциалов определяют экспериментально в зависимости от внутренних (связанных с металлом) и внешних (связанных с электролитом и физическими условиями) факторов. Значения стандартных (нормальных) потенциалов для ряда металлов приведены в табл. 7.10.
Таблица 7.10
Стандартные электродные потенциалы некоторых элементов в водных растворах при 25 ºС
Электрод |
Электродная |
Eo, |
Электрод |
Электродная |
Eo, |
|
реакция |
В |
|
реакция |
В |
Li+ | Li |
Li+ + e– = Li |
–3,04 |
Cr3+ | Cr |
Cr2+ + 3e– = Cr |
–0,74 |
Rb+ | Rb |
Rb+ + e– = Rb |
–2,92 |
Fe2+ | Fe |
Fe2+ + 2e– = Fe |
–0,44 |
K+ | K |
K+ + e– = K |
–2,92 |
Cd2+ | Cd |
Cd2+ + 2e– = Cd |
–0,403 |
Ba2+ | Ba |
Ba2+ + 2e– = Ba |
–2,90 |
Mn3+ | Mn |
Mn3++ 3e– = Mn |
–0,283 |
Ca2+ | Ca |
Ca2+ + 2e– = Ca |
–2,87 |
Co2+ | Co |
Co2+ + 2e– = Co |
–0,27 |
Na+ | Na |
Na+ + e– = Na |
–2,71 |
Ni2+ | Ni |
Ni2+ + 2e– = Ni |
–0,24 |
Mg2+| Mg |
Mg2++ 2e– = Mg |
–2,38 |
Sn2+ | Sn |
Sn2+ + 2e– = Sn |
–0,136 |
Be2+ | Be |
Be2+ + 2e– = Be |
–1,85 |
Pb2+ | Pb |
Pb2+ + 2e– = Pb |
–0,126 |
U3+ | U |
U3+ + 3e– = U |
–1,80 |
Fe3+ | Fe |
Fe3+ + 3e– = Fe |
–0,036 |
Hf4+ | Hf |
Hf4+ + 4e– = Hf |
–1,70 |
H+ | H2, Pt |
H+ + e– = ½ H2 |
0,000 |
Al3+ | Al |
Al3+ + 3e– = Al |
–1,66 |
Cu2+ | Cu |
Cu2+ + 2e– = Cu |
+0,337 |
Ti2+ | Ti |
Ti2+ + 2e– = Ti |
–1,63 |
Cu+ | Cu |
Cu+ + e– = Cu |
+0,52 |
Zr4+ | Zr |
Zr4+ + 4e– = Zr |
–1,53 |
Hg22+| Hg |
Hg22++2e–= 2Hg |
+0,798 |
U4+ | U |
U4+ + 4e– = U |
–1,50 |
Ag+ | Ag |
Ag+ + e– = Ag |
+0,799 |
Pu4+ | Pu |
Pu4+ + 4e– = Pu |
–1,28 |
Hg2+ | Hg |
Hg2+ + 2e– = Hg |
+0,854 |
Ti3+ | Ti |
Ti3+ + 3e– = Ti |
–1,21 |
Br–| Br2, Рt |
Br2 + 2e–= 2Br– |
+1,066 |
Mn2+| Mn |
Mn2++ 2e– = Mn |
–1,18 |
Pt2+ | Pt |
Pt2+ + 2e– = Pt |
+1,188 |
Nb3+ | Nb |
Nb3+ + 3e– = Nb |
–1,10 |
Cl–| Cl2, Pt |
Cl2 + 2e–= 2Cl– |
+1,359 |
Zn2+ | Zn |
Zn2+ + 2e– = Zn |
–0,76 |
Au3+ | Au |
Au3+ + 3e– = Au |
+1,50 |
|
|
|
520 |
|
|
С термодинамической точки зрения, табл. 7.10 показывает изменение свободной энергии при восстановлении или окислении ионов в растворах водородом. При реакции
Mez |
|
п |
H |
|
Me |
|
пH |
(7.36) |
(раствор) |
2 |
|
2(газ) |
|
(тв.) |
(раствор) |
|
|
это изменение определяется соотношением
G n G |
G |
|
n |
G |
G |
z . (7.37) |
|
||||||
H |
Me(тв.) |
2 |
H2 (газ) |
Me |
|
|
Поскольку величины G для элементов в стандартных условиях принимаются равными нулю, то
G n GH GMez .
Подобно тому, как условились считать равным нулю стандартный водородный потенциал, то и GH 0 , и G GMez .
Так как данные табл. 7.10 эквивалентны данным свободных энергий ионов, то они могут быть использованы для расчетов равновесий. Стандартная свободная энергия иона может быть определена из уравнения
Gi zi E F,
где zi – заряд иона, E – ЭДС. Таким образом, с помощью таблицы можно определить направление реакций в растворах.
Табл. 7.10 характеризует тенденцию металлов и металлоидов переходить в раствор в виде ионов. Металлы, стоящие в таблице выше водорода, заряжаются отрицательно по отношению к водородному электроду, а ниже – положительно, при условии равенства единице активностей всех ионов, участвующих в реакции.
Металлы, стоящие в таблице выше водорода являются менее благородными по сравнению с расположенными ниже и вытесняют из раствора металлы или металлоиды с меньшими значениями нормального потенциала. Табл. 7.10 представляет собой ряд, в котором сверху вниз уменьшается восстановительная и увеличивается окислительная способность элементов. Этот ряд, называемый рядом стандартных потенциалов или рядом напряжений, показывает, что элементы, у которых φo более отрицательны, будут про-
521

являть себя как восстановители по отношению к стоящим ниже элементам. Самым сильным из всех восстановителей, указанных в таблице, является литий, а самым слабым – золото. И так как с увеличением восстановительных свойств уменьшаются окислительные, то можно добавить: самым сильным окислителем будут ионы золота, а самым слабым – ионы лития.
Из двух металлов, составляющих гальванический элемент, анодом является более активный металл в ряду напряжений при условии, что активности ионов в равновесии с одним и другим металлами равны единице.
Какими физическими факторами определяется место элемента в ряду стандартных потенциалов?
Так как стандартный потенциал определяется изменением свободной энергии при реакции взаимодействия металла (металлоида) с водородом
Mez + + 2z H2(газ) = Me(тв.) + zH+ ,
то Go = −zFEo .
Для выяснения составных частей этой величины разделим рассматриваемую реакцию на ряд элементарных процессов. Так как реакция протекает при сравнительно низкой температуре (25 ºС),
оценивая величину Go ,можно пренебречь изменением энтропии
So в |
уравнении Go = H o −T S o и |
приближенно считать |
||
Go = |
H o . |
Для осуществления |
реакции |
необходимо затратить |
энергию Eд |
(энтальпия системы |
H > 0 ) на диссоциацию молеку- |
||
лы водорода на атомы. Превращение атома водорода в ион сопровождается затратой энергии UH+ (энтальпия системы уменьшается
H < 0 ), носящей название потенциала ионизации. При переходе иона водорода в раствор выделяется теплота его гидратации HH+ .
При одновременном восстановлении иона металла сначала затрачивается энергия, соответствующая его теплоте гидратации HMe z+ .
Затем выделяется энергия, соответствующая потенциалу ионизации UMez+ при превращении иона в атом. Наконец, при образова-
522
нии кристаллической решетки из атомов освобождается энергия, соответствующая теплоте сублимации Uо (или Но).
Таким образом,
Go = −z(− |
1 |
Eд −U |
H |
+ + H |
H |
+ − H |
Me |
z+ +U |
Me |
z+ +Uo ) . (7.38) |
|
2 |
|
|
|
|
|
Три первые члена в уравнении (7.38) относятся к водороду и, следовательно, одинаковы при реакциях со всеми элементами. Поэтому стандартный потенциал металла или металлоида определяется последними тремя членами уравнения. Наибольшее влияние на
величину Go оказывает потенциал ионизации. Чем благороднее металл, тем выше его потенциал ионизации, т.е. тем труднее вырвать из его атомов электроны.
Теплота гидратации иона зависит от его заряда и радиуса. Чем меньше потенциал ионизации и чем больше теплота гидратации, тем легче металл переходит в раствор. Так, наибольшим стандартным потенциалом характеризуется литий – металл с малым потенциалом ионизации. Из-за малого радиуса литий имеет сильное электрическое поле и поэтому энергично притягивает дипольные молекулы воды, что сопровождается значительным выделением тепла (гидратации). Литий, таким образом, наименее благородный металл. Наиболее благородные металлы располагаются в конце ряда напряжений.
Склонность некоторых металлов образовывать поверхностные пленки может изменить положение металла в ряду напряжений. Эти пленки сдвигают измеряемый потенциал в положительном направлении. О металле, находящемся в таком состоянии, говорят, что он пассивен. Например, Cr в ряду напряжений расположен рядом с Zn, но во многих водных растворах, насыщенных воздухом, из-за образования на его поверхности пассивной пленки, по окислительным свойствам ближе к серебру. Находясь в паре с железом, хром становится катодом и ускоряет коррозию железа. В активном состоянии, например, в HCl, происходит переполюсовка, и Cr становится анодом по отношению к железу.
523
7.3.7. Термодинамика процессов электрохимической коррозии металлов
Принципиальная возможность или невозможность самопроизвольного протекания процессов электрохимической или химической коррозии металлов определяется знаком изменения свободной энергии процесса. Процесс электрохимической коррозии термодинамически возможен при соблюдении условия
|
|
GT = −nET F < 0 , |
(7.39) |
где |
GT – изменение энергии Гиббса, Дж; n – число электронов |
||
или |
химических |
эквивалентов, участвующих |
в реакции; |
ET |
= (ϕк)обр − (ϕа )обр |
– ЭДС гальванического (или микрогальвани- |
|
ческого) элемента, в котором обратимо осуществляется данный коррозионный процесс; (ϕк)обр – обратимый потенциал катодной
реакции в данных условиях; (ϕа )обр = (ϕМе)обр – обратимый потен-
циал металла (анода) в данных условиях.
Самопроизвольное протекание электрохимического коррозионного процесса возможно, если обратимый (равновесный) потенциал анодной реакции ионизации металла (ϕМе)обр окажется отрица-
тельнее обратимого потенциала какой-либо катодной реакции (например, восстановления кислорода (ϕО2 )обр )
(ϕМе)обр < (ϕO2 )обр .
Установившийся в этом случае стационарный потенциал систе-
мы займет промежуточное положение: |
|
(ϕМе)обр < ϕкор < (ϕO2 )обр . |
(7.40) |
Это означает, что для электрохимического растворения металла необходимо присутствие в электролите окислителя – деполяризатора, обратимый окислительно-восстановительный потенциал которого положительнее обратимого потенциала металла в данных условиях. В этом случае ET > 0 , а GT < 0 , т.е. чем больше ЭДС
любого гальванического элемента, тем больше термодинамическая возможность протекания его суммарной реакции.
524
