
Маругин, В..А. Неорганическая химия
.pdf
Глава 8. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Изучить. Хомченко, стр. 193 – 208; Глинка, стр. 563 – 584.
Вопросы для подготовки
1.Понятие о комплексных соединениях.
2.Строение комплексных соединений. Комплексообразователь, лиганды, координационное число.
3.Образование комплексных соединений.
4.Диссоциация комплексных соединений. Понятие о константе нестойкости комплексных соединений.
5.Названия комплексных соединений.
6.Значение комплексных соединений в химии и биологии.
В природе существуют химические соединения различного состава. Одни из них образуются обычным путем, за счет взаимодействия электронов с образованием ковалентной или ионной связи. Это соединения первого порядка: кислоты, основания, соли.
Однако имеются химические соединения, которые образуются за счет взаимодействия нейтральных молекул, без участия электронов. Например, двойные соли KCr(SO4)2, кристаллогидраты CuSO4·5H2O. Они относятся к соединениям высшего порядка. Эти соединения в воде диссоциируют на обычные ионы:
KCr(SO4)2 |
K+ + Cr3+ + 2SO42– |
CuSO4·5H2O |
Cu2+ + SO42– + 5H2O |
Другая группа соединений высшего порядка имеет более сложный состав, поэтому при диссоциации они дают сложные, так называемые комплексные ио-
ны:
K3[Fe(CN)6]  3K+ + [Fe(CN)6]3–.
3K+ + [Fe(CN)6]3–.
Молекулярные соединения такого типа называются комплексными.
181
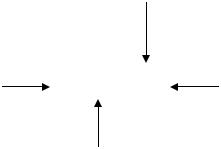
Строение комплексных соединений
В химии комплексных соединений большая роль принадлежит координационной теории, предложенной А.Вернером (1893). В настоящее время, на основании современного учения о строении атома, она получила новое содержание, но основные положения ее дают возможность говорить о составе, свойствах и строении комплексных соединений.
Суть теории можно свести к следующим положениям: 1) центральное место занимает комплексообразователь – обычно металл (чаще всего d-элемент–
Ag+, Au+, Cu2+, Cd2+, Hg2+, Pd2+, Pt2+, Fe2+, Fe3+, Co2+, Zn2+, Al3+, Cr3+); 2) вокруг
комплексообразователя расположены лиганды (нейтральные полярные молекулы или ионы противоположного знака - NH3, NO, CN , CNS , NO2 , F , Cl , Br , J , OH , S2O32 ); 3) комплексообразователь и лиганды образуют внутреннюю координационную сферу; 4) число лигандов, способных удерживаться данным комплексообразователем, определяется координационным числом комплексообразователя (оно чаще всего имеет значение в два раза больше, чем заряд комплексообразователя); 5) внутренняя координационная сфера обычно имеет заряд; 6) ионы, нейтрализующие этот заряд и не входящие во внутреннюю коор-
динационную сферу, располагаются во внешней координационной сфере.
лиганды
внешняя |
|
K3[Fe(CN)6] |
координационное |
|
|
||||
координационная |
|
число |
2,4,6 |
|
сфера |
|
|
|
|
|
|
комплексообразователь |
|
|
182
Получение комплексных соединений
Для написания формулы комплексного соединения необходимо знать: 1) комплексообразователь и его заряд; 2) координационное число комплексообразователя; 3) формулу лиганда и его заряд.
Пример 1. При взаимодействии хлорида цинка ZnCl2 с избытком роданида калия KSCN образуется комплексное соединение. Напишите уравнение реакции.
Решение. Пишем уравнение реакции ZnCl2 + 2KSCN = Zn(SCN)2 + 2KCl.
В этом уравнении не учитывается, что при избытке KSCN образуется комплексное соединение.
Для написания комплексного соединения находим комплексообразователь – Zn2+, координационное число которого 4. В данной реакции лигандами будут ионы SCN . Комплексообразователь Zn2+ и лиганды SCN образуют комплексный ион [Zn(SCN)4]2 . Во внешней координационной сфере будут располагаться ионы противоположного знака – K+.
ZnCl2 + 4KSCN = K2 [Zn(SCN)4] + 2KCl .
Пример 2. При взаимодействии хлорида меди CuCl2 с избытком концентрированного гидроксида аммония NH4OH образуется комплексное соединение. Напишите уравнение реакции.
Решение. Пишем уравнение реакции:
CuCl2 + 2NH4OH = Cu(OH)2↓ + 2NH4Cl.
В этом уравнении не учитывается, что в концентрированном растворе аммиака имеется большое количество молекул NH3. Ионы Cu2+, как комплексообразователи, могут образовывать комплексный ион с полярными молекулами
NH3:
Cu2+ + 4NH3 → [Cu(NH3)4]2+.
Комплексный ион имеет положительный заряд, следовательно, во внешней координационной сфере должны находиться отрицательно заряженные ионы, в данном случае ионы Cl . Уравнение реакции будет иметь следующий вид:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2.
183

Диссоциация комплексных соединений
При растворении в воде комплексные соединения распадаются на ионы,
образуя сложные комплексные ионы, например:
K2 [Zn(SCN)4]  2K+ + [Zn(SCN)4]2 ; [Cu(NH3)4]Cl2
2K+ + [Zn(SCN)4]2 ; [Cu(NH3)4]Cl2  [Cu(NH3)4]2+ + 2Cl .
[Cu(NH3)4]2+ + 2Cl .
Такая диссоциация протекает полностью.
Комплексные ионы в свою очередь подвергаются вторичной диссоциа-
ции:
[Zn(SCN)4]2 |
Zn2+ + 4SCN ; |
[Cu(NH3)4]2+ |
Cu2+ + 4NH3. |
Эта диссоциация протекает в незначительной степени. Для таких обратимых процессов можно написать константу равновесия. В данных случаях она будет называться константа нестойкости комплексного иона. Эта величина характеризует прочность комплексного иона. Чем меньше эта величина, тем прочнее комплексный ион.
Kн[Zn(SCN)4]2 = [Zn2+][SCN−−]4 = 6,3·10-18; [Zn(SCN)4]2
Kн[Cu(NH3)4]2+ = [Cu2+][NH3]−4 = 4,6·10-14. [Cu(NH3)4]2
Пример 3. Напишите уравнения диссоциации молекулы [Ag(NH3)2]Cl и образующегося комплексного иона. Напишите выражение для константы нестойкости комплексного иона.
Решение. Комплексное соединение [Ag(NH3)2]Cl диссоциирует следующим образом:
[Ag(NH3)2]Cl  [Ag(NH3)2]+ + Cl ;
[Ag(NH3)2]+ + Cl ;
[Ag(NH3)2]+  Ag+ + 2NH3;
Ag+ + 2NH3;
[Ag+][NH3]2 Kн[Ag(NH3)2]+ = [Ag(NH3)2]+ = 6,8·10 8.
184
Названия комплексных соединений.
В научной и учебной литературе для названий комплексных соединений применяется специальная номенклатура.
Всегда сначала называют анион в именительном падеже, а затем катион в родительном падеже.
Лиганды имеют свое название: NH3 – аммин-; F – фторо-; H2O – акво-;
OH – гидроксо-; CN – циано-; SCN – родано-; Cl – хлоро-; |
NO2 – нитро-; |
Br – бромо-; S2O32 – тиосульфато- и др. |
|
[Cu(NH3)4]Cl2 – хлорид тетрааммин меди (II); |
|
K2 [Zn(SCN)4] – тетрароданоцинкат (II) калия; |
|
K3 [Fe(CN)6] – гексацианоферрат (III) . |
|
Для некоторых часто применяемых соединений используют тривиальные названия: K3[Fe(CN)6] – «красная кровяная соль»; K4[Fe(CN)6] – «желтая кровяная соль» и пр.
Пример 4. Назовите следующие комплексные соединения: K3 [Co(NO2)6] и Na2[Zn(OH)4].
Решение. В первом соединении комплексообразователь кобальт Co, лиганды ионы NO2 (нитро-). Следовательно, название будет таким: гексанитро-
кобальтат (III) калия.
Во втором соединении комплексообразователь – цинк Zn, лиганды – ионы
OH (гидроксо-). Название будет таким: тетрагидроксоцинкат (II) натрия.
Пример 5. Назовите следующие комплексные соединения: [Ni(NH3)4]SO4 и [Zn(H2O)4]Cl2.
Решение. В первом соединении комплексообразователь никель Ni, лиганды молекулы NH3 (аммин-), координационное число 4. Следовательно, назва-
ние будет таким: сульфаттетрааммин-никеля (II).
Во втором соединении комплексообразователь – цинк Zn, лиганды – молекулы воды H2O (акво-). Название будет таким: хлоридтетраакво-цинка (II).
185
ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ Пробный вариант
1.Напишите уравнения реакции между: а) нитратом серебра и цианидом калия; б) сульфатом железа (II) и фторидом калия. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
FeSO4, KAl(SO4)2, CaCl2·2H2O, Na3[FeF6].
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
FeCl3 + K4[Fe(CN)6] →
Алгоритм ответа
1. Напишите уравнения реакции между: а) нитратом серебра и цианидом калия; б) сульфатом железа (II) и фторидом калия. Образуются комплексные соединения.
Ответ. а) Формула нитрата серебра AgNO3, цианида калия KCN.
Ион Ag+ является комплексообразователем, координационное число иона Ag+ равно 2. Ионы CN будут лигандами.
AgNO3 +2KCN = K[Ag(CN)2].
б) Формула сульфата железа (II) FeSO4, фторида калия KF.
Ион Fe2+ – |
комплексообразователь, |
координационное число иона Fe2+ |
|
равно 4. Ионы F |
– лиганды. |
|
|
|
FeSO4 +4KF = K2[FeF4] + K2SO4. |
|
|
2. Напишите уравнения реакции диссоциации следующих соединений: Fe- |
|||
|
SO4, KAl(SO4)2, CaCl2·2H2O, [Cu(SCN)4]SO4. |
||
Ответ. FeSO4 – средняя соль, |
FeSO4 |
Fe2+ + SO42 ; |
|
KAl(SO4)2 – двойная сол, |
KAl(SO4)2 |
K+ + Al3+ + SO42 ; |
|
186

CaCl2·2H2O – кристаллогидрат, CaCl2·2H2O  Ca2+ + 2Cl + 2H2O;
Ca2+ + 2Cl + 2H2O;
[Cu(SCN)4]SO4 – комплексная соль, [Cu(SCN)4]SO4 |
[Cu(SCN)4]2+ + SO42 . |
3. Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
Ответ. Формула комплексного иона [Cu(SCN)4]2+.
Уравнение диссоциации: [Cu(SCN)4]2+ Cu2+ + 4SCN .
Cu2+ + 4SCN .
Константа нестойкости: |
Kн = |
[Сu2+][SCN |
−]4 |
. |
|
[Cu(SCN)4]2+ |
|||||
|
|
|
|||
4. Назовите комплексные соединения из первого и второго вопросов. Ответ. K[Ag(CN)2] – дицианоаргентат (I) калия;
K2[FeF4] – тетрафтороферрат (II) калия; [Cu(SCN)4]SO4 – сульфаттетрароданокупрат (II).
5. Напишите уравнение реакции между следующими соединениями: FeCl3 + K4[Fe(CN)6] →.
Ответ. Средняя соль FeCl3 при диссоциации дает ионы Fe3+ и 3Cl , ком-
плексная соль K4[Fe(CN)6] – ионы 4K+ и [Fe(CN)6]4 . Fe3+ + 3Cl + 4K+ + [Fe(CN)6]4 →
При протекании реакции ионы обмениваются местами и образуются два новых соединения:
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl.
Вариант 1
1.Напишите уравнения реакции между: а) нитратом серебра и гидроксидом аммония; б) сульфатом железа (III) и фторидом калия. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
Fe2(SO4)3, KCr(SO4)2, MgCl2·2H2O, Na3[Fe(CN)6].
3. Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
187
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
AlCl3 + K4[Fe(CN)6] →
Вариант 2
1.Напишите уравнения реакции между: а) нитратом серебра и бромидом калия; б) сульфатом железа (II) и фторидом калия. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
FeCl3, NH4Fe(SO4)2, AlCl3·6H2O, Na4[Fe(CN)6].
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
FeCl3 + K3[Fe(CN)6] →
Вариант 3
1.Напишите уравнения реакции между: а) нитратом серебра и тиосульфатом натрия (Na2S2O3); б) хлоридом железа (III) и роданидом калия. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
FeSO3, KFe(SO4)2, BaCl2·2H2O, Na2[FeBr4].
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
FeCl2 + K4[Fe(CN)6] →
188
Вариант 4
1.Напишите уравнения реакции между: а) хлоридом серебра и цианидом калия; б) сульфатом цинка и гидроксидом калия. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
Fe(NO3)3, (NH4)2Fe(SO4)2, (NH4)2CO3·H2O, K3[CoF6].
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
FeCl2 + K3[Fe(CN)6] →
Вариант 5
1.Напишите уравнения реакции между: а) хлоридом цинка и роданидом калия; б) сульфатом меди и гидроксидом аммония. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
CuSO4, NH4Al(SO4)2, FeCl3·6H2O, Na2[Pd(CN)4].
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
СuCl2 + K4[Fe(CN)6] →
Вариант 6
1.Напишите уравнения реакции между: а) нитратом железа (III) и цианидом калия; б) сульфатом кобальта (III) и фторидом калия. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
CuCl2, NaAl(SO4)2, Na2S·9H2O, Na2[Cd(SCN)4].
189
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
CuCl2 + K3[Fe(CN)6] →
Вариант 7
1.Напишите уравнения реакции между: а) сульфатом палладия (II) и цианидом калия; б) сульфатом меди (II) и бромидом калия. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
ZnSO4, NH4Cr(SO4)2, MgCl2·6H2O, [Zn(NH3)4](OH)2.
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
AgNO3 + K4[Fe(CN)6] →
Вариант 8
1.Напишите уравнения реакции между: а) нитратом кадмия (II) и роданидом калия; б) сульфатом цинка (II) и гидроксидом аммония. Образуются комплексные соединения.
2.Напишите уравнения реакции диссоциации следующих соединений:
ZnCl2, NaCr(SO4)2, Na2SO3·7H2O, Na3[AlF6].
3.Для комплексного иона (вопрос 2) напишите уравнение диссоциации и математическое выражение константы нестойкости.
4.Назовите комплексные соединения из первого и второго вопросов.
5.Напишите уравнение реакции между следующими соединениями:
AgNO3 + K3[Fe(CN)6] →
190
