
Маругин, В..А. Неорганическая химия
.pdf
FeO(Т) + H2(Г) |
Fe(Т) + H2O(Г) ∆H > 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) понижении температуры; б) понижении давления.
6.Найдите тепловой эффект реакции горения гептана. Сколько теплоты выделится, если сгорит 500 г C7H16?
Вариант 5
1. Напишите математическое выражение закона действующих масс для следующих реакций:
PCl3(Т) + Cl2(Г) →
N2(Г) + 3H2(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 3 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 40оС? (Температур-
ный коэффициент γ для этой реакции равен 3.)
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
2H2(Г) + O2(Г) |
2H2O(Г) ∆H < 0 |
3Fe(Т) + 4H2O(Г) |
Fe3O4(Т) + 4H2(Г) ∆H > 0 |
От каких факторов зависит константа химического равновесия?
5. Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) понижении давления.
71

6. Найдите тепловой эффект реакции взаимодействия оксида железа (III) c оксидом углерода. Сколько теплоты необходимо затратить, чтобы получить 1000 г железа?
Вариант 6
1. Напишите математическое выражение закона действующих масс для следующих реакций:
CO(Г) + Cl2(Г) → 4Fe(Т) + 3O2(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 5 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 70оС? (Температур-
ный коэффициент γ для этой реакции равен 2.)
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
|
H2O(Г) + CO(Г) |
H2(Г) + CO2(Г) |
∆H > 0 |
PCl5(Т) |
PCl3(Т) + Cl2(Г) |
∆H > 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) повышении давления.
6.Найдите тепловой эффект реакции разложения карбоната кальция при нагревании. Сколько теплоты необходимо затратить, чтобы разложить 200 г CaCO3?
72

Вариант 7
1. Напишите математическое выражение закона действующих масс для следующих реакций:
H2(Г) + Br2(Г) →
CuO(Т) + CO(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 3 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 50оС? (Температур-
ный коэффициент γ для этой реакции равен 3.)
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
|
Cr2O3(Т) + 3CO(Г) |
2Cr(Т) + 3CO2(Г) |
∆H > 0 |
H2(Г) + CO2(Г) |
H2O(Г) + CO(Г) |
∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) повышении давления.
6.Найдите тепловой эффект реакции горения метана. Сколько теплоты выделится, если сгорит 1 м3 (н.у.) CH4?
Вариант 8
1. Напишите математическое выражение закона действующих масс для следующих реакций:
4HCl(Г) + O2(Г) →
Mg(Т) + CO2(Г) →
73

Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 2 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз уменьшится скорость химической реакции, если понизить температуру на 50оС? (Температур-
ный коэффициент γ для этой реакции равен 2.)
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
|
MnO2(Т) + 2CO(Г) |
Mn(Т) + 2CO2(Г) |
∆H > 0 |
CH4(Г) + 2O2(Г) |
2H2O(Г) + CO2(Г) |
∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) повышении давления.
6.Найдите тепловой эффект реакции горения оксида углерода. Сколько теплоты выделится, если сгорит 100 л (н.у.) смеси равных количеств CO + H2?
Вариант 9
1. Напишите математическое выражение закона действующих масс для следующих реакций:
2NO2(Г) + 2SO2(Г) → 4Al(Т) + 3O2(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2. Во сколько раз увеличится скорость этих реакций, если давление увеличить в 4 раза? Докажите расчетом.
74

3. Сформулируйте правило Вант-Гоффа. Во сколько раз уменьшится скорость химической реакции, если понизить температуру на 30оС? (Температур-
ный коэффициент γ для этой реакции равен 3.)
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
|
2CuS(Т) + 3O2(Г) |
2CuO(Т) + 2SO2(Г) |
∆H < 0 |
CO(Г) + Cl2(Г) |
COCl2(Г) |
∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) понижении давления.
6.Найдите тепловой эффект реакции горения этанола. Сколько теплоты выделится, если сгорит 92 г C2H5 OH?
Вариант 10
1. Напишите математическое выражение закона действующих масс для следующих реакций:
2SO2(Г) + O2(Г) →
3Fe(Т) + 4H2O(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз уменьшится скорость этих реакций, если давление уменьшить в 4 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 30оС? (Температур-
ный коэффициент γ для этой реакции равен 3.)
4. Напишите математическое выражение константы химического равновесия для следующих реакций:
2SO2(Г) + O2(Г) |
2SO3(Г) ∆H < 0 |
75

2P(Т) + 3Cl2(Г) |
2PCl3(Т) ∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) понижении давления.
6.Найдите тепловой эффект реакции горения метанола. Сколько теплоты выделится, если сгорит 160 г CH3OH?
Вариант 11
1. Напишите математическое выражение закона действующих масс для следующих реакций:
H2(Г) + S(Т) →
3Fe(Т) + 4H2O(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 5 раз? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 70оС? (Температур-
ный коэффициент γ для этой реакции равен 3).
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
H2S(Г) |
H2(Г) + S(Т) ∆H > 0 |
4NH3(Г) + 3O2(Г) |
2N2(Г) +6H2O ∆H < 0 |
От каких факторов зависит константа химического равновесия?
5. Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) понижении давления.
76

6. Найдите тепловой эффект реакции бензола. Сколько теплоты выделится, если сгорит 300 г C6H6?
Вариант 12
1. Напишите математическое выражение закона действующих масс для следующих реакций:
CH4(Г) + 2O2(Г) →
Zn(Т) + Cl2(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 3 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 100оС? (Температур-
ный коэффициент γ для этой реакции равен 2.)
4. Напишите математическое выражение константы химического равновесия для следующих реакций:
CO2(Г) + C(Т) |
2CO(Г) ∆H > 0 |
4HCl(Г) + O2(Г) |
2Cl2(Г) +2H2O(Г) ∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) повышении температуры; б) понижении давления
6.Найдите тепловой эффект реакции горения этана. Сколько теплоты выделится, если сгорит 200 л (н.у.) C2H6?
Вариант 13
1. Напишите математическое выражение закона действующих масс для следующих реакций:
77
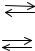
H2(Г) + Br2(Г) →
S(Т) + 3Cl2(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 4 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 100оС? (Температур-
ный коэффициент γ для этой реакции равен 3.)
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
|
CO(Г) + ZnO(Т) |
CO2(Г) + Zn(Т) |
∆H > 0 |
2C2H2(Г) + 5O2(Г) |
4CO2(Г) +2H2O(Г) |
∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье. Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) понижении температуры; б) повышения давления.
6.Найдите тепловой эффект реакции горения этилена. Сколько теплоты выделится, если сгорит 500 л (н.у.) C2H4?
Вариант 14
1. Напишите математическое выражение закона действующих масс для следующих реакций:
CH4(Г) + 2O2(Г) →
Zn(Т) + Cl2(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2. Во сколько раз увеличится скорость этих реакций, если давление увеличить в 4 раза? Докажите расчетом.
78

3. Сформулируйте правило Вант-Гоффа. Во сколько раз увеличится скорость химической реакции, если повысить температуру на 90оС? (Температур-
ный коэффициент γ для этой реакции равен 3.)
4. Напишите математическое выражение константы химического равно-
весия для следующих реакций: |
|
|
CO(Г) + ZnO(Т) |
CO2(Г) + Zn(Т) |
∆H > 0 |
2C2H2(Г) + 5O2(Г) |
4CO2(Г) +2H2O(Г) |
∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье.Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) понижении температуры; б) повышения давления.
6.Найдите тепловой эффект реакции горения ацетилена. Сколько теплоты выделится, если сгорит 300 л (н.у.) C2H2?
Вариант 15
1. Напишите математическое выражение закона действующих масс для следующих реакций:
H2(Г) + S(Т) →
3Fe(Т) + 4H2O(Г) →
Как читается закон действующих масс? От каких факторов зависит скорость химической реакции?
2.Во сколько раз увеличится скорость этих реакций, если давление увеличить в 3 раза? Докажите расчетом.
3.Сформулируйте правило Вант-Гоффа. Во сколько раз уменьшится скорость химической реакции, если понизить температуру на 30оС? (Температур-
ный коэффициент γ для этой реакции равен 3.)
4. Напишите математическое выражение константы химического равновесия для следующих реакций:
Cr2O3(Т) + 3CO(Г) |
2Cr(Т) + 3CO2(Т) ∆H > 0 |
79

H2(Г) + CO2(Г) |
H2O(Г) + CO(Г) |
∆H < 0 |
От каких факторов зависит константа химического равновесия?
5.Сформулируйте принцип Ле Шателье.Объясните, в какую сторону будет смещаться химическое равновесие реакций (вопрос 4) при: а) понижении температуры; б) повышения давления.
6.Найдите тепловой эффект реакции бензола. Сколько теплоты выделится, если сгорит 156 г C6H6?
Тест по теме: ХИМИЧЕСКАЯ КИНЕТИКА 1. Математическое выражение закона действующих масс для реакции
CO2 + C → имеет следующий вид:
а) V = [CO2]; б) V = k[CO2]; в) V = k[CO2][C]; г) V =k[CO2]+[C]. 2. При повышении давления в 2 раза скорость реакции 2SO2 + O2 →
возрастет в:
а) 4 раза; б) 32 раза; |
в) 8 раз; г) 16 раз. |
3.Скорость химической реакции (А + Б →) при повышении температуры
с20 до 700С (γ= 2) возрастет в:
а) 5 раз; б) 10 раз; в) 20 раз; г) 32 раза.
4. Математическое выражение для константы химического равновесия
для реакции 2NO + O2 |
|
2NO2 имеет следующий вид: |
|
|
|
|
||||||||||
а) |
K = |
[2NO2 ] |
|
; б) K = |
[NO2 ]2 |
|
|
; в) K = |
[NO2 ]2 |
|
; |
г) K = |
[2NO2 ] |
|
. |
|
|
[2NO]+[O2 ] |
[NO]2[O |
2 ] |
|
||||||||||||
|
[2NO][O2 ] |
|
|
|
|
[NO]2[O2 ] |
|
|||||||||
5. |
При повышении температуры равновесие в системе: |
|
|
|
|
|||||||||||
|
4HCl + O2 |
|
2H2O + 2Cl2 |
∆H > 0 |
сместится в сторону: |
|
||||||||||
а) прямой реакции; |
б) обратной реакции; в) смещения не произойдет. |
|||||||||||||||
6. При повышении давления равновесие в системе: |
|
|
|
|
|
|
||||||||||
|
4HCl + O2 |
|
2H2O + 2Cl2 |
∆H > 0 |
сместится в сторону: |
|
||||||||||
а) прямой реакции; |
б) обратной реакции; в) смещения не произойдет. |
|
||||||||||||||
80
