
- •Федеральное государственное образовательное учреждение
- •Химия Задания для контрольной работы Ижевск 2010
- •Задание № 1. Основные классы неорганических соединений……………………4
- •Приложения…………………………………………………………………………25
- •Задание № 2 Тема: «Строение атома»
- •Задание № 3 Тема: «Ковалентная связь»
- •Задание № 4 Тема: «Энергетика химических реакций»
- •Задание № 5 Тема: «Кинетика химических реакций»
- •Задание № 6 Тема: «Способы выражения концентраций»
- •Задание № 7 Тема: «Растворы неэлектролитов»
- •Задание № 8 Тема: «Растворы электролитов»
- •Задание № 9 Тема: «Гидролиз солей»
- •Задание № 10 Тема: «Окислительно-восстановительные реакции»
- •Задание № 11 Тема: «Электрохимия. Гальванические элементы»
- •Задание № 12 Тема: «Электрохимия. Электролиз»
- •Задание № 13 Тема: «Электрохимия. Коррозия металлов»
- •Задание № 14 Тема: «Свойства металлов»
- •Приложения
- •Окончание таблицы 1
- •Электродные потенциалы металлов в различных средах
- •Перенапряжение выделения водорода и ионизации кислорода на разных электродах
- •Вопросы для подготовки к экзамену
- •Вариант №1
- •4. Реакция восстановления оксида меди (II) алюминием возможна
- •5. При взаимодействии 1 моль ортофосфорной кислоты с 1 моль гидроксидом натрия образуется:
- •6. Метилоранж становится желтым при растворении в воде каждой из двух солей:
- •7. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна:
- •13.При электролизе раствора сульфата цинка с графитовым анодом и катодом на катоде выделится:
- •32.Дополните
- •41. С уменьшением концентрации соли степень диссоциации
- •76. Виды коррозии: Примеры:
- •77. Для защиты металла от коррозии
- •78. Вид коррозионных процессов: При контакте фаз:
- •79. Алюминий склёпан медью
- •Список литературы
- •Учебное издание
Вариант №1
Часть А
Составьте электронную формулу атомов железа, графически укажите валентные электроны в нормальном и возбужденном состояниях. Какие степени окисления может проявлять атом железа? Приведите примеры оксидов и гидроксидов железа в соответствующих степенях окисления, укажите их характер.
Если в момент химического равновесия 2NO + O2
 2NO2
концентрации NO,
O2
и NO2
соответственно равны 8 моль/л., 6 моль/л.,
4 моль/л., то начальные концентрации
исходных веществ (NO
и O2)
были:
2NO2
концентрации NO,
O2
и NO2
соответственно равны 8 моль/л., 6 моль/л.,
4 моль/л., то начальные концентрации
исходных веществ (NO
и O2)
были:12 моль/л и 8 моль/л;
14 моль/л и 8 моль/л;
16 моль/л и 12 моль/л;
32 моль/л и 24 моль/л.
Окисление аммиака протекает по уравнению:
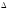 Н
обр. 4NH3
+ 3O2
= 2N2
+ 6 H2O
Н
обр. 4NH3
+ 3O2
= 2N2
+ 6 H2O
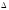 Нx.p.
= -1528 кДж
Нx.p.
= -1528 кДж
кДж/моль г г г ж (-285,84)
теплота
образования аммиака ( Н0
обр.(NH3))
равна:
Н0
обр.(NH3))
равна:
-92,15 кДж/моль;
92,15 кДж/моль;
46,76 кДж/моль;
-46,76 кДж/моль.
4. Реакция восстановления оксида меди (II) алюминием возможна
 G0
обр.
3CuO + 2Al = Al2O3
+ 3Cu
G0
обр.
3CuO + 2Al = Al2O3
+ 3Cu
кДж/моль -129,8 -1582
свободная
энергия Гиббса ( G
х.р.) равна:
G
х.р.) равна:
-1192 кДж;
-3576 кДж;
+1192 кДж;
+3576 кДж .
5. При взаимодействии 1 моль ортофосфорной кислоты с 1 моль гидроксидом натрия образуется:
1) ортофосфат натрия 3) дигидроортофосфат натрия
2) гидроортофосфат натрия 4) фосфат натрия
Составьте молекулярно-ионные уравнения реакций. Сумма всех коэффициентов в кратком ионном уравнении равна…
6. Метилоранж становится желтым при растворении в воде каждой из двух солей:
1) K2S и K3PO4 3) LiCl и FeSO4
2) KNO3 и K3PO4 4) CH3COOK и K2SO4
Составьте молекулярно-ионные уравнения реакций гидролиза.
7. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна:
1) 10 2) 12 3) 13 4) 9
Кислая среда образуется при растворении в воде каждой из двух солей:
1) BaCl2 и AlCl3 3) CuCl2 и LiCl
2) K2S и K3PO4 4) NH4NO3 и Zn(NO3)2
Составьте молекулярно-ионные уравнения гидролиза, выведите константу гидролиза по первой ступени.
В уравнение реакции схема которой:
FeSO4
+ KMnO4
+ H2SO4
Fe2(SO4)3
+ MnSO4
+ K2SO4
+ H2O
Сумма коэффициентов перед формулами исходных веществ равна:
1) 20 3) 25
2) 18 4) 22
Дайте полное решение задания (используйте ионно-электронный метод).
Установите правильную последовательность действий при определении типа гибридизации Ц.А. в частице:
Определите тип гибридизации;
Вычислите ст. ок., Ц.А. и число неспаренных (
 );
);Найдите Ц.А. в частице;
Укажите К.Ч. (Ц.А.) и число
 связей;
связей;Графически изобразите валентные (
 )
Ц.А. в соответствующей степени окисления.
)
Ц.А. в соответствующей степени окисления.Определите валентные электроны, участвующие в образовании связей в периферийных атомах и покажите их перекрывание с ГАО Ц.А.
Изобразите структурную формулу, указывающую геометрию частицы.
Установите соответствие:
Тип гибридизации Ц.А. Частица
1) sp2 a) Н2О
2) sp3 б) ВН3
3) sp3d в) SCl6
4) sp3d2 г) CO
5) sp д) PCl5
Рассмотрите по алгоритму те частицы, в которых Ц.А. в sp3 и sp3d гибридизации.
В Г.Э.: Ag | AgNO3 | | Fe(NO3)2 | Fe
|
Электроды
|
Процессы а) Fe0 – 2e Fe2- б) Fe2- + 2e Fe0 в) Ag0 – 1e Ag- г) Ag- + 1e Ag0 |
Рассчитайте ЭДС при н.у.
Дайте полное решение заданий
