
- •Оглавление
- •ВВЕДЕНИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 1. КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА И СЛОЖНОГО СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 3. РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА 4. ЖЕСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЕ УМЯГЧЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •Ионообменные реакции
- •ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА 7.ТЕПЛОВЫЕ ЭФФЕКТЫ, НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 8. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 10. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
- •ЛАБОРАТОРНАЯ РАБОТА 11. ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА 12. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
- •ЛАБОРАТОРНАЯ РАБОТА 14. ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ
- •ЛАБОРАТОРНАЯ РАБОТА 15. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА МЕТАЛЛОВ
- •ЛАБОРАТОРНАЯ РАБОТА 17. ЛЕГИРУЮЩИЕ МЕТАЛЛЫ (ХРОМ, МАРГАНЕЦ)
- •ЛАБОРАТОРНАЯ РАБОТА 18. ТЯЖЕЛЫЕ КОНСТРУКЦИОННЫЕ МЕТАЛЛЫ ПОДГРУППЫ ЖЕЛЕЗА (ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ)
- •ЛАБОРАТОРНАЯ РАБОТА 19. ЦИНК
- •ЛАБОРАТОРНАЯ РАБОТА 20. ОЛОВО И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 21. СВИНЕЦ И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА И СЛОЖНОГО СОЕДИНЕНИЯ
Цельработы
Освоить методику экспериментального определения эквивалента простых и сложных веществ.
Краткиетеоретическиесведения
Эквивалент элемента. Эквивалент Э – условная химическая единица, в Z раз меньшая соответствующей формульной единицы ФЕ вещества, участвующего в реакции. Под формульной единицей понимается химическая формула вещества. Для реакции
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Формульное количество |
2 моль |
3 моль |
1 моль |
6 моль |
Эквивалентное количество |
6 моль |
6 моль |
6 моль |
6 моль |
Эквивалентное число Z |
3 |
2 |
6 |
1 |
Фактор эквивалентности f = 1/Z |
1/3 |
1/2 |
1/6 |
1 |
Масса одного эквивалента вещества называется молярной массой эквивалента вещества Мэкв (размерность – г /моль):
Ì ýêâ = |
Ì |
= f Ì , |
(2.1) |
|
Z |
||||
|
|
|
где М – молярная масса; f – фактор эквивалентности.
Между молярной массой эквивалента Мэкв, атомной массой А и стехиометрической валентностью элемента В существует зависимость:
Mэкв = АВ .
По этой формуле определяется теоретическое значение молярной массы эквивалента элемента. Например:
Мэкв(Zn) = 65,42 =32,7 г/моль; Мэкв(Al) = 273 =9 г/моль.
Эквивалент может быть также определен как количество вещества,
равноценное в химической реакции одному молю атомов водорода или одному молю электронов.
Химия. Лаб. практикум |
-21- |

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Краткие теоретические сведения
Один из основных законов химии – закон эквивалентов: химические элементы взаимодействуют между собой в количествах, пропорциональных их эквивалентам. Например, 1,008 г/моль водорода соединяется с 8 г/моль кислорода или 35,5 г/моль хлора, или с 23 г/моль натрия; 2,016 г/моль водорода соединяютсяс16 г/молькислородаили71 г/мольхлора, или46 г/мольнатрияит.д.
Закону эквивалентов можно придать математическое выражение
m1 |
= |
Ì ýêâ(1) |
, |
(2.2) |
m2 |
|
|||
|
Mýêâ(2) |
|
||
где m1, m2 – масса первого и второго вещества; Mэкв(1), Mэкв(2) – молярные массы эквивалентов первого и второго вещества.
Например, если известно, что 1,44 г металла образуют 2,72 г оксида, то молярную массу эквивалента этого металла вычисляют следующим образом. Масса металла m1 равна 1,44 г, масса кислорода m2 равна 2,72 – 1,44 = 1,28 г, молярная масса эквивалента кислорода равен 8. Отсюда молярная масса эквивалента металла Mэкв (1) = 1,44 8/1,28 = 9 г/моль.
Методыопределениямолярныхмассэквивалентов
Экспериментальное определение молярных масс эквивалентов элементов может быть проведено различными методами.
a) Метод прямого определения. Находят массовое количество элемента, соединяющееся с 1,008 г/ моль водорода или с 8 г/моль кислорода.
П р и м е р. При окислении 8,71 г металла получено 9,71 г оксида. Молярная масса эквивалента металла определяется из простого соотношения:
на 8,71 г металла пошло (9,71 – 8,71) г кислорода; на Х (Мэкв г/ моль) пошло 8 г/моль О2;
Ì ýêâ = |
8,71 8 |
|
=69,68 г/моль. |
|
9,71−8,71 |
||||
|
|
|||
б) Аналитический метод. Молярная масса эквивалента определяется по данным анализа, когда известен количественный состав соединения данного элемента с другим элементом, молярная масса эквивалента которого известна.
П р и м е р. Для нахождения молярной массы химического эквивалента золота, которое непосредственно с водородом и кислородом не соединяется и не вытесняет водород из кислот, можно воспользоваться результатами анализа его соединения с хлором – хлорида золота (III) AuCl3. Опыт показывает, что при образовании этого соединения 197 г/моль золота взаимодействуют
Химия. Лаб. практикум |
-22- |

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Краткие теоретические сведения
со 106,5 г/моль хлора. Молярная масса эквивалента хлора равна 35,5 г/моль. Отсюда молярная масса эквивалента золота
Ì ýêâ(Au) = |
197 35,5 |
=65,7 г/моль. |
|
106,5 |
|
в) Метод вытеснения. Этот метод применим к металлам, взаимодействующим с кислотами или гидроксидами щелочных металлов с выделением водорода. В этом случае находят количество металла, вытеснившего 1 моль атомов водорода или 11,2 л водорода при нормальных условиях.
г) Электрохимический метод. Молярные массы химических эквивалентов элементов определяются на основе закона Фарадея, согласно которому 96500 Кл электричества выделяют из электролита одну молярную массу эквивалента вещества.
П р и м е р. Ток в 1 А в течение 193000 с выделил 18 г алюминия из раствора его соли. Эквивалент алюминия вычисляется из соотношения
в течение 193000 с выделилось 18 г Al;
при пропускании 96 500 Кл выделилось Х (Мэкв);
Ì ýêâ =1819300096500 =9 г/моль.
Методвытесненияводорода(объемныйметод)
В данной работе для определения молярной массы эквивалента металла будем пользоваться наиболее простым и доступным методом, основанным на измерении объема водорода при реакции вытеснения его из раствора соляной кислоты.
Me + nHCl = MeCln + n2 H2
Согласно закону эквивалентов, один эквивалент металла вытесняет один эквивалент водорода, имеющий молярную массу эквивалента 1 г/моль.
Используя закон Авогадро, можно определить объем, который занимает один эквивалент водорода при определенных физических условиях. При нор-
мальных физических условиях (p = 1,013·105 Па или p |
7 60 мм рт. ст., |
|
Т = |
298 К) 1 моль водорода, имеющий массу 2 г/моль, |
занимает объем |
V = |
22,4 л, тогда 1 моль эквивалента водорода, имеющий массу 1 г/моль, |
|
должен занимать объем Vэкв = 11,2 л.
В данной работе измеряют объем водорода и приводят его к нормальным условиям. Пусть навеска металла m г вытеснила V0 водорода при нормальных условиях. Тогда эквивалент определится из пропорции:
m г вытесняют V0 H2 при н.у.;
Химия. Лаб. практикум |
-23- |

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Краткие теоретические сведения
Х (Mэкв г/моль) вытесняют 11,2 л Н2;
Ì ýêâ = m 11,2 г/моль. V0
Для приведения объема вытесненного водорода к нормальным условиям пользуются формулой объединенного закона Бойля–Мариотта и Гей– Люссака:
|
ð0V0 |
= pV |
, |
|
(2.3) |
|
|
|
T |
||||
|
|
T |
|
|
|
|
0 |
|
|
|
|
||
откуда |
|
|
|
|
||
V0 = |
(p −pâ ) VT0 |
. |
(2.4) |
|||
|
||||||
|
|
|
p0T |
|
|
|
Здесь p0, V0 и T0 – соответственно, давление, объем и температура газа при нормальных условиях.
Пример расчета эквивалентов веществ
1) Рассчитать эквивалент железа в реакциях:
а) Fe + H2SO4(разб) = FeSO4 + H2;
б) 2Fe + 6 H2SO4(конц) = Fe2(SO4)3 +3SO2 + 6H2O.
Для реакции (a) Fe – 2ē = Fe2+ и эквивалентное число Z = 2. Эквивалент железа равен Э = 0,5ФE, молярная масса эквивалента железа равна
Ì ýêâ = |
1 |
Ì =55,85: 2 = 27,925 г/моль. |
|
2 |
|
Для реакции (б) Fe – 3ē = Fe3+ и эквивалентное число Z = 3. Эквивалент железа равен Э = 13 ФE, молярная масса эквивалента железа равна Mэкв =
= 13 M = 55,85: 3 = 18,617 г/моль, где М – молярная масса железа.
Эквивалентсложноговещества
Эквивалентом сложного вещества называется такое его количество, которое в данной реакции реагирует без остатка с 8 г кислорода, 1,008 г водорода или с эквивалентом другого вещества.
Эквивалент сложного вещества определяется реакцией, в которой участвует вещество. Поэтому он не является постоянной величиной (как, например, молекулярная масса) и может иметь различные значения. Поясним это на примере взаимодействия фосфорной кислоты со щелочью. В реакции
H3PO4 + NaOH = NaHPO4 + H2O
Химия. Лаб. практикум |
-24- |

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Краткие теоретические сведения
молекула кислоты реагирует с одной молекулой NaOH, что соответствует одному эквиваленту водорода. Поэтому эквивалент кислоты равен ее молекулярной массе: ÝH3PO4 =1 ФЕ. Молярная масса эквивалента кислоты равна
Мэкв = М = 98 г/моль.
В реакции H3PO4 + 2NaOH = Na2HPO4 + 2H2O молекула кислоты соответствует двум эквивалентам водорода (или двум эквивалентам щелочи). Эквивалентное число Z равно 2. Поэтому ÝH3PO4 =1/2 ФЕ.
Молярная масса эквивалента кислоты Мэкв = М / 2 = 98 / 2 = 49 г/моль. В реакции H3PO4 + 3NaOH = Na3PO4 + 3H2O эквивалентное число Z равно 3, поэтому Э = 1/3 ФЕ. Молярная масса эквивалента кислоты равна
Mýêâ(H3PO4 ) =М / 3 = 98 / 3 ≈ 32,7 г/моль.
Молярная масса эквивалента кислоты (гидроксида) равна ее (его) молекулярной массе, деленной на количество атомов водорода (для гидроксида на количество OH–-групп), замещенными в данной реакции другими атомами или ионами.
Например,
Ì ýêâ(H SO ) = |
MH2SO4 |
= |
98 |
=49 г/моль. |
||
2 |
||||||
2 |
4 |
|
2 |
|
||
|
|
|
|
|||
Молярная масса эквивалента соли равна ее молекулярной массе, деленной на количество атомов металла в составе соли и на валентность этого металла. Например,
Ì ýêâ(Al |
(SO |
) ) = |
Ì Al2 (SO4 )3 |
= |
342 |
=57г/моль. |
|
2 3 |
|||||||
2 |
4 |
3 |
|
6 |
|
||
|
|
|
|
Экспериментальнаячасть
Опыт 1 Определениемолярноймассыэквивалентацинка
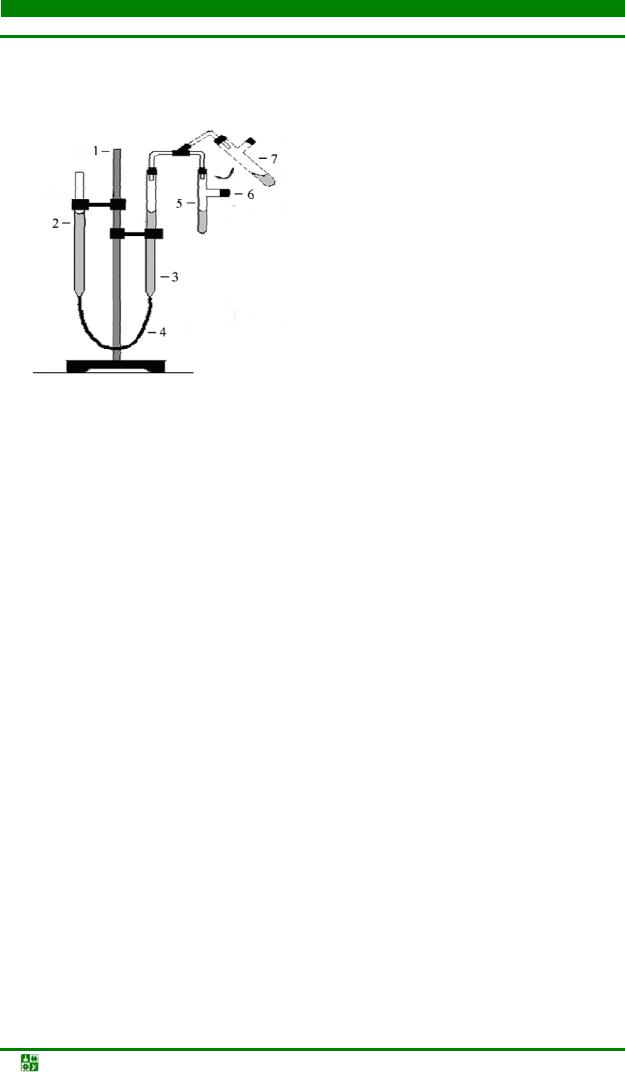
Опыт проводится на приборе, изображенном на рис. 2.1. Прибор состоит из штатива 1, на котором закреплены бюретки 2 и 3, соединенные шлангом. Бюретки имеют поперечное сечение, равное 1 см2, и градуированы с точностью 0,1 см, причем нулевая отметка находится в верхней части бюретки. К бюретке 3 при помощи стеклянных трубок, соединенных резиновым шлангом 4, присоединена пробирка 5 с отводной трубкой 6. Бюретки заполнены водой, пробирка 5 – концентрированной соляной кислотой. В отводную трубку помещают образец металла с известной массой и, переводя пробирку из положения 6 в положение 7, сбрасывают металл в кислоту. При взаимодействии металла с кислотой в пробирке 5 выделяется водород, который, по-
Химия. Лаб. практикум |
-25- |
ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Экспериментальная часть
ступая в бюретку 3, вытесняет воду из нее в бюретку 2. Измерения проводят при одинаковом положении уровней воды в обеих бюретках, что определяет одинаковое давление.
Рис. 2.1. Прибор для определения эквивалента цинка объемным методом: 1 – штатив; 2, 3 – бюретки с водой; 4 – соединительная трубка; 5 – рабочая пробирка; 6, 7
– поло-
жения рабочей пробирки 5
Перед началом опыта бюретки должны находиться в таком положении относительно друг друга, чтобы уровень воды в них был примерно на середине шкалы отсчета. Отводную трубку 6 и закрывающую ее пробку перед началом опыта насухо вытирают фильтровальной бумагой, после чего в нее помещают полученный образец металла с известной массой m. Трубку плотно закрывают пробкой, осторожно ввинчивая ее. Прибор проверяют на герметичность. Для этого медленно поднимают или опускают бюретку 2, наблюдая за колебаниями уровня воды в бюретке. Если прибор не герметичен, то уровни в обеих бюретках будет выравниваться. В этом случае нужно проверить положение всех пробок и снова проверить прибор.
После проверки прибора на герметичность уравнивают положение воды в обеих бюретках и отмечают положение уровня в бюретке 3 по нижнему мениску, записывая его значение по градуировочной шкале h1 c точностью 0,1 см. После чего осторожно сбрасывают металл в кислоту, переводя пробирку 5 из положения 6 в положение 7. По мере понижения уровня воды в бюретке 3 опускают бюретку 2, следя за тем, чтобы уровни в обеих бюретках были приблизительно на одной высоте, что определяет равенство давлений в них.
По окончании растворения металла точно выравнивают положение уровней в обеих бюретках и записывают положение уровня в бюретке 3 по шкале h2 с той же точностью. Объем выделившегося водорода V в реакции:
M + nHCl = MCln + n2 H2
равняется разности уровней V = h1 – h2, имеет размерность см3 и относится к атмосферным условиям (p,T) проведения опыта.
Эквивалент металла Эмет, имеющий молярную массу Мэкв вытесняет эквивалент водорода ÝH2 , который при нормальных условиях занимает объ-
Химия. Лаб. практикум |
-26- |

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Экспериментальная часть
ем Vэкв = 11200 см3, а используемая в опыте масса металла m вытесняет объем водорода V0, пересчитанного на нормальные условия. В соответствии с законом эквивалентов, это можно представить в виде уравнения (2.5):
Ì ýêâ |
= |
Výêâ |
. |
(2.5) |
m |
|
|||
|
V |
|
||
|
|
0 |
|
|
Измеренный объем водорода при атмосферных условиях (p, T) пересчитывается на нормальные условия по уравнению Клапейрона:
ð0V0 |
= |
pV |
, |
(2.6) |
|
T |
T |
||||
|
|
|
|||
0 |
|
|
|
|
p0, V0, T0 относятся к нормальным условиям, а p, V, T – к условиям проведения опыта. Давление p газов в бюретке 3 в соответствии с законом Дальтона будет равно будет равно сумме парциальных давлений воздуха pвозд, водорода pН и насыщенного водяного пара pпар:
p = pвозд + pН + pпар. |
(2.7) |
При одинаковом положении уровней воды в обеих бюретках давление pатм = pвозд + pН в бюретке (3) будет меньше атмосферного на величину давления насыщенного водяного пара, которое зависит только от температуры (табл. 2.1):
p = pатм – pпар. |
(2.8) |
Подставляем в уравнение (2.5) выражение V0из уравнения (2.6). Получаем уравнение для расчета молярной массы эквивалента металла Мэкв:
Mýêâ = |
m Výêâ |
= |
m Výêâ p0 T |
. |
(2.9) |
V0 |
|
||||
|
|
p V T0 |
|
||
В журнал записывают температуру, атмосферное давление по барометру, давление водяного пара (табл. 2.1).
|
|
|
|
|
|
|
Таблица 2.1 |
|
|
|
|
|
|
|
|
|
|
|
t, оC |
|
мм рт. ст. |
Па |
t, оC |
мм рт.ст. |
Па |
|
|
15 |
|
1705,1 |
12,79 |
22 |
2643,7 |
19,83 |
|
|
16 |
|
1817,1 |
13,63 |
23 |
2809,0 |
21,07 |
|
|
17 |
|
1947,1 |
14,53 |
24 |
2983,7 |
22,38 |
|
|
18 |
|
2063,8 |
15,48 |
25 |
3167,2 |
23,76 |
|
|
19 |
|
2197,1 |
16,48 |
26 |
3361,0 |
25,21 |
|
|
20 |
|
2337,8 |
17,53 |
27 |
3564,9 |
26,74 |
|
|
21 |
|
2486,4 |
18,65 |
28 |
3779,6 |
28,35 |
|
|
|
|
|
|
|
|
|
|
|
Химия. Лаб. практикум |
|
|
-27- |
|
|||

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Экспериментальная часть
Преобразуем уравнение (2.9), подставив известные численные дан-
ные:
|
Ì |
ýêâ = |
m 11200 p0 (273 +t) |
= |
m |
K , |
(2.10) |
||
|
(pàòì −pï àð ) V 273 |
V |
|||||||
|
|
|
|
|
|
|
|||
где |
11200 (273 + t) p |
|
|
|
|
||||
|
|
|
|
|
|||||
K = |
|
|
0 |
. |
|
|
|
(2.11) |
|
|
|
273 (pàòì −pï àð ) |
|
|
|
||||
Коэффициент К зависит только от условий опыта (p,T) и размерности давления. Так как этот коэффициент не зависит от массы металла, то его можно рассчитать заранее и использовать при повторных измерениях.
После расчета молярной массы эквивалента металла по уравнению (2.10) рассчитывается молярная масса металла для значения валентности Z, равного 2 по уравнению
М = Мэкв·Z. |
(2.12) |
Затемрассчитываетсяотносительнаяпогрешностьопытапоуравнению
Ì = |
Ì ýêâ(ýêñï )Ì ýêâ(òåî ð) |
100% , |
(2.13) |
|
|||
|
Ì ýêâ(òåî ð) |
|
|
где Мэкв (экспер) – молярная масса эквивалента металла, рассчитанная из опытных данных по уравнению (6); Мэкв (теор) – теоретическая молярная масса эк-
вивалента металла, рассчитанная по уравнению (2.12). Записать данные опыта:
Вес цинка, г.
Атмосферное давление, мм рт. ст. Температура, 0С.
Объем воды в стакане до опыта, л. Объем воды в стакане после опыта, л. Объем водорода в условиях опыта ,л.
Объем водорода при нормальных условиях, л. Эквивалентный вес металла, г.
Величина ошибки определения эквивалентного веса, %.
Опыт 2 Определениеэквивалентакарбонатанатрия
Для определения эквивалента карбоната натрия проводят реакцию
Na2CO3 +2HCl = 2NaCl + CO2↑ + H2O
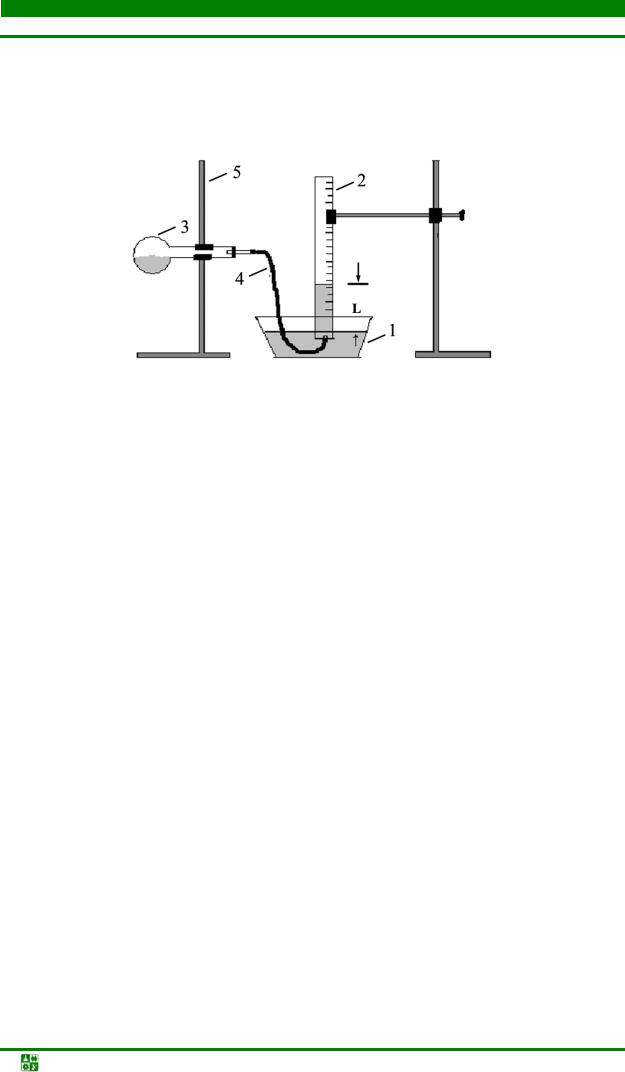
Опыт выполняют в следующем порядке: наполните кристаллизатор 1 (рис. 2.2) на половину его объема насыщенным раствором поваренной соли,
Химия. Лаб. практикум |
-28- |
ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Экспериментальная часть
в котором растворимость диоксида углерода меньше, чем в воде. Тем же раствором наполните вровень с краями мерный цилиндр 2 вместимостью 100 мл и закройте его стеклянной пластинкой, надвигая последнюю скользящим движением.
Рис. 2.2. Прибор для определения молярной массы эквивалента карбоната натрия: 1 – кристаллизатор; 2 – мерный цилиндр; 3 – колба круглодонная; 4 – газоотводная трубка; 5 – штатив
Переверните цилиндр вверх дном и опустите в кристаллизатор. Удалите под раствором стеклянную пластинку и закрепите цилиндр в лапке штатива так, чтобы края цилиндра были ниже уровня раствора в кристаллизаторе, следя за тем, чтобы в цилиндр не попал воздух. В колбочку вместимостью 50 мл налейте 8–10 мл 2 н. раствора хлороводородной (соляной) кислоты, вытрите горло колбы фильтровальной бумагой и закрепите ее в штативе в горизонтальном положении. Навеску соли (~0,3–0,4 г) карбоната натрия поместить осторожно в горло колбы таким образом, чтобы кристаллы не могли преждевременно упасть в кислоту, плотно закройте колбу пробкой с газоотводной трубкой и подведите открытый изогнутый конец трубки под цилиндр.
Выньте колбу из штатива и медленно, чтобы не происходило очень бурного выделения диоксида углерода, пересыпьте карбонат натрия небольшими порциями в кислоту аккуратными наклонами колбы. В конце опыта стряхнуть остатки кристаллов в колбу. По окончании выделения газа вновь закрепите колбу в штативе. Измерьте в цилиндре объем выделившегося диоксида углерода и с помощью миллиметровой линейки измерьте расстояние L от уровня воды в кристаллизаторе до уровня воды в цилиндре.
Запишите данные опыта: Mасса карбоната натрия m, г.
Объем выделившегося диоксида углерода V, мл.
Расстояние от уровня воды в кристаллизаторе до уровня воды в цилиндре l, мм.
Температура опыта, 0С. Атмосферное давление, p.
Химия. Лаб. практикум |
-29- |

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Экспериментальная часть
По уравнению Менделеева–Клапейрона |
|
||||
p |
CO2 |
V = |
m |
RT |
(2.14) |
|
|||||
|
|
M |
|
||
|
|
|
|
||
вычислите массу m диоксида углерода. Для определения давления рСО2 сле-
дует из атмосферного давления p вычесть давление столба жидкости pр-ра и вычислить по формуле
p |
ð−ðà |
= |
ρð−ðà |
l . |
(2.15) |
|
|||||
|
|
ρ |
|
||
|
|
|
Hg |
|
|
Плотность насыщенного раствора хлорида натрия ρр-ра = 1,20 г/см3, плотность ртути сHg = 13,60 г/ см3. Парциальным давлением водяного пара ввиду его малого значения в насыщенном растворе поваренной соли в данном опыте можно пренебречь.
Таким образом,
pCO |
= p −pð−ðà . |
(2.16) |
|
2 |
|
Зная, что эквивалент кислотного оксида CO2 в реакции нейтрализации, протекающей с образованием Na2CO3, равен половине массы его моля, и применяя закон эквивалентов
Ý |
|
mNa |
CO |
3 |
|
|
|
Na2CO3 |
= |
|
2 |
|
, |
(2.17) |
|
Ý |
m |
CO2 |
|
||||
|
|
|
|
||||
CO2 |
|
|
|
|
|
||
вычислите молярную массу эквивалента Na2CO3. Найдите абсолютную и относительную погрешность измерения.
Контрольныевопросыизадачи
1.Сколько оксида получится при окислении 3 г металла, молярная масса эквивалента которого равна 9 г? (Ответ: 5,7 г.)
2.Определите молярные массы эквивалентов кислот и оснований в следующих реакциях:
а) HNO3 + Bi(OH)3 = Bi(OH)2NO3 + H2O
б) H2S + NaOH = NaHS + H2O
в) 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O
г) H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O
Химия. Лаб. практикум |
-30- |

ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА
Контрольные вопросы и задачи
д) 2HCl + Bi(OH)3 = BiOHCl2 + 2H2O
е) 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O
3. Какие объемы занимают при нормальных условиях массы одного эквивалента кислорода и одного эквивалента водорода? (Ответ: VO2 = 5,6 л;
VH2 = 11,2 л.)
4.Определите молярную массу эквивалента металла, если 0,046 г его
вытеснили из кислоты 62,35 мл водорода, собранного над водой при температуре 17 оС и давлении 1,017 ·105 Па. Давление водяного пара при 17 оС
равно 0,193 ·105 Па. (Ответ: 88,9 г.)
5.Вычислите эквивалент и молярную массу эквивалента H3PO4 в реакциях образования: a) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
6.При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н. у.). Вычислите молярную массу эквивалента, мольную массу и атомную массу металла.
7.При соединении 5,6 г железа с серой образовалось 8,8 г сульфида
железа. Найдите эквивалентную массу железа ЭFe, если известно, что молярная масса эквивалента серы равна 16 г/ моль. (Ответ: 28 г/моль.)
8.Некоторое количество металла, молярная масса эквивалента которого равна 28 г/моль, вытесняет из кислоты 0,7 г водорода, измеренного при нормальных условиях. Определите массу металла. (Ответ: 1,76 г.)
9.Определите молярные массы эквивалентов элементов в соединени-
ях HBr, H2O и NH3.
10.При сгорании трехвалентного металла в количестве 23,48 г было получено 44,40 г его оксида. Какой металл был сожжен? Определите молярную массу эквивалента оксида.
Химия. Лаб. практикум |
-31- |
