
- •Оглавление
- •ВВЕДЕНИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 1. КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 2. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЭЛЕМЕНТА И СЛОЖНОГО СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 3. РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА 4. ЖЕСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЕ УМЯГЧЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •Ионообменные реакции
- •ЛАБОРАТОРНАЯ РАБОТА 6. ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА 7.ТЕПЛОВЫЕ ЭФФЕКТЫ, НАПРАВЛЕНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА 8. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА 10. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
- •ЛАБОРАТОРНАЯ РАБОТА 11. ЭЛЕКТРОЛИЗ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА 12. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИ
- •ЛАБОРАТОРНАЯ РАБОТА 14. ПОЛУЧЕНИЕ ДИСПЕРСНЫХ СИСТЕМ. УСТОЙЧИВОСТЬ КОЛЛОИДНЫХ РАСТВОРОВ
- •ЛАБОРАТОРНАЯ РАБОТА 15. ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА МЕТАЛЛОВ
- •ЛАБОРАТОРНАЯ РАБОТА 17. ЛЕГИРУЮЩИЕ МЕТАЛЛЫ (ХРОМ, МАРГАНЕЦ)
- •ЛАБОРАТОРНАЯ РАБОТА 18. ТЯЖЕЛЫЕ КОНСТРУКЦИОННЫЕ МЕТАЛЛЫ ПОДГРУППЫ ЖЕЛЕЗА (ЖЕЛЕЗО, КОБАЛЬТ, НИКЕЛЬ)
- •ЛАБОРАТОРНАЯ РАБОТА 19. ЦИНК
- •ЛАБОРАТОРНАЯ РАБОТА 20. ОЛОВО И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 21. СВИНЕЦ И ЕГО КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА 22. СВОЙСТВА МЕДИ И ЕЕ СОЕДИНЕНИЙ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Краткие теоретические сведения
[Кm+]n · [Аn−]m = const = ПР.
Из понятия ПР вытекают условия образования осадков
([Кm+]n ·[Аn−]m > ПР)
и растворения осадков
([Кm+]n ·[Аn−]m < ПР).
Произведение растворимости некоторых малорастворимых электролитов при 25 °С приводится в табл. 6 приложения.
Ионообменныереакции
Так как электролиты в растворе находятся в виде ионов, то реакции между растворами солей, гидроксидов и кислот − это реакции обмена ионами, т. е. ионообменные реакции. Реакции обмена с участием ионов электролитов протекают в направлении образования слабых электролитов, выделения газов и выпадения осадков.
Существуют следующие правила для написания реакций ионного типа:
•формулы малодиссоциирующих веществ (осадков, газов, слабых элктролитов, комплексных ионов) записывают в молекулярном виде;
•формулы хорошо диссоциирующих веществ (сильные электролиты) записывают в ионном виде;
•реакции обмена пишутся в молекулярном, ионно-молекулярном и ионном виде.
Рассмотрим получение гидроксида железа (III) в результате взаимодействия водных растворов нитрата железа (III) и гидроксида натрия. Молекулярное уравнение реакции:
Fe(NO3)3 + 3NaOH = Fe(OH)3↓ +3 NaNO3
Полное ионно-молекулярное уравнение реакции:
Fe3+ + 3NO −3 + 3Na+ + OH− = Fe(OH)3↓ +3Na+ + 3NO −3
Сильные электролиты – нитрат железа (III) и гидроксид натрия в растворе находятся в виде ионов. Гидроксид железа (III) − слабый электролит и ионов железа и гидроксид-ионов в растворе почти не образует. Следователь-
но, взаимодействуют только ионы Fe3+ и OH−. Исключив ионы Na+ и NO −3 из обеих частей уравнения, получим сокращенное ионное уравнение:
Fe3+ + 3OH− = Fe(OH)3↓
Химия. Лаб. практикум |
-50- |
ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Краткие теоретические сведения
только взаимодействие этих ионов отражает суть процесса, т. е. определяет направление реакции, поэтому следует пользоваться краткой ионной записью.
Экспериментальнаячасть
Опыт 1 Зависимостьэлектропроводностиотстепенидиссоциацииэлектролитов
Электропроводность растворов в значительной степени зависит от cтепени диссоциации электролита. При одинаковой концентрации, чем выше степень диссоциации электролита, тем больше значение его удельной электропроводности.
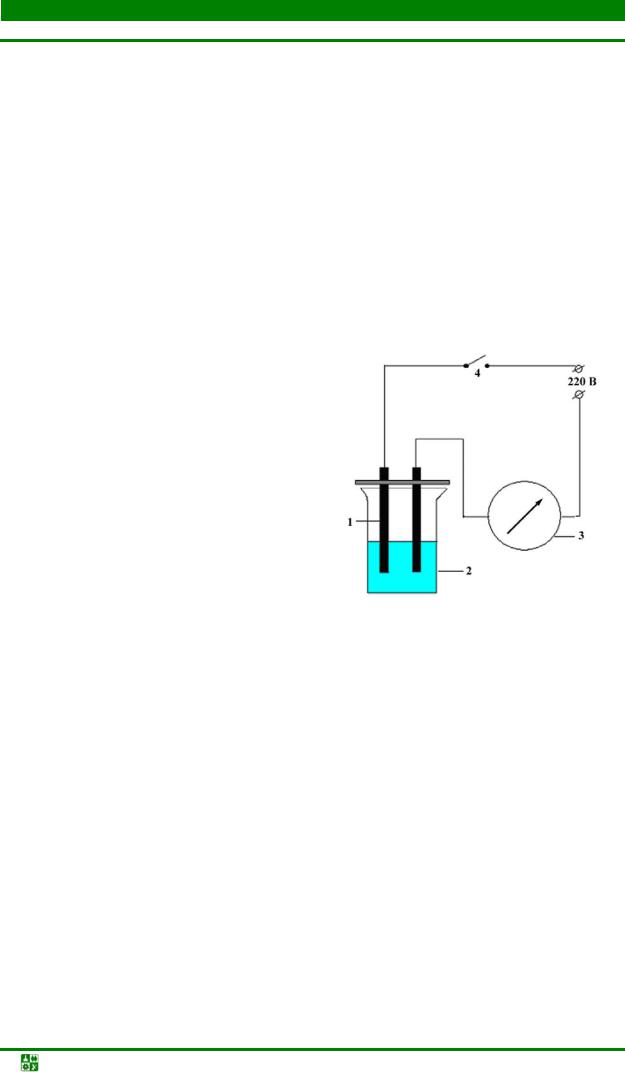
Рис. 5.4. Принципиальная схема определения электропроводности растворов: 1 – графитовые электроды; 2 – стакан с исследуемым раствором; 3 – вольтметр; 4 – ключ
замыкания цепи
Для изучения электропроводности растворов применяют прибор, принципиальная схема которого изображена на рис. 5.4. Перед началом опыта прибор включают в сеть. Стакан 2 емкостью 50 мл каждый раз наполняют раствором на 1/2 его объема, чтобы площади электродов, опущенных в жидкость, были во всех опытах одинаковы. Затем опускают электроды 1 в раствор и только после этого замыкают электрическую цепь при помощи ключа 4.
Определяют электропроводность следующих растворов: дистиллированной воды, сахара, уксусной кислоты, гидроксида аммония, ацетата аммония и хлорида натрия. Промываем электроды дистиллированной водой после испытания каждого раствора. Об электропроводности растворов судят по отклонению стрелки вольтметра 3, чем больше отклонение стрелки, тем больше электропроводность.
На основании полученных результатов расположите электролиты в порядке возрастания их электропроводности. Напишите уравнения диссоциации. Для слабых электролитов запишите константы диссоциации.
Химия. Лаб. практикум |
-51- |

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Экспериментальная часть
Объясните увеличение электропроводности раствора ацетата аммония, полученного при сливании растворов уксусной кислоты и гидроксида аммония, в сравнении с электропроводностью исходных растворов.
Опыт 2 Влияниеразбавленияраствора
настепеньэлектролитическойдиссоциации
Испытайте электропроводность концентрированной (80 %) и разбавленной (2 н.) уксусной кислоты. Наблюдайте увеличение амплитуды отклонения стрелки вольтметра в случае с разбавленной кислотой. Сделайте вывод о направлении смещения равновесия диссоциации с разбавлением раствора.
Опыт 3 Влияниеодноименногоиона
настепеньдиссоциациислабогоэлектролита
В опыте используем индикаторы – метиловый оранжевый и фенолфталеин, окраска которых изменяется в зависимости от того, в какой форме (кислотной или щелочной) они находятся (табл. 5.1).
|
|
|
|
Таблица 5.1 |
||
|
|
|
Окраска |
|
|
|
Индикатор |
Окраска |
Окраска |
Область |
|||
нейтральной формы |
кислотной формы |
щелочной формы |
перехода рН |
|||
|
||||||
Фенолфталеин |
Не окрашен |
Не окрашен |
Красная |
|
8,0–10,0 |
|
Метиловый |
Оранжевая |
Розовая |
Желтая |
|
3,1–4,4 |
|
оранжевый |
|
|||||
|
|
|
|
|
||
a) В две пробирки влейте по 5−7 капель 0,1 н. раствора уксусной кислоты и по одной капле индикатора метилового оранжевого. Индикатор поменял оранжевый цвет на розовый. В одну из пробирок добавьте несколько кристалликов ацетата натрия и перемешайте. Наблюдайте переход окраски индикатора от розового до оранжевого.
б) В две пробирки влейте по 5−7 капель 0,1 н. раствора аммиака и по одной капле индикатора фенолфталеина. Раствор приобретает красную окраску. В одну из пробирок добавьте несколько кристалликов хлорида аммония. Наблюдайте обесцвечивание раствора.
Пользуясь выражением констант диссоциации для уксусной кислоты и гидроксида аммония (Кд (CH3COOH) = 1,86·10–5; Кд (NH4OH) = 1,77·10–5),
объясните причину смещения равновесия.
Опыт 4 Определениенаправленияпротекания
ионообменныхреакцийсучастиемэлектролитов
В пробирку с 5−7 каплями раствора ацетата натрия добавьте 3-4 капли серной кислоты (1:1), растворы перемешайте и слегка подогрейте пробирку с растворами на водяной бане. Определите образование уксусной кислоты по
Химия. Лаб. практикум |
-52- |

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Экспериментальная часть
характерному запаху. Во вторую пробирку внесите 5−7 капель раствора хлорида аммония и 3-4 капли 4 н. раствора щелочи, подогрейте раствор. Выделение аммиака из пробирки определяется по специфическому запаху.
Запишите уравнения реакции в молекулярном и ионном виде. Сделайте вывод о направлении протекания изученных реакций, ис-
пользуя константы диссоциации уксусной кислоты и гидроксида аммония (см. прил., табл. 8).
Опыт 5 Получениеирастворениеосадковмалорастворимыхэлектролитов
Малорастворимые осадки выпадают и растворяются при изменении концентраций ионов, образующих соединение, в соответствии со значением ПР этих соединений.
В две пробирки налейте по 1-2 мл 0,1 М раствора хлорида кальция CaCl2 и добавьте по 1-2 мл 0,1 М раствора карбоната натрия Na2CO3. В одну пробирку добавьте немного соляной кислоты, а в другую – уксусной кислоты. Осадок растворяется в той пробирке, где была добавлена соляная кислота. Объясните результаты опыта, используя значения констант диссоциации кислот и ПР CaCO3:
Кд (CH3COOH) = 1,86·10–5; Кд (I) (H2CO3) = 4,3·10–7;
Кд (II) (H2CO3) = 5,6·10–11; ПР= 3,8·10–9.
Напишите уравнения реакций образования и растворения осадка.
Примерырешениятиповыхзадач
П р и м е р 1. Реакция с образованием слабого электролита:
HCl + KOH = H2O + KCl
Р е ш е н и е. Напишем полное ионно-молекулярное уравнение:
H+ + Cl– + K+ + OH– = H2O + K+ + Cl-
В результате реакции образуется слабый электролит − вода; исключив ионы натрия и хлора, получим краткое ионное уравнение:
H+ + OH− = H2O
П р и м е р 2. Реакция с образованием газа:
Химия. Лаб. практикум |
-53- |

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Примеры решения типовых задач
CO2↑
Na2CO3 + H2SO4 = Na2SO4 + H2CO3
H2O
Р е ш е н и е. В результате реакции образуется слабый электролит H2CO3, распадающийся на CO2 и H2O:
2Na+ + CO 23− + 2H+ + 2Cl− = 2Na+ + 2Cl− + H2O + CO2↑
СO 23− + 2H+ = H2O + CO2↑
П р и м е р 3. Реакция растворения осадка:
CaCO3↓ + 2HCl = CaCl2 + 2H2O
Р е ш е н и е. Сильными электролитами являются соляная кислота, хлорид кальция, а слабыми − карбонат кальция и вода, причем вода − более слабый электролит.
Полное ионно-молекулярное уравнение имеет вид
CaCO3↓ + 2H+ + 2Cl– = Сa2+ + 2Cl– + 2H2O
Исключив ионы хлора, получим краткое ионное уравнение:
CaCO3↓ + 2H+ = Ca2+ + 2H2O
Контрольныевопросыизадачи
1.В чем заключается основная причина диссоциации? Как зависит способность электролитов к диссоциации от вида химической связи?
2.Какие вещества называют электролитами? По какому принципу их разделяют на сильные и слабые электролиты?
3.Напишите уравнения электролитической диссоциации известных вам сильных кислот и оснований в воде.
4.Что такое константа диссоциации? Чем она отличается от степени диссоциации и от чего зависит?
5.При каких условиях обменные реакции протекают до конца? Приведите примеры.
6.Что называется произведением растворимости? Каковы условия образования и растворения осадков?
7.Написать все возможные уравнения электролитической диссоциации угольной и сернистой кислот, гидроксида железа (III) и выразить в общем виде их константы диссоциации.
8.Составьте ионные и молекулярные уравнения следующих реакций:
а) CH3COOH + NaOH = … б) Zn(OH)2 + HNO3 = …
Химия. Лаб. практикум |
-54- |

ЛАБОРАТОРНАЯ РАБОТА 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Контрольные вопросы и задачи
в) CuSO4 + H2S = …
г) Fe(OH)3 + KOH = …
д) BaCO3 + HCl = …
Химия. Лаб. практикум |
-55- |
