
- •Компьютерный набор С.Г. Крившенко
- •1 ИСХОДНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ ТЕРМОДИНАМИКИ И МОЛЕКУЛЯРНОЙ ФИЗИКИ
- •2 ИДЕАЛЬНЫЙ ГАЗ
- •3 ВНУТРЕННЯЯ ЭНЕРГИЯ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ. РАБОТА И ТЕПЛОТА. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •4 ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •5 ЯВЛЕНИЯ ПЕРЕНОСА
- •6 СОСТОЯНИЕ РЕАЛЬНЫХ ВЕЩЕСТВ
- •6.1 Твердые тела и их тепловые свойства
- •6.2 Жидкости
- •7 ФАЗЫ И ФАЗОВЫЕ ПРЕВРАЩЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА № 31
- •ОПРЕДЕЛЕНИЕ ТЕРМИЧЕСКОГО КОЭФФИЦИЕНТА ДАВЛЕНИЯ ВОЗДУХА
- •Отсюда
- •Порядок выполнения работы
- •Контрольные вопросы
- •ЛАБОРАТОРНАЯ РАБОТА № 32
- •ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ ВОЗДУХА
- •Контрольные вопросы.
- •ЛАБОРАТОРНАЯ РАБОТА № 41
- •ОПРЕДЕЛЕНИЕ ПРИРАЩЕНИЯ ЭНТРОПИИ ТВЕРДОГО ТЕЛА ПРИ НАГРЕВАНИИ И ПЛАВЛЕНИИ
- •Порядок выполнения работы
- •Контрольные вопросы
- •ЛАБОРАТОРНАЯ РАБОТА № 43
- •Контрольные вопросы
- •ЛАБОРАТОРНАЯ РАБОТА № 44
- •ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТОВ ВНУТРЕННЕГО ТРЕНИЯ ЖИДКОСТИ ПО МЕТОДУ СТОКСА
- •В случае падения шарика в жидкости уравнение движения имеет вид
- •Описание установки
- •Таблица
- •Контрольные вопросы
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ

8
3 ВНУТРЕННЯЯ ЭНЕРГИЯ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ. РАБОТА И ТЕПЛОТА. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Под |
внутренней |
энергиейU |
|
|
|
термодинамической |
системы |
понимается |
|||||||||||||||
суммарная кинетическая энергия теплового движения молекул и потенциальная |
|||||||||||||||||||||||
энергия их взаимодействия. Внутренняя энергия является однозначной функцией |
|
||||||||||||||||||||||
состояния термодинамической системы, т.е. изменение DU |
внутренней |
энергии |
|
||||||||||||||||||||
при переходе системы из состояния1 в состояние 2 не зависит от вида процесса |
|
||||||||||||||||||||||
перехода. Как и |
потенциальная |
|
|
энергия, U |
определяется |
с |
точностью |
до |
|||||||||||||||
произвольной постоянной. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Поскольку силами межмолекулярного взаимодействия идеального газа |
|||||||||||||||||||||||
можно |
пренебречь, |
под внутренней энергиейидеального газа |
понимается |
|
|||||||||||||||||||
суммарная кинетическая энергия теплового движения его молекул. |
|
|
|
|
|
||||||||||||||||||
В соответствии сзаконом равномерного распределения |
энергии |
по |
|||||||||||||||||||||
степеням свободы на каждую степень свободы молекулы в среднем приходится |
|
||||||||||||||||||||||
одинаковая кинетическая энергия, равная 1 2kT . |
|
|
|
|
|
|
|
|
|||||||||||||||
Под |
числом |
степеней свободы тела понимается число |
независимы |
||||||||||||||||||||
координат, которые необходимо задать для того, чтобы полностью определить |
|
||||||||||||||||||||||
положения тела в пространстве. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Число степеней свободы молекулы i |
зависит от числа атомов в молекуле: |
|
|||||||||||||||||||||
для |
одноатомной |
|
молекулыi = 3 , |
|
|
для |
двухатомной i = 5 |
|
(3 |
степени |
|
||||||||||||
поступательного движения и 2 вращательного), для многоатомной молекулы i = 6 . |
|
||||||||||||||||||||||
Таким |
образом, |
средняя |
кинетическая |
|
энергия |
теплового |
движения |
||||||||||||||||
молекулы, имеющей i степеней свободы, равна |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
e |
= |
i |
kT . |
|
|
|
|
|
|
(3.1) |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||
Внутренняя энергия 1 моля идеального газа |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
Um = e |
N= A |
|
|
i |
k ×T × N A = |
i |
RT . |
|
|
|
|
(3.2) |
|
||||||
|
|
|
|
|
2 |
2 |
|
|
|
|
|
||||||||||||
Для произвольной массы газа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
i |
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
U = |
× |
RT . |
|
|
|
|
|
|
(3.3) |
|
||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
||||
По приведённым формулам внутренняя энергия рассчитывается только для |
|
||||||||||||||||||||||
жестких молекул. Учёт колебательных движений может осуществиться введением |
|
||||||||||||||||||||||
дополнительных степеней свободы. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Существуют |
|
два |
|
|
|
способа |
|
изменения |
|
|
внутренней |
||||||||||||
термодинамической системы: путём совершения работы и путём теплообмена. |
|
||||||||||||||||||||||
Количество энергии, переданное системе внешними |
телами |
в форме |
|||||||||||||||||||||
работы, |
называется |
работой |
A , |
совершенной |
|
над системой, |
а |
количество |
|
||||||||||||||
энергии, переданное внешними телами в форме теплоты, называется теплотой Q , сообщенной системе.
В равновесном процессе элементарная работаd A термодинамической системы при изменении её объёма на d V равна

9 |
|
d A = p × dV . |
(3.4) |
В координатах p -V d A графически изображается в |
виде площади, |
ограниченной кривой процесса, осью абсцисс и вертикальными прямыми V =const и V + dV =const (на рисунке 2.3 эта площадь заштрихована).
Для нахождения теплотыQ , сообщенной термодинамической системе,
вводится |
понятие теплоёмкости |
C* , |
под которой |
понимается отношение |
|||||||||||||||
элементарной |
теплоты d Q , |
сообщенной |
системе, |
к |
соответствующему |
||||||||||||||
изменению dT её температуры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
C* = |
dQ |
. |
|
|
|
|
(3.5) |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
dT |
|
|
|
|
|||||
На практике наиболее часто используются удельная и молярная(мольная) |
|||||||||||||||||||
теплоемкости. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Удельной |
теплоемкостью c |
|
называется |
теплоемкость единицы |
массы |
||||||||||||||
однородного вещества |
|
|
|
|
1 |
|
|
dQ |
|
|
|
|
|
|
|||||
|
|
|
|
c = |
× |
. |
|
|
(3.6) |
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
m dT |
|
|
|
|
||||||||
Молярной теплоемкостью называется теплоемкость 1 моля вещества: |
|
||||||||||||||||||
|
|
C = |
M |
× |
dQ= |
|
M × c . |
|
|
(3.7) |
|
||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
m |
|
|
|
dT |
|
|
|
|
|
|
|
|
|||
Таким образом, элементарная теплота d Q , сообщенная системе при изменении ее |
|||||||||||||||||||
температуры на d T , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
dQ = m ×c × dT= |
m |
×C × dT . |
|
(3.8) |
|||||||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|||
И |
теплота и работа |
зависят |
|
от |
вида термодинамического |
.процес |
|||||||||||||
Следовательно, от вида процесса зависит и теплоемкость.
Первое начало термодинамики является выражением закона сохранения
энергии применительно к тепловым процессам: количество |
теплоты d Q , |
сообщенной системе, идёт на изменение её внутренней |
энергииd U и на |
совершение системой работы dA против внешних сил |
|
d Q = dU + d A . |
(3.9) |
Применим первое начало термодинамики к изопроцессам в газах.
1) Изохорный процесс (V =const ). При изохорном процессе d A = p × dV = 0 ,
следовательно, вся |
теплота, сообщенная газу, расходуется на |
повышение его |
||
внутренней энергии |
|
dQ = dU |
(3.10) |
|
|
|
|||
или |
d U = |
m |
×Cv × d T . |
(3.11) |
|
||||
|
|
M |
|
|
10
Из формул (3.3) и (3.11) получаем мольную теплоемкость Cv |
при постоянном |
|||||
объёме |
i |
|
|
|||
|
|
C = |
R . |
(3.12) |
||
|
||||||
|
|
v |
2 |
|
|
|
2) Для изобарного процесса( p = const ) уравнение |
первого начала |
|||||
термодинамики |
|
|
|
|||
|
m |
×Cp × d T = dU + pd V , |
(3.13) |
|||
|
|
|||||
|
M |
|
|
|
||
где Cp - молярная теплоемкость при постоянном давлении.
Из уравнения Клапейрона – Менделеева (2.2) |
|
|||||
|
pd V = |
m |
× R × d T . |
(3.14) |
||
|
|
|||||
|
|
|
M |
|
||
После подстановки (3.11) и (3.14) и (3.13) получаем уравнение Майера для |
||||||
мольных теплоемкостей |
|
|
|
|
||
|
Cp = Cv + R . |
(3.15) |
||||
Подставив |
формулу (3.12) в |
|
выражение (3.15), |
получаем мольную |
||
теплоемкость Cp |
при постоянном давлении |
|
||||
|
Cp = |
i + 2 |
× R . |
(3.16) |
||
|
|
|||||
|
|
|
2 |
|
|
|
3) При изотермическом процессе (T = const ) внутренняя энергия системы |
||||||
не изменяется, следовательно, вся теплота расходуется на совершение работы |
||||||
|
dQ = p × d V . |
(3.17) |
||||
4) Для адиабатного процесса, т.е. для процесса, |
происходящего без |
|||||
теплообмена с внешней средой (d Q = 0 ), уравнение (3.9) запишется в виде |
||||||
|
d A + d U = 0 , |
(3.18) |
||||
т.е. в адиабатном процессе работа совершается за счет убыли внутренней энергии. Параметры состояния при адиабатном процессе связаны уравнениями
Пуассона
|
|
|
|
|
|
pV g |
= const ; |
|
(3.19) |
|
|
|
|
|
|
pT ¶ (1-g ) = const ; |
|
(3.20) |
|
|
|
|
|
|
|
V T 1 (g -1) = const , |
|
(3.21) |
|
где g = |
Cp |
= |
i + 2 |
– показатель адиабаты. |
p |
|
|||
Cv |
i |
|
|
||||||
|
|
|
|
|
|
|
|
||
Линия, |
изображающая |
адиабатный |
|
||||||
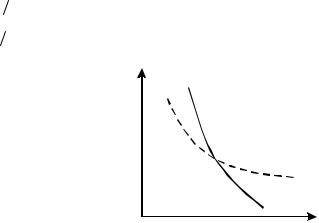
процесс, называется адиабатой. На рисунке 3.1 в |
|
|
|||||||
p -V |
диаграмме |
вид |
адиабаты |
показан |
|
||||
сплошной линией. На этом же рисунке для |
V |
||||||||
сравнения |
|
штриховой |
|
линией |
изображена |
||||
Рисунок 3.1
11
изотерма. Для любого газа g >1, поэтому в p -V диаграмме адиабата идет круче, чем изотерма.
4 ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ |
|
|
|
|
|||
Все реальные тепловые процессы необратимы. В прямом направлении |
|
||||||
необратимые процессы протекают самопроизвольно, |
для |
осуществления |
|||||
обратных |
процессов |
требуется |
одновременное |
|
протекание |
неко |
|
компенсирующих процессов. |
|
|
|
|
|
|
|
Направление протекания процессов определяет 2-е начало термодинамики. |
|
||||||
Приведем несколько его эквивалентных формулировок. |
|
|
|
||||
1) |
Формулировка |
Клаузиуса: |
невозможен |
процесс, |
единственным |
|
|
результатом которого является передача теплоты от холодного тела горячему. |
|
||||||
2) |
Формулировка |
Кельвина: |
невозможен |
процесс, |
единственным |
|
|
результатом которого является совершение работы за счет охлаждения теплового |
|
||||||
резервуара. |
|
|
|
|
|
|
|
3)Никакая тепловая машина периодического действия не может иметь КПД, превышающий КПД цикла Карно при тех же температурах нагревателя и холодильника.
4)Энтропия S изолированной системы не может убывать при любых
происходящих в ней процессах:
|
|
|
|
d S ³ 0 , |
|
|
|
|
(4.1) |
|
|
где знак равенства относится к обратимым процессам, |
знак больше– к |
|
|||||||||
необратимым процессам. |
|
|
|
|
|
|
|
|
|||
В статистической физике возможное направление изменения состояния |
|||||||||||
системы |
оценивается |
с |
помощью |
термодинамической |
вер |
||||||
(статистического веса) |
P состояния системы. |
|
|
|
|
|
|
||||
Статистический |
вес P – |
число |
микросостояний, |
которыми |
может быть |
||||||
реализовано данное макросостояние. |
|
|
|
|
|
|
|
||||
Чем ближе система к состоянию термодинамического равновесия, тем |
|
||||||||||
больше значение P . |
|
|
|
|
|
|
|
|
|
||
Энтропия |
S |
является |
функцией состояния |
системы, она |
связана |
со |
|||||
статистическим весом P формулой Больцмана |
|
|
|
|
|
|
|||||
где k - постоянная Больцмана. |
S = k ×ln P , |
|
|
|
|
(4.2) |
|
||||
|
|
|
|
|
|
|
|
||||
Максимальная |
энтропия |
соответствует состоянию |
равновесия |
системы. |
|||||||
Рост энтропии |
означает, что система |
переходит в более |
вероятное |
состояние. |
|||||||
Рост энтропии при необратимых процессах означает, что в ходе этих процессов система переходит в состояние термодинамического равновесия, при котором никакие процессы невозможны.
12
Вычисление энтропии S с помощью формулы(4.2) невозможно, так как неизвестна величина термодинамической вероятности P .
Клаузиус показал, что в обратимых процессах приведенное количество теплоты, т.е. отношение элементарной теплотыd Q , сообщенной системе, к температуре системы T , является полным дифференциалом энтропии S :
|
|
d S = |
dQ |
. |
(4.3) |
||||||
|
|
|
|
||||||||
|
|
|
|
|
|
d T |
|
||||
Энтропия системы согласно формуле (4.3) может быть определена только с |
|||||||||||
точностью до постоянного слагаемого: |
|
||||||||||
|
S = T |
d Q |
+ S0 , |
(4.4) |
|||||||
|
|
||||||||||
|
ò |
|
T |
|
|||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
где интегрирование производится по произвольному обратимому процессу; S0 – |
|||||||||||
значение энтропии системы при T = 0 K . |
|
||||||||||
Значение S0 определяется с помощью принципаНернста |
или третьего |
||||||||||
начала |
термодинамики, согласно |
|
которому при нуле |
термодинамической |
|||||||
температуры энтропия системы равна нулю, т.е. P =1. |
|
||||||||||
Для необратимого процесса |
|
|
|
|
dQ |
|
|
||||
|
|
|
dS > |
. |
(4.5) |
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
T |
|
|||
Объединяя уравнения (4.3) и (4.5), можно получить математическую запись 2- |
|||||||||||
го начала термодинамики для произвольных процессов в виде |
|
||||||||||
|
|
d S ³ |
d Q |
, |
(4.6) |
||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
T |
|
|||
где знак |
равенства относится |
к обратимым процессам, неравенства – к |
|||||||||
необратимым. |
|
|
|
|
|
|
|
|
|
||
Решая совместно уравнения (4.6) и (3.9), получим выражение |
|
||||||||||
|
T × d S ³ d U + d A , |
(4.7) |
|||||||||
которое представляет собойтермодинамическое тождество, являющееся обобщением первого и второго начал термодинамики.
Для обратимого изотермического процесса неравенство(4.7) запишется в
виде |
|
|
|
d A = T × d S - d=U |
d (T × S -U= ) |
-d F . |
(4.8) |
Величина |
|
|
|
F =U -T × S |
|
(4.9) |
|
является функцией состояния и называетсясвободной |
энергией. Согласно |
||
уравнениям (4.8) и (4.9) свободная |
энергия |
представляет собой ту часть |
|
внутренней энергии системы, которая может быть превращена в работу против
внешних сил при обратимом изотермическом процессе. Величину T × S |
называют |
|
связанной энергией. |
|
|
Из выражения (4.9) |
видно, что свободная энергия тем меньше, чем больше |
|
энтропия. Следовательно, |
энтропия характеризует величину энергии, |
которая не |
