
- •Лекция 4 Адсорбция
- •Структура и применение промышленных адсорбентов
- •Адсорбционные равновесия. Типы изотерм адсорбции.
- •Кинетика адсорбции
- •1) В крупных порах, когда диаметр пор больше средней длины свободного пробега молекул адсорбента, преимущественным видом переноса является нормальная или объемная диффузия.
- •Литература
1) В крупных порах, когда диаметр пор больше средней длины свободного пробега молекул адсорбента, преимущественным видом переноса является нормальная или объемная диффузия.
Основным уравнением кинетики диффузионных процессов в гомогенной среде являются законы Фика. При стационарной адсорбции диффузия происходит в направлении выравнивания концентрации поглощаемого вещества, причем градиент концентрации постоянен во времени. В этом случае скорость адсорбции выражается первым законом Фика:
![]()
(1)
где G - количество диффундирующего вещества; dG/d - скорость диффузии или диффузионный поток; D - коэффициент диффузии (знак минус указывает на уменьшение концентрации адсорбтива в направлении потока; S - поверхность, перпендикулярная направлению потока; c - концентрация адсорбтива в газовой фазе; х - координата длины; dc/dx - градиент концентрации.
Уравнение (1) используют в работах теоретического плана - при изучении механизма переноса адсорбтива в транспортных порах на специальных установках, в которых обеспечивается постоянство градиента концентрации.
Для практических целей больший интерес представляет изучение нестационарной диффузии. Нестационарная диффузия сопровождается адсорбцией, когда концентрация адсорбата в твердой фазе изменяется и градиент концентрации непостоянен. Для описания нестационарной адсорбции пользуются вторым законом Фика:
![]()
(2)
где а - концентрация адсорбата в адсорбированном состоянии.
Скорость нормальной диффузии определяется числом столкновений молекул газа друг с другом. Коэффициент диффузии в этом случае зависит от средней длины тепловой скорости молекул и средней длины свободного пробега молекул :
D = 1/3 . (3)
Величины и , а следовательно, и коэффициент диффузии возрастают при повышении температуры. В приближенных расчетах принимают:
D ~ T1,75 (4)
2) При малом размере пор, когда длина свободного пробега молекул намного больше радиуса пор, фактором, определяющим скорость диффузии, становится частота соударений со стенками пор. Такая диффузия называется молекулярной или кнудсеновской. При столкновении адсорбирующихся молекул с поверхностью они некоторый интервал времени фиксируются на активных центрах адсорбента, а после этого, благодаря тепловому движению, удаляются в газовую фазу. коэффициент молекулярной диффузии определяется средней тепловой скоростью движения молекул и диаметром поры dп:
D = 1/3 dп. (5)
![]() В
то же время:
В
то же время:
(6)
где М - относительная молекулярная масса газа.
Следовательно, коэффициент молекулярной диффузии и температура связаны следующей зависимостью:
D ~ T 0,5 (7)
3) Если поры по размерам соизмеримы с поглощаемыми молекулами, адсорбционный процесс приобретает активированный характер. По аналогии с представлениями Аррениуса, развитыми для химической реакции, при активированной адсорбции не все молекулы могут проникнуть в поры и быть там поглощенными, а лишь те, которые обладают некоторым избыточным запасом энергии. Этот избыток называют энергией активации.
Коэффициент диффузии связан с энергией активации Еа следующей зависимостью:
D=D0 exp-(Ea/RT) (8)
где D0 - предэкспоненциальный множитель.
Величина предэкспоненциального множителя зависит от природы, как адсорбента, так и адсорбтива. Например, предадсорбция полярных веществ на цеолите приводит к частичной блокировке входных окон и, как следствие, понижению скорости сорбции и уменьшению величины D0.
Связь между энергией активации и коэффициентом диффузии (уравнение 8) используют для вычисления энергии активации на основе экспериментальных данных. Для этого исследуют кинетические кривые адсорбции конкретного вещества при двух температурах Т1 и Т2. Соответствующие им коэффициенты диффузии могут быть определены по уравнениям:
D1 = D0 exp-(Ea1/RT1) (9)
D2 = D0 exp-(Ea2/RT2) (10)
Энергия активации практически постоянна, если интервал исследуемых температур Т1-Т2 невелик. Следовательно
Еа1 Еа2 = Еа
О![]() тсюда:
тсюда:
(![]() 11)
11)
(![]() 12)
12)
(13)
Соотношение коэффициентов диффузии может быть заменено на соотношение времен отработки их адсорбционной емкости до любой степени, например 50 %:
(![]() 14)
14)
Энергия активации увеличивается по мере приближения диаметра входного окна поры к диаметру молекул адсорбтива. Например, при переходе от цеолита NaA к КА разница между определяющим размером пор и критическим диаметром молекул становится меньше одного ангстрема, при этом наблюдается резкий рост энергии активации. Таким образом, энергию активации можно рассматривать как молекулярно ситовую характеристику цеолитов.
Зависимость энергии активации от диаметра входного окна d0 описывается уравнением
Еа = Е0 ехр (A dкр/d0)
где Е0 - предэкспоненциальный множитель, А - постоянная величина для каждого адсорбтива, dкр - критический диаметр молекул адсорбата.
Энергия активации зависит также от размера катиона, входящего в состав цеолита. Здесь играют роль два противоположных фактора: с одной стороны, чем меньше катион, тем больше диаметр входного окна и легче проникновение молекул адсорбата в адсорбционную полость, с другой стороны, крупные катионы легче деформируются, способствуя проникновению адсорбируемых молекул.
4) Интенсивность переноса вещества в гранулах промышленных адсорбентов усиливается благодаря миграции молекул по поверхности пор. Этот вид переноса получил название поверхностной диффузии. Движение молекул по поверхности происходит скачкообразно. Если длину скачка обозначить через , а время пребывания молекулы в адсорбированном состоянии через , то коэффициент поверхностной диффузии определится из соотношения
D = 2/4 (15)
В то же время:
= 0 ехр (Е0/RT) (16)
где 0 - период колебания атомов в структуре адсорбента, приблизительно равный 10-13 с.
Тогда:
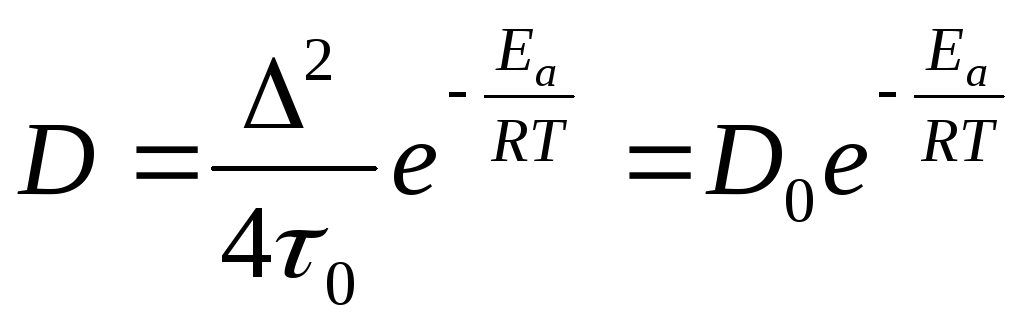
(17)
В этой формуле D0 - коэффициент диффузии двухмерного газа на идеально однородной поверхности, при Т или Еа=0.
Коэффициент поверхностной диффузии связан с температурой следующей зависимостью:
D Tn e-Ea/RT (18)
где n может изменяться от 0,5 до 1,5.
При повышении температуры уменьшается адсорбционная способность и градиент концентрации в адсорбированной фазе. Поэтому роль поверхностной диффузии в общей скорости переноса вещества падает.
