
ЛЕКЦИЯ 4. Химическая связь.
План.
1.Электронная теория химической связи.
2. Ковалентная связь. Полярность связи, дипольный момент.
3. Ионная связь. Оценка степени ионности связи.
4. Донорно-акцепторный механизм образования ковалентной связи.
5. Водородная связь. Силы межмолекулярного взаимодействия.
По выражению г-на Брайка Кроуфорда мл.
« Вопрос о природе химической связи –
сердце всей химии (1953) [3 ].
Химическая связь – взаимодействие атомов между собой, обычно при этом предполагается обмен электронами. Поэтому хим. связь – это обмен электронами между атомами соединения. С другой стороны: хим. связь – сила, удерживающая атомы друг возле друга [1,2]. При взаимодействии атомов происходит взаимодействие между ядрами и электронами атомов.
Для того чтобы между двумя атомами возникла химическая связь, они должны столкнуться и должно произойти понижение суммарной энергии этой системы. Значит, вообще говоря, при реакции
А(г) + В(г) → АВ(г) + Энергия (выделяется!)
Должно происходить выделение энергии. В противном случае предпочтительнее было бы перераспределение электронов между частицами, приводящее к образованию свободных атомов. Это происходит потому, что в нашем мире действует всеобщий закон природы, согласно которому, любая система (живая или неживая) стремится самопроизвольно (без внешних воздействий) перейти в состояние с минимальным запасом энергии. При этом избыток энергии выделяется и рассеивается в окружающей среде. Если молекула АВ характеризуется меньшим запасом энергии, то система перейдет в это состояние; при этом избыток энергии выделится. Если же атомы А и В имеют меньший запас энергии, то наоборот, система перейдет в это состояние. В последнем случае наблюдается образование неустойчивых связей и в большинстве случаев такие связи очень недолговечны.
Поэтому можно с полной уверенностью утверждать, что образование соединений происходит при условии, что возникает энергетическое состояние с более низкой полной энергией, чем у не прореагировавших исходных атомов.
Е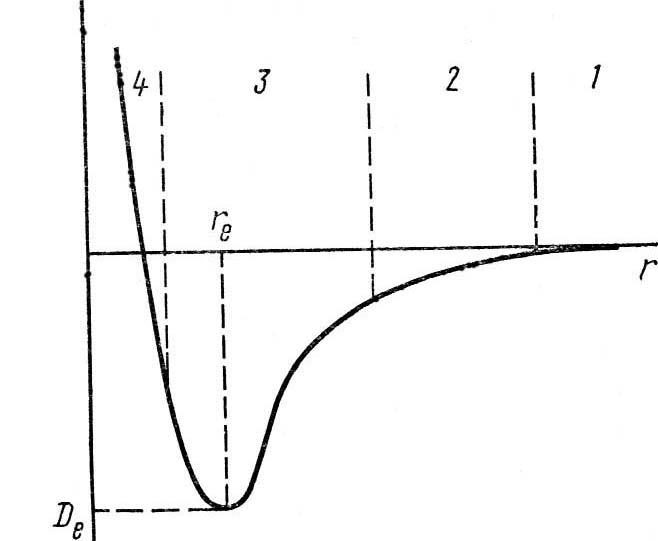 Рассмотрим несколько наиболее
общих признаков химической связи на
примере образования некоторой двухатомной
молекулы. Определяющими
Рассмотрим несколько наиболее
общих признаков химической связи на
примере образования некоторой двухатомной
молекулы. Определяющими
факторами являются межъядерное
расстояние r и энергия взаимодействия
атомов Е. На рисунке показано
изменение энергии в системе из двух постепенно сближающихся атомов. Сначала атомы разделены большим расстоянием и энергия их взаимодействия близка к 0 (область 1). При сближении атомов между ними возникает слабое взаимодействие (область 2). Когда межъядерное расстояние становится сравнимым с размерами электронных оболочек (область 3) между атомами появляются 2 конкурирующих взаимодействия. Во-первых, притяжение между ядром одного атома и электронами другого. Во-вторых, отталкивание, действующие между одноименно заряженными ядрами и электронами обоих атомов. Сначала превалирует притяжение и энергия продолжает уменьшаться вплоть до расстояния re, которому соответствует минимальное значение энергии взаимодействия между атомами Dе. При дальнейшем сближении увеличиваются силы отталкивания, и энергия снова резко возрастает. Таким образом, атомы занимают наиболее стабильное положение друг возле друга, соответствующее расстоянию re и минимальной энергии. Вполне логично предположить, что это расстояние соответствует ситуации, когда силы отталкивания уравновешиваются силами притяжения, так что равнодействующая равна 0. Так образуется химическая связь. А молекулы типа O2, H2, N2 могут быть количественно охарактеризованы указанием равновесного межъядерного расстояния (длина связи) и энергии связи (она же энергия диссоциации – разрушения связи).
Ковалентная связь
Ковалентная связь образуется парой электронов, распределенной между двумя атомами, которые обобществляют эту пару. Обобществленные электроны находятся на орбитали, которая принадлежит обоим атомам, и испытывают одновременное действие двух атомных ядер. Увеличение электронной плотности в пространстве между ядрами вызывает усиление электростатического взаимодействия в этом пространстве между ядрами и электронами. А это сопровождается понижением энергии системы.

 Если атомы
идентичны, распределение обобществляемых
электронов оказывается симметричным,
поскольку они испытывают влияние двух
одинаковых ядер. Такая связь называется
неполярной ковалентной связью. В этом
случае центр распределения отрицательного
заряда электронов совпадает с центром
положительного заряда ядер. И электронное
облако молекулы (рисунок 1) напоминает
электронное облако атома, но у молекулы
оно вытянуто в направлении связи.
Если атомы
идентичны, распределение обобществляемых
электронов оказывается симметричным,
поскольку они испытывают влияние двух
одинаковых ядер. Такая связь называется
неполярной ковалентной связью. В этом
случае центр распределения отрицательного
заряда электронов совпадает с центром
положительного заряда ядер. И электронное
облако молекулы (рисунок 1) напоминает
электронное облако атома, но у молекулы
оно вытянуто в направлении связи.
δ-
т
δ+
0< δ+ < 1 и 0> δ– > -1.
Э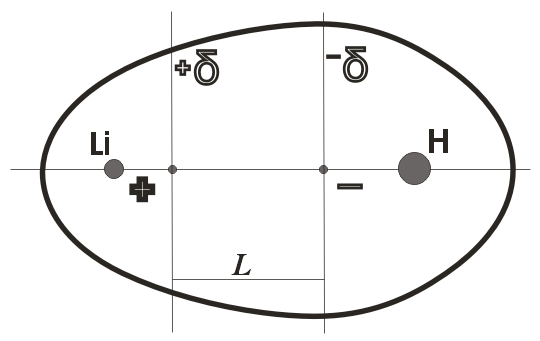 тот
условный заряд, который возникает на
атомах при образовании связи за счет
смещения связывающей электронной пары,
называют степенью
окисления
(СО).
тот
условный заряд, который возникает на
атомах при образовании связи за счет
смещения связывающей электронной пары,
называют степенью
окисления
(СО).
Чем больше разность ЭО у атомов А и В, тем сильнее приближаются δ+ и δ– к своим предельным значениям. Химическая связь, при которой центр распределения отрицательного заряда электронов смещен вдоль оси связи относительно центра положительного заряда ядер, называется полярной ковалентной связью. В структурных формулах связь обозначается чертой, а ковалентная полярная – стрелкой, направленной в сторону более электроотрицательного атома:
H – H, O = O, Hδ+ → Clδ – , т. к. ЭО(Н)<ЭО(Cl).
Такая связь обладает дипольным моментом. Дипольный момент образуется за счет смещения центров положительного и отрицательного зарядов на некоторую величину l – длину диполя (рисунок).
Дипольный момент определяют экспериментально сразу как произведение :
μ = еl, где е – величина заряда, l – расстояние между центрами зарядов.
В качестве единицы измерения дипольных моментов принят дебай (названный в честь голландского физика П.Дебая, разработавшего теорию полярных молекул). В системе СИ 1D = 0,33•10–29 Кл•м.
Молекулы с полярной связью могут быть сами полярными, а могут и не быть. Все зависит от симметрии молекулы. Полярные молекулы поляризуются в электрическом поле, устанавливаясь по силовым линиям поля, ориентируются в электрических полях, создаваемых ионами в растворах, взаимодействуют между собой, замыкая свои электрические поля (рис. ).
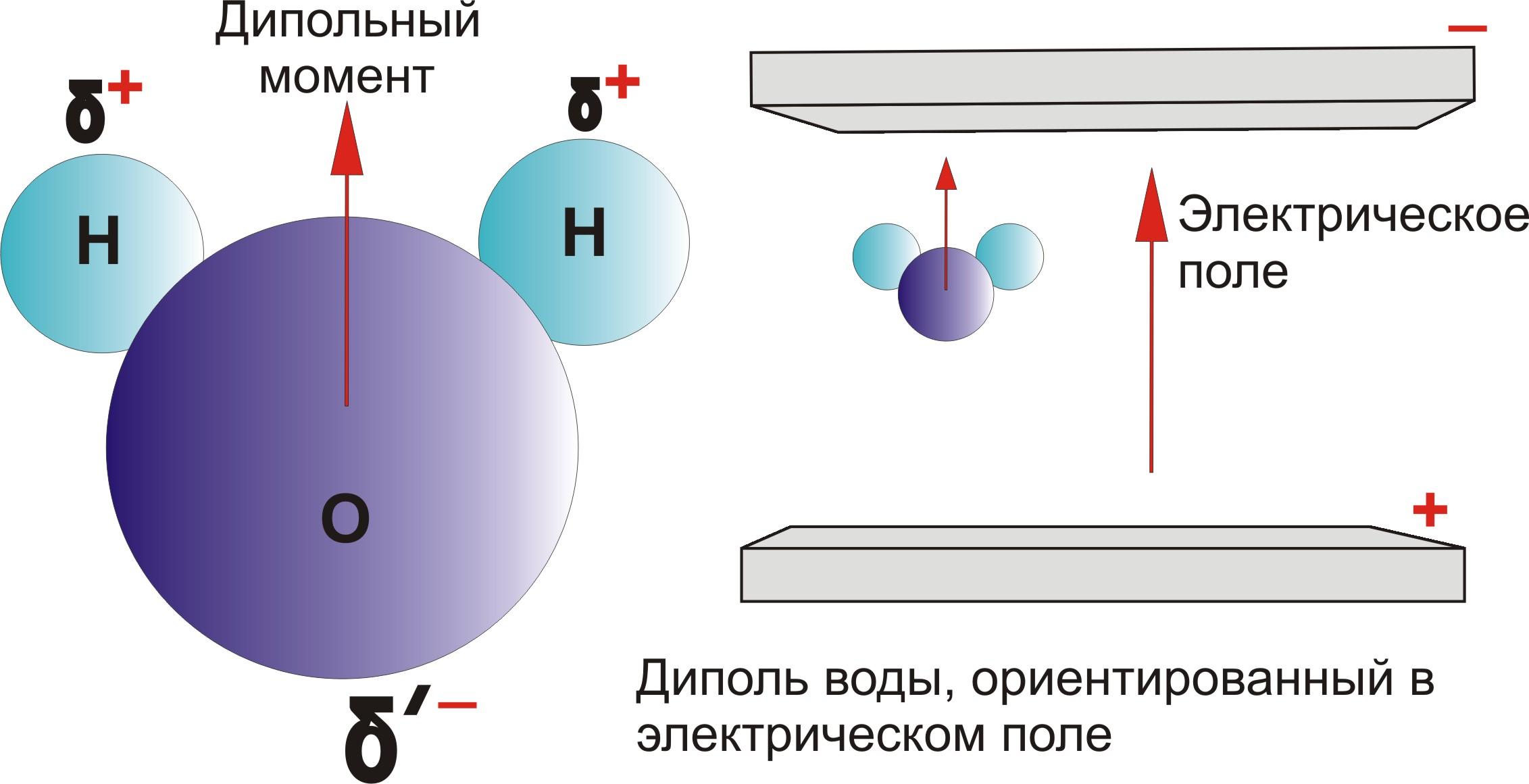
На свойстве диполей воды ориентироваться в электромагнитном поле основано действие микроволновых печей. Частоты микроволнового излучения лежат в пределах от 109 Гц до 5• 1012 Гц. Микроволновое излучение – это поток электромагнитных волн, в которых напряженность электрического и магнитного полей периодически изменяется. Следовательно меняется и ориентация диполей воды с очень высокой частотой. За счет усиления колебательного движения молекул воды внутри твердых тел увеличивается кинетическая энергия молекул воды, что в свою очередь приводит к повышению температуры.
Следует отметить, что различают дипольный момент связи и дипольный момент молекулы. Последний представляет собой векторную сумму дипольных моментов всех связей молекулы. Например, приведенная выше молекула гидрида лития обладает дипольным моментом, а молекула СО2 не обладает, хотя связь С=О имеет момент 2,7D, но поскольку молекула О=С=О линейна, то векторная сумма дипольных моментов связей равна 0. Нулевым дипольным моментом обладают все симметричные молекулы, например, AlCl3, CH4, CCl4, BeH2.
Ковалентная связь обладает высокой энергией связи, т.е. очень устойчива. Устойчивость ковалентной связи может быть объяснена одновременным притяжением пары обобществленных электронов к ядрам двух атомов. Вместе с тем необходимо учитывать и наличие сил отталкивания между ядрами и электронными облаками связанных атомов. При этом ясно, что какому бы атому первоначально ни принадлежал электрон, в молекуле он притягивается одновременно двумя ядрами.
При образовании ковалентной связи обобществляемые электроны занимают так называемую связывающую орбиталь. Квантовая теория налагает на свойства этой орбитали определенные ограничения, как и в случае атомной орбитали:
-
согласно принципу запрета Паули, два связывающих электрона, находящиеся на одной орбитали, должны обладать противоположными спинами;
-
на связывающей орбитали не может находиться более 2 электронов.
Д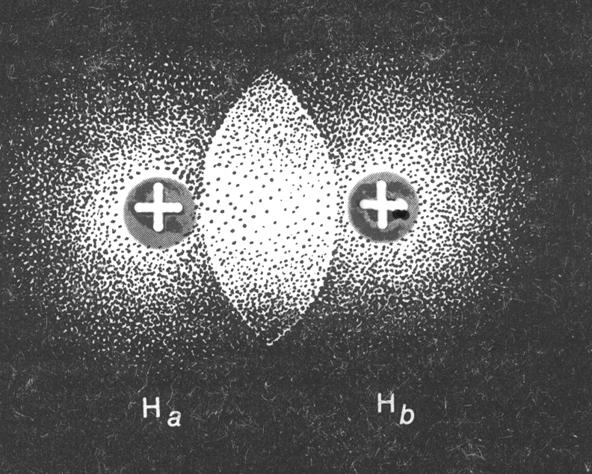 ля
объяснения понижения энергии при
образовании ковалентной связи разработаны
2 теории. Исторически 1-й появилась теория
валентных связей, которая смогла в общих
чертах объяснить геометрическое строение
молекул. Эта теория исходит из представления
об образовании ковалентных связей при
перекрывании атомных орбиталей. При
сближении 2-х атомов их орбитали проникают
друг в друга (перекрываются), и при этом
образуется связывающая орбиталь.
ля
объяснения понижения энергии при
образовании ковалентной связи разработаны
2 теории. Исторически 1-й появилась теория
валентных связей, которая смогла в общих
чертах объяснить геометрическое строение
молекул. Эта теория исходит из представления
об образовании ковалентных связей при
перекрывании атомных орбиталей. При
сближении 2-х атомов их орбитали проникают
друг в друга (перекрываются), и при этом
образуется связывающая орбиталь.
Рис. 3.
Как это происходит показано на примере перекрывания 1s-орбиталей 2-х атомов водорода (рисунок 3). Если спины 2-х электронов имеют противоположное направление, при сближении атомов происходит понижение энергии системы, которое обусловлено появлением в системе новых сил притяжения между ядрами и электронами. Оно происходит до тех пор, пока при достаточно малом расстоянии между ядрами не начнется очень быстрое возрастание межъядерного отталкивания. Таким образом, минимум энергии системы соответствует определенному расстоянию между ядрами атомов. Например, для молекулы водорода это расстояние равное 0,74 Å. Если же электроны будут иметь параллельные спины, потенциальная энергия пары атомов монотонно повышается при их сближении. При таких обстоятельствах химическая связь не образуется, так как минимальной энергии системы будет соответствовать удаление атомов на бесконечное расстояние друг от друга.
