- •16 Компьютеные измерительные системы в исследованиях растворов электролитов свойства растворов электролитов
- •Электролитическая диссоциация
- •Лабораторная работа 1: Зависимость электропроводности от концентрации сильного электролита Цель работы
- •Приборы и реактивы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Кондуктометрическое титрование
- •Лабораторная работа 2: Определение концентрации щелочи с помощью хронокондуктометрического титрования. Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Лабораторная работа 3: Определение концентраций сильной и слабой килот с помощью хроно-кондуктометрического титрования. Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Растворимость малорастворимых солей
- •Лабораторная работа 4: Определение произведения растворимости малорастворимой соли
- •Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Потенциометрия
- •Лабораторная работа 5: Определение концентрации раствора сильного основания методом потенциометрического титрования
- •Цель работы
- •Приборы и реактивы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Лабораторная работа 6: Определение констант диссоциации многоосновной кислоты
- •Цель работы
- •Приборы и реактивы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Диссоциация слабых электролитов
- •Лабораторная работа 7: Определение степени и константы диссоциации слабой кислоты Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Выполнение работы с использованием дозатора
- •Химические равновесия в растворах электролитов. Гидролиз солей
- •Лабораторная работа 7: Изучение гидролиза солей Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Обработка результатов.
- •Буферные растворы
- •Лабораторная работа 7: Изучение свойств ацетатных буферных растворов Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента и обработка результатов
Электролитическая диссоциация
Для количественной характеристики явления электролитической диссоциации используются данные об электропроводности растворов. Электропроводностьюназывается величина обратная электрическому сопротивлению. Она измеряется в Cименсах. (1См=1Ом-1). Величина, обратная удельному сопротивлению называетсяудельной проводимостьюи представляет собой величину численно равную электропроводности единицы объема, помещенного между параллельными электродами единичной площади, находящимися на расстоянии, равном единице. Удельная проводимость измеряется в См/м. Часто удельную электропроводность измеряют в См/см.
1/R = s/l (1)
Под действием электрического поля ионы приобретают направленное движение, скорость которого пропорциональна градиенту потенциала –U/l.
vi= (ezi/R)(U/l), (2)
где e – элементарный электрический заряд (заряд электрона); zi – количество элементарных электрических зарядов, которое несет один ион (зарядность иона) U - разность потенциалов между электродами; l - расстояние между электродами; R - фактор, характеризующий сопротивление среды, зависящий от температуры, природы иона и растворителя.
Коэффициент пропорциональности в этом выражении является величиной, характерной для каждого вида ионов и называется электрической подвижностью ионаилиабсолютной скоростью(размерность этой величины м2/Вс). Численно она равна скорости движения иона при единичном градиенте потенциала. Величины подвижностей ионов зависят от сопротивления, которое испытывают ионы при своем движении в растворе. Чем меньше сопротивление, тем больше подвижность. Сопротивление же увеличивается с увеличением размеров гидратной оболочки иона, электростатического взаимодействия между ионами и вязкостью раствора.
ui=ezi/R, (3)
Плотность тока переносимого катионами и анионами, пропорциональна их заряду, концентрации и скорости направленного движения:
j+= z+c+u+(U/l)F, (4)
j-= z-c-u-(U/l)F, (5)
где F -число Фарадея (96484,56 Кл/моль).
Суммарная плотность тока ионов обоих знаков
j= j++ j-=zici(U/l)F(u++ u-), (6)
так как z+c+=z-c-=zici, где через zi и сiобозначены соответственно заряд и концентрация i-того иона.
Согласно закону Ома плотность тока, проходящего через единичное сечение проводника можно выразить следующим образом:
j = I/s =U/Rs = U/l (7)
Из приведенного выше определения удельной электропроводности можно найти ее величину через подвижности ионов:
ziciF (u++ u-) (8)
Cильные электролиты диссоциируют в растворах полностью, поэтому концентрацию ионов любого знака можно выразить через молярную концентрацию электролита в растворе с(М): ci=ic/1000, гдеI- число ионов данного знака в молекуле электролита. Следовательно
ziciF(u++ u-)=ziicF(u++ u-)/1000=zcF(u++ u-)/1000, (9)
где z = zii - число граммов-эквивалентов в 1 моль.
Из
этого уравнения следует, что удельная
электрическая проводимость сильных
электролитов зависит от концентрации
электролита, валентного типа электролита,
т.е. количества зарядов ионов и их
подвижности.![]()
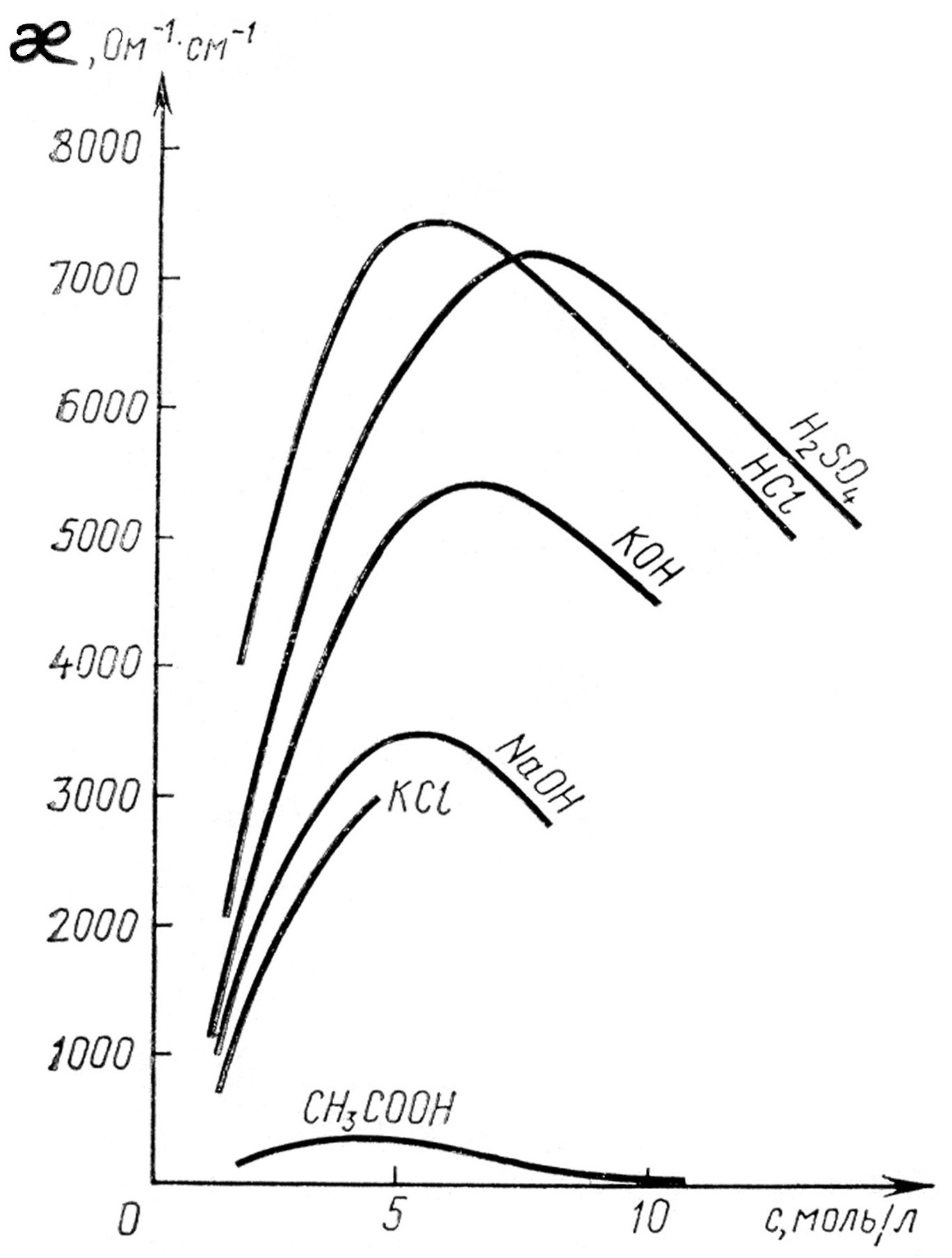
С увеличением концентрации удельная электропроводность сначала растет, а затем падает. Появление максимума на зависимости удельной электропроводности от концентрации связано с тем, что при малых концентрациях расстояние между ионами велико, электростатическое взаимодействие между ними незначительно и удельная электропроводность растет из-за увеличения концентрации электрических зарядов. При больших концентрациях взаимодействие усиливается и подвижность ионов уменьшается в большой степени, чем растет их концентрация.
При растворении слабых электролитов даже в полярных растворителях, имеющих высокую диэлектрическую проницаемость, часть молекул не диссоциирует. Степень диссоциации слабых электролитов зависит от концентрации. При бесконечном разведении, а в концентрированных растворах.
Концентрация ионов в растворах слабых электролитов зависит от степени диссоциации. С учетом этого выражение для удельной электрической проводимости слабого электролита принимает вид:
ziciF(u++ u-)= ziicF(u++ u-)=zcF((u++ u-)/1000 (10)
Можно считать, что электростатические взаимодействия ионов в растворах слабых электролитов отсутствуют, поскольку концентрация ионов в них невелика, а расстояние между ними значительны. Поэтому подвижности ионов почти не зависят от концентрации раствора. Вследствие этого можно сказать, что удельная проводимость растворов слабых электролитов зависит от произведения c. Пока концентрация раствора не очень велика, это произведение увеличивается с ростом концентрации, и удельная электрическая проводимость растет. Однако при больших концентрациях это произведение уменьшается, вследствие чего удельная электропроводность снижается. Таким образом, зависимость удельной электропроводности от концентрации для слабых электролитов имеет подобный характер с аналогичной зависимостью для сильных электролитов. Однако максимум на зависимости для слабых электролитов гораздо менее выражен и значения удельной электропроводностей для слабых электролитов приблизительно на порядок меньше, чем для сильных. Зависимости удельных электропроводностей от концентраций растворов некоторых сильных и слабых электролитов представлены на рис. 1.
Помимо удельной электрической проводимости растворы электролитов характеризуются молярными и эквивалентными электрическими проводимостями.
Молярная электрическая проводимость раствора есть мера электрической проводимости всех ионов, образующихся при диссоциации одного моль электролита при данной концентрации. Молярной электрической проводимостьюназывается величина численно равная электрической проводимости объема раствора, заключенного между двумя параллельными электродами с межэлектродным расстоянием равным единице, причем каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 моль растворенного вещества.
|
|
|
|
Рис.1. Зависимость удельной электрической проводимости от концентрации растворов электролитов. |
Рис. 2. Зависимость эквивалентной электрической проводимости от разведения растворов электролитов. |
Между молярной и удельной электрическими проводимостями имеется соотношение:
m/с=V, (11)
где - молярная электрическая проводимость, измеряемая в Смм2/моль;- удельная электрическая проводимость, См/м; V - разведение раствора, м3/моль; с - концентрация, моль/м3.
Если концентрация раствора выражена в моль/литр, то приведенное выше уравнение будет иметь вид:
m10-3/с (12)
Эквивалентной электрической проводимостьюназывается величина численно равная электрической проводимости объема раствора, заключенного между двумя параллельными электродами с межэлектродным расстоянием равным единице, причем каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 грамм-эквивалент растворенного вещества. Аналогично молярной электропроводности эквивалентная электропроводность может быть выражена через удельную электропроводность и разбавление:
экв.1000/с'=1000V', (13)
где c'- концентрация, выраженная в грамм-эквивалент/литр, а V'- разведение, выраженное в литр/грамм-эквивалент. Так как с и с'связаны между собой уравнением с'=zc, где z- число грамм- эквивалентов в одном моль или z=1/f, где f -фактор эквивалентности, то молярная и эквивалентная электропроводность будут связаны между собой следующим соотношением:
mzэкв(14)
Если выразить удельную электропроводность через электрические подвижности ионов, то получаются следующие выражения для молярной и эквивалентной электропроводности сильных электролитов:
mz F (u++ u-) (15)
эквF (u++ u-) = F u++F u-=++-(16)
Произведения Fu+=+и Fu-=-называют эквивалентными электрическими проводимостями катиона и аниона.
Эквивалентная электрическая проводимость сильных электролитов возрастает с увеличением разведения вследствие уменьшения электростатического взаимодействия между ионами. Согласно теории сильных электролитов Дебая-Хюккеля каждый ион полностью диссоциированного электролита окружен ионами противоположного знака, которые образуют так называемую ионную атмосферу.
При наложении внешнего поля центральный ион и ионная атмосфера, как обладающие зарядами, одинаковыми по величине, но обратными по знаку, движутся в противоположные направления. Силы межионного взаимодействия вызывают взаимное торможения ионов при их движении в электрическом поле. Движение ионной атмосферы в сторону, противоположную центральному иону, вызывает электрофоретическое торможение. Второй эффект торможения обусловлен нарушением симметрии расположения ионной атмосферы вокруг центрального иона при его движении под действием поля. Рассеивание существующей и образование новой атмосферы вокруг движущегося иона происходит не мгновенно. Для этого требуется некоторое время – так называемое время релаксации, и поэтому позади движущегося иона всегда находится некоторый избыток заряда противоположного знака, тормозящего его движение. Это торможение называют релаксационным.
Чем выше концентрация раствора, тем значительнее эти эффекты, вызывающие уменьшение подвижности ионов, и, следовательно, эквивалентной электропроводности электролитов.
Зависимость эквивалентной и молярной электропроводности от концентрации электролита выражается эмпирической формулой Кольрауша:
0-A![]() , (17)
, (17)
которая хорошо согласуется с экспериментальными данными для разбавленных растворов с концентрацией до 210-2моль/л
В бесконечно разбавленных растворах электролитов межионное взаимодействие становится исчезающе малым, и эквивалентная электропроводность стремится к предельному значению 0. Следует отметить, что0не является эквивалентной электропроводностью чистого растворителя.0- это предельная эквивалентная проводимость при с'0.
Для предельных эквивалентных электропроводностей можно переписать, полученное выше уравнение:
00,++0,-(18)
и получить выражение, которое называется вторым законом Кольрауша.
В растворах слабых электролитов межионные взаимодействия слабы и ионы движутся независимо друг от друга при любой концентрации. Степень диссоциации может быть найдена из соотношений:
экв0экв=m0m (19)
Эквивалентная электропроводность слабых электролитов резко уменьшается с ростом концентрации. Причиной этого является уменьшение степени диссоциации. Зависимости эквивалентных электропроводностей от разведения для сильных и слабых электролитов приведены на рис. 2.
С повышением температуры вязкость и диэлектрическая проницаемость растворителя уменьшается. Общее влияние этих двух факторов на эквивалентную электропроводность при температурах близких к комнатной приводит к тому, то при повышении температуры на 10С эквивалентная электропроводность увеличивается на 1,5-2,5%. Поэтому при измерении электропроводности раствор электролита необходимо термостатировать.