
- •16 Компьютеные измерительные системы в исследованиях растворов электролитов свойства растворов электролитов
- •Электролитическая диссоциация
- •Лабораторная работа 1: Зависимость электропроводности от концентрации сильного электролита Цель работы
- •Приборы и реактивы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Кондуктометрическое титрование
- •Лабораторная работа 2: Определение концентрации щелочи с помощью хронокондуктометрического титрования. Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Лабораторная работа 3: Определение концентраций сильной и слабой килот с помощью хроно-кондуктометрического титрования. Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Растворимость малорастворимых солей
- •Лабораторная работа 4: Определение произведения растворимости малорастворимой соли
- •Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Потенциометрия
- •Лабораторная работа 5: Определение концентрации раствора сильного основания методом потенциометрического титрования
- •Цель работы
- •Приборы и реактивы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Лабораторная работа 6: Определение констант диссоциации многоосновной кислоты
- •Цель работы
- •Приборы и реактивы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Диссоциация слабых электролитов
- •Лабораторная работа 7: Определение степени и константы диссоциации слабой кислоты Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Выполнение работы с использованием дозатора
- •Химические равновесия в растворах электролитов. Гидролиз солей
- •Лабораторная работа 7: Изучение гидролиза солей Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Обработка результатов.
- •Буферные растворы
- •Лабораторная работа 7: Изучение свойств ацетатных буферных растворов Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента и обработка результатов
Обработка результатов
Определив по графику (см. рис. 6) интервал времени, соответствующий координате излома на графике, рассчитать концентрацию раствора NaOH по формуле:
сHClV(мл)= cNaOHvtизлома,
где сHCl–концентрация соляной кислоты (г-экв/литр); V(мл) – объем этой кислоты в мл (рекомендуемый объем – 100 мл); cNaOH– неизвестная, определяемая студентом концентрация NaOH (г-экв/литр) (рекомендуемая концентрация 0,10,03 г-экв/литр); v- скорость истечения раствора NaOH, мл/мин, t – время излома (мин) (точка эквивалентности). В приведенном примере неизвестную концентрацию NaOH можно определить по формуле:
cNaOH= 0,004100/0,6186,84 = 0,095 г-экв/литр
Ошибка определения в данном примере не превышает 0,002 г-экв/литр.
По данным графика рассчитать тангенс угла наклона каждого из прямолинейных участвов кривой титрования. Объяснить различие в наклонах этих прямых.
При титровании соляной кислоты раствором гидроксида натрия происходит замещение ионов водорода менее подвижными ионами натрия, и вследствие этого электрическая проводимость раствора будет понижаться. После прохождения точки эквивалентности электрическая проводимость раствора возрастает, вследствие увеличения числа ионов
натрия и гидроксила. Так как подвижность ионов гидроксила меньше, чем подвижность ионов водорода, то линия электрической проводимости до точки эквивалентности (излом на кривой) падает круче, чем поднимается после этой точки:
tg1=1,7210-4,
tg2= 1,1110-4,
tg1/ tg2=1,55.
Сравните это отношение с отношением подвижности иона водорода и иона гидроксила. (1,7 при температуре 250С).
Лабораторная работа 3: Определение концентраций сильной и слабой килот с помощью хроно-кондуктометрического титрования. Цель работы
Показать возможность дифференцированного титрования ряда кислот или оснований методом кондуктометрического титрования (хронокондуметрического титрования).
Приборы и материалы
Компьютер с компьютерной измерительной системой "Вернье"
.Датчик удельной электрической проводимости.
Механическая мешалка.
Жидкостной дозатор
Стаканчики (емкостью 200мл), 4шт.
Раствор NaOH, 0,1 М, 500мл.
Раствор KСl 0,01 М, 100мл.
Раствор HСl 0,08 М, 100 мл
Раствор CH3COOH0,08М, 100 мл
Дистиллированная вода.
Мерные колбы емкостью 100 мл, 3шт.
Пипетка емкостью 5 мл, 1шт.
Промывалка
Емкость для слива реактивов.
Лабораторный термометр.
Мерный цилиндр емкостью 10 мл.
Секундомер.
Последовательность проведения эксперимента
Подготовить установку, как это описано в предыдущей лабораторной работе. (Ввести калибровку, максимальные и минимальные значения удельной электропроводности, время эксперимента). На экране компьютера должны высветиться координатные оси и табличка "Press to begin measurement".
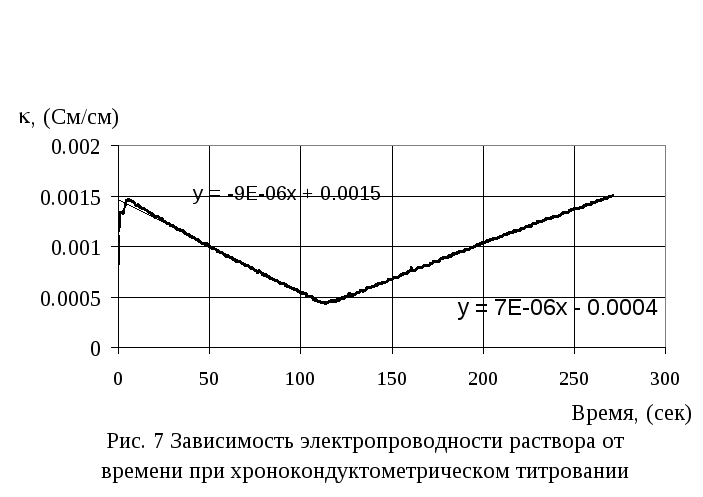
Приготовить 500 мл. 0,1 М раствора NaOH из стандарт-титра. Приготовить 100 мл исследуемого раствора, смешав 50 мл 0,004МHCl и 50 мл 0,004МCH3COOH. Титрование производить точно также как и в предыдущей демонстрации. За 15 минут на экране возникает картина, представленная на рис. 7.
Кривая титрования характеризуется наличием двух изломов, первый из которых соответствует точке эквивалентности сильной кислоты, второй – слабой. С помощью программы Excel рассчитать координаты изломов и определить концентрации кислот.
