
- •III.2 Ароматичні вуглеводні
- •2.1 Ароматичність. Будова молекули бензену
- •2.2 Класифікація, номенклатура
- •2.3 Ізомерія
- •2.4 Фізичні властивості
- •2.5 Хімічні властивості бензену
- •Ііі.2.6 Вплив замісників на реакційну здатність ароматичних сполук
- •2.7 Хімічні особливості гомологів бензену
- •2.8 Властивості поліядерних аренів
- •2.9 Одержання аренів
- •2.10 Використання аренів
2.3 Ізомерія
Ізомерія монозаміщених аренів зумовлена будовою замісника, наприклад:

Пропілбензен Ізопропілбензен
 У
ди- і багатозаміщених гомологів бензену
виникає ще один вид ізомерії, зумовлений
різним положенням замісників:
У
ди- і багатозаміщених гомологів бензену
виникає ще один вид ізомерії, зумовлений
різним положенням замісників:
О-Ксилол м-Ксилол n-Ксилол
2.4 Фізичні властивості
Моноядерні арени – безбарвні легкі рідини з густинами 0,8-0,9 г/мл, нерозчинні у воді, але добре розчинні у малополярних розчинниках.
Сами вони теж є добрими розчинниками. Температури кипіння гомологів бензену зростають із підвищенням молекулярної маси: кожна нова група –СН2- збільшує температуру кипіння у середньому на 20-300. Всі арени мають характерні запахи, деякі (толуол) виявляють помітну наркотичну дію.
Бензен і більшість конденсованих поліаренів належать до високотоксичних речовин. Вдихання їх парів викликає головний біль, а при високих концентраціях – отруєння. Пари бензену вражають слизисту оболонку ока. А рідкий бензен може проникати через шкіру. Для нього характерна кумулятивність, тобто виявлення токсичної дії при поступовому накопиченні в організмі.
Поліядерні арени – білі тверді речовини, майже без запаху, слизькі на дотик, нерозчинні у воді.
2.5 Хімічні властивості бензену
Незважаючи на велику ненасиченість аренів, для них не характерні реакції приєднання. Більш того, ненасиченість бензену не відкривається за допомогою звичайних якісних реакцій: він не знебарвлює ні бромну воду, ні розчин KMnO4.
Хімічні властивості аренів зумовлюються, у першу чергу, наявністю спряженої системи і високою енергією делокалізації, або енергії спряження, тому бензен і його гомологи вступають переважно в такі реакції, при яких зберігається їх ароматичність, тобто в реакції електрофільного заміщення SE,механізм яких складається з декількох послідовних стадій.
1) Генерування електрофільного реагентуу відповідних умовах під впливом каталізатора, який сприяє поляризації, а потім і розриву звязків у молекулі:
Поляризація
молекули +– Розрив звязку
Е – А --------------------- E – Y ------------------------ E+ + A-
Каталізатор
Утворення -комплексу.Початкова атака електрофілом Е+-електронної хмари бензенового кільця протікає швидко і без порушення ароматичності системи:

 Швидко
Швидко
+ Е+---------------
--------------
-комплекс
3 )Утворення
-комплексу
– повільна стадія, під
час якої електрофіл Е+
утворює -звязок
з одним із атомів Карбону за рахунок
двох -електронів
спряженої системи. При цьому атом Карбону
переходить із sp2-
уsp3-гібридизований
стан, ароматичність системи порушується,
тому що у кільці залишається тільки
чотири-електрони,
які розподіляються на пятьsp2-гібридизованих
атомів Карбону. Молекула перетворюється
в-комплекс –
карбкатіон, точніше –аренонієвийкатіон:
)Утворення
-комплексу
– повільна стадія, під
час якої електрофіл Е+
утворює -звязок
з одним із атомів Карбону за рахунок
двох -електронів
спряженої системи. При цьому атом Карбону
переходить із sp2-
уsp3-гібридизований
стан, ароматичність системи порушується,
тому що у кільці залишається тільки
чотири-електрони,
які розподіляються на пятьsp2-гібридизованих
атомів Карбону. Молекула перетворюється
в-комплекс –
карбкатіон, точніше –аренонієвийкатіон:
Повільно
--------------------- sp3-Гібридизований
атом Карбону
-Комплекс -Комплекс
(аренонієвий катіон)
4) Повернення ароматичності.Оскільки втрата ароматичності енергетично невигідна, система прагне повернути її найпростішим шляхом, а саме – відщепленням протону Н+від-комплексу. Внаслідок цього два електрони, що утворювали звязок С-Н, приєднуються до тих чотирьох-електронів, що були у-комплексі. Тому замкнута шестиелектронна система поновлюється і молекула переходить в ароматичний стан:



. . Швидко
---------------------- + H+
-Комплекс Продукт Протон
5) Утворення побічного продукту.Відщеплений протон взаємодіє з негативно зарядженим аніоном А-, що утворився при розриві звязків у молекулі реагенту на перший стадії:
Н++ А------- HA
Побічний продукт
 У
загальному вигляді механізм реакції
електрофільного заміщення в аренах
можна зобразити схемою:
У
загальному вигляді механізм реакції
електрофільного заміщення в аренах
можна зобразити схемою:
-H+
+ Е+ ----- ---------
Субстрат Електрофіл -Комплекс-Комплекс Продукт
Розглянемо найважливіші реакції електрофільного заміщення SE.
Галогенуваннябензену проходить тільки у присутності каталізаторів – так званих кислот Льюіса (речовин, здатних звязувати вільну електронну пару) :AlCl3, FeCl3, AlBr3, FeBr3, SnCl4, TiCl4, BF3. Практичного значення набули реакції хлорування та бромування. Реакція з хімічно активнимF2 протікає деструктивно, а з І2– з малим виходом завдяки низькій реакційній здатності йоду.


800C
+ Br2 ----------------- + HBr
HAlr3
Бромбензол


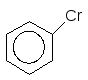
250C
+ Cl2 -------------------- + HCl
AlCl3
Механізм реакції галогенування:
 Hal : Hal + FeHal3
--
Hal+ +
[FeHal4]-
Hal : Hal + FeHal3
--
Hal+ +
[FeHal4]-


+ Hal+ --- --- + H+
Субстрат
-Комплекс -Комплекс
 Галогенопохідний
Галогенопохідний
продукт
Н++[FeHal4]- ------- HHal + FeHal4.
2) Нітрування.Бензен реагує дуже повільно навіть з концентрованоюHNO3 при нагріванні, але при дії на нього нітрувальною сумішшю (суміш концентрованихHNO3 i H2SO4) досить легко перетворюється на нітропохідні.
Електрофільною частинкою є нітроїл-катіон NO2+, який утворюється за схемою:
HO-NO2(к) +2H2SO4 (к) 2HSO4- + H3O+ + NO2+


500С
+ HO-NO2(к)-------------- + H2O
H2SO4 (к)
Бензен Нітробензен
3) Сульфування. Бензен сульфується при звичайній температурі олеумом (розчинSO3 у 100%-нійH2SO4) або чадною сірчаною кислотою, яка даєSO3 внаслідок рівноваги:
2H2SO4 SO3 + H3O+ + HSO4-.
Отже, електрофільним реагентом є оксид Сульфуру (ІV), оскільки за рахунок трьох електронегативних атомів Оксигену, які відтягують на себе електронну густину звязків S = 0, на атомі Сульфуру виникає великий дефіцит електронної густини і достатньо високий частковий позитивний заряд (3+):
 -
-

 O
O
 3+
3+
+ O===S -
 O
O
Субстрат Електрофіл -Комплекс-Комплекс


H2SO4
-------------
-HSO4-
Бензенсульфонат-іон Бензенсульфонова кислота
Реакція сульфування належить до оборотних процесів: при оброблювані продукта перегрітою водяною парою протікає зворотна реакція – десульфування:


SO3H2SO4, 250C
-------------------------
------------------------
H2O, 1500C (-H2SO4)
Бензен Бензенсульфонова
(бензенсульфо)кислота
4) Алкілювання – реакція Фріделя –Крафтса– введення алкільної групи у бензенове кільце у присутності каталізаторів (кислот Льюіса) з утворенням гомологів бензену. У якості алкилювального реагенту використовують галогеналкани СnH2n+1Hal, спиртиCnH2n+1OH, алкениCnH2n, наприклад:





 800
800
+ CH3Cl ------------- + HCl
AlCl3
Бензен Толуол
Каталізатор ініціює утворення електрофілу за схемою:
СН3Cl + AlCl3 --- CH3+ + [AlCl4]-.
Реакції з алкенами і спиртами каталізуються найчастіше кислотами:
 00C
00C
+ СH3-CH====CH2 --------
HF
Ізопропілбензен
(кумол)
 OH
OH
600C
+ СH3-C-CH3 -----------
H3PO4
СH3 Трет-бутілбензен
5) Ацилювання– заміщення атому Гідрогену в бензеновому кільці на ацильну групуRCO. У якості ацилювального реагента використовують галогенангідриди чи ангідриди карбонових кислот; при цьому одержують змішані ароматично-аліфатичні кетони.


 O
800C
O
800C
 + СН3-С-----------
+ HCl
+ СН3-С-----------
+ HCl
Cl AlCl3
Бензен Хлорацетіл Ацетофенон
(галогенангідрид
оцтової кислоти)
 O
O
 CH3-C
800C
CH3-C
800C
+ O ---------- + CH3COOH
 CH3-C
AlCl3
CH3-C
AlCl3
 O
O
Бензен Ангідрид Ацетофенон
Оцтової кислоти
ІІ Реакції приєднання АЕсупроводжуються порушенням ароматичності, тому вимагають великої витрати енергії і проводяться в дуже жорстких умовах
Гідрування(відновлення)


2000C, 50 Атм
+ 3Н2---------------------- Н
Ni
Бензен Циклогексан
Реакція використовується для одержання циклогексана, який є, по-перше, добрим розчинником, а по-друге, - вихідною речовиною при добуванні адипінової кислоти, а з неї – капролактама.
Реакція оборотна: при 3000С і нормальному тиску протікає зворотний процес.
Х
 лоруванняпри інтенсивному ультрафіолетовому
опромінюванні:
лоруванняпри інтенсивному ультрафіолетовому
опромінюванні:

УФ
+ 3Cl2 ----------
Гексахлорциклогексан (гексахлоран)
Гексахлоран – сильна харчова, контактна і дихальна отрута, застосовується як інсектицид: смертельна доза для мух становить усього 10-12 г.
ІІІ Реакції окиснення
Відмінною рисою ароматичних вуглеводнів є їх стійкість по відношенню навіть до сильних окисників. У звичайних умовах на них не діють ні концентровані кислоти, ні хромова суміш, ні розчинKMnO4. Однак у жорстких умовах вони піддаються окисненню:
 O O
O O
 C C
C C
5000C HC H2O HC OH
+ О2---------- O -------
V2O5 HC HC O
C C
O OH
Бензен -2СО2Малеіновий Малеїнова
-2Н2О ангідрид кислота
Малеіновий ангідрид і малеінова кислота використовуються у виробництві поліестерних смол, склопластика і лакофарбних матеріалів.
У живих організмах бензен під дією ферментів окиснюється до дуже шкідливої сполуки – муколової кислоти:

+ 2О2------------------- HOOC-CH=CH-CH=CH-COOH
Фермент
Бензен Муконова кислота
