
- •III.2 Ароматичні вуглеводні
- •2.1 Ароматичність. Будова молекули бензену
- •2.2 Класифікація, номенклатура
- •2.3 Ізомерія
- •2.4 Фізичні властивості
- •2.5 Хімічні властивості бензену
- •Ііі.2.6 Вплив замісників на реакційну здатність ароматичних сполук
- •2.7 Хімічні особливості гомологів бензену
- •2.8 Властивості поліядерних аренів
- •2.9 Одержання аренів
- •2.10 Використання аренів
2.7 Хімічні особливості гомологів бензену
В основному для гомлогів бензену характерні такі ж властивості, що і для самого бензену. Однак наявність вуглеводневого радикалу, яка сприяє перерозподілу електронної густини, накладає свою специфіку на швидкість і напрямок протікання реакцій.
1) Реакції електрофільного заміщення в алкілбензенахдають суміш продуктів, як було показано на прикладі нітрування толуолу в параграфі 2.6.
 Оскільки
алкільний радикал СН3- є замісником
І роду, тобто орто- і пара-орієнтаном,
то утворюється суміш головним чином о-
іn-нітротолуолів. Однак
активуюча дія метильного радикалу, який
полегшує реакціїSE
, приводить до того, що нітрування
в більш жорстких умовах дає трьохзаміщену
нітросполуку:
Оскільки
алкільний радикал СН3- є замісником
І роду, тобто орто- і пара-орієнтаном,
то утворюється суміш головним чином о-
іn-нітротолуолів. Однак
активуюча дія метильного радикалу, який
полегшує реакціїSE
, приводить до того, що нітрування
в більш жорстких умовах дає трьохзаміщену
нітросполуку:

1400
+ 3HONO2 ------------- + 3H2O
олеум
Толуол 2,4,6-Тринітротолуол (тротил)

 Реакційна
здатність аренів з двома чи з трьома
насиченими радикалами ще більше зростає,
особливо якщо вони мають узгоджену
орієнтацію. Так, мезителен легко
нітрується навіть при відємних
температурах:
Реакційна
здатність аренів з двома чи з трьома
насиченими радикалами ще більше зростає,
особливо якщо вони мають узгоджену
орієнтацію. Так, мезителен легко
нітрується навіть при відємних
температурах:
-100C
+ HO-NO2(розв.)-------------- +Н2О
CH3COOH
Мезитилен 2,4,6-Триметилнітробензен
 Аналогічно
до мононітрування толуолу протікають
реакціїSE
з іншими реагентами, наприклад,
бромування:
Аналогічно
до мононітрування толуолу протікають
реакціїSE
з іншими реагентами, наприклад,
бромування:

 ----------------
+ HBr
----------------
+ HBr
+ Br2 -------------
 FeBr2
о-Бромтолуол
FeBr2
о-Бромтолуол
Толуол ----------------
+ HBr
n-Бромтолуол
Алкілювальні реагенти діють менш селективно порівняно з іншими електрофілами. Так, метилювання толуолу при 00С дає о- іn-ксилоли, а при підвищенній температури - мета-ізомер. Цікаво, що нагрівання о- іn-ксилолів спричиняє їх ізомеризацію:

0oC
-------------------- +
CH3Cl, AlCl3
------------------- о-Ксилолn-Ксилол
-HCl
Толуол 800C
800C
--------------------
м-Ксилол
2 )Реакції у бокових ланцюгах. Поряд
з реакціямиSE
для алкілбензенів характерні реакції
галогенування за механізмомSR,
які проводять у відповідних умовах.
Заміщення атомів Н у боковому ланцюгу
на галоген протікає селективно, особливо
при бромуванні: переважно заміщується
бензильний атом Н, тобто гідроген,
сполучений з атомом Карбону, найближчим
до ароматичного ядра. Така селективність
пояснюється впливом бензенового кільця
на міцність звязку
С-Н у бензильному положенні і невеликою
енергією звязку
(314 кДж/моль). З цієї причини швидкість
радикального бромування толуолу у 3
рази більша, ніж бромування ізобутану
(нагадуємо, що при третичному Карбоні
енергія звязку С-Н
дорівнює 376 кДж/моль) і аж у 108разів
більша, ніж бромування метану. Хлор, як
більш реакційноактивний реагент, виявляє
не таку повну селективність (масове
співвідношення між ізомерними продуктами
наведене у дужках):
)Реакції у бокових ланцюгах. Поряд
з реакціямиSE
для алкілбензенів характерні реакції
галогенування за механізмомSR,
які проводять у відповідних умовах.
Заміщення атомів Н у боковому ланцюгу
на галоген протікає селективно, особливо
при бромуванні: переважно заміщується
бензильний атом Н, тобто гідроген,
сполучений з атомом Карбону, найближчим
до ароматичного ядра. Така селективність
пояснюється впливом бензенового кільця
на міцність звязку
С-Н у бензильному положенні і невеликою
енергією звязку
(314 кДж/моль). З цієї причини швидкість
радикального бромування толуолу у 3
рази більша, ніж бромування ізобутану
(нагадуємо, що при третичному Карбоні
енергія звязку С-Н
дорівнює 376 кДж/моль) і аж у 108разів
більша, ніж бромування метану. Хлор, як
більш реакційноактивний реагент, виявляє
не таку повну селективність (масове
співвідношення між ізомерними продуктами
наведене у дужках):
Br2, УФ

 ----------------
+ HBr
----------------
+ HBr
------- 1-Бром-1-фенілетан (100%)
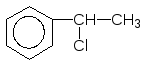
 Cl2,
h
Cl2,
h
Етилбензен ----------
-HCl +
1-Феніл-1- 2-Феніл-1-
хлорбензен хлорбензен
(90%) (10%)
 Арени
з насиченими боковими ланцюгами
піддаються дегідруванню (реакції
елімінування Е) при одержанні стирену,
який використовують при виробництві
синтетичних каучуків:
Арени
з насиченими боковими ланцюгами
піддаються дегідруванню (реакції
елімінування Е) при одержанні стирену,
який використовують при виробництві
синтетичних каучуків:
 5000C
5000C
---------------------- + H2
Al2O3/Cr2O3
Етилбензен Стирен (стирол)
Гомологи бензену з ненасиченими боковими ланцюгами дуже важко вступають у реакції SE в ароматичному кількці , якщо кратний звязок знаходиться при бензильному атомі Карбону (тобто замісники належать до дезактивуючих м-орієнтантів, які сповільнюють реакцію). Однак у той же час вуглеводням з ненасиченим боковим ланцюгом притаманні всі реакції, характерні для подвійних і потрійних звязків, наприклад, знебарвлення бромної води (якісна реакція на крайній потрійний звязок):


+ Br2 -----------
Н2О
 Стирен
1,2-Дибромфенілетан
Стирен
1,2-Дибромфенілетан

+ Ag2O -------------- + H2O
NH4OH
Фенілацетилен Фенілацетиленід
срібла
3) Окиснення. На відміну від бензену його гомологи значно легше окиснюються навіть лужним розчиномKMnO4, за виключенням алкілбензенів з третичним бензильним атомом Карбону. Для трет-алкілбензенів необхідно створювати більш жорсткі умови, наприклад, кипятіння з концентрованим сірчанокислим розчиномKMnO4. Продуктом окиснення завжди буває бензойна кислота – незалежно від довжини і розгалуженості бокового ланцюгу.

 [O]
[O]
------------------------ + CO2
KMnO4, KOH
Етилбензен Бензойна кислота

 [O]
[O]
------------------------ + 2 CO2
KMnO4, KOH
Кумол


[O]
----------------------------
KMnO4, KOH
Трет-Бутилбензен


[O], t0
--------------------------- + 3 CO2
KMnO4, H2SO4(конц.)
Полізаміщені гомологи бензену при окисненні дають багатоосновні кислоти:


[O]
------------------------
KMnO4, KOH
n-КсилолБензен-1,4-дикарбонова
 (терефталева)
кислота
(терефталева)
кислота

[O]
------------------------
KMnO4, KOH
ДуролБензен-1,2,4,5-тетракарбонова
(1,2,4,5-тетраметилбензен) (піромелітова) кислота

 Можна
здійснити і селективне окиснення тільки
одного алкільного радикалу при дії на
дизаміщений арен гарячою розведеною
азотною кислотою
Можна
здійснити і селективне окиснення тільки
одного алкільного радикалу при дії на
дизаміщений арен гарячою розведеною
азотною кислотою
[O]
------------------------
HNO3 (розв.)
О-Ксилоло-Толуілова кислота


[O]
------------------------
HNO3 (розв.)
n-Цимолn-Толуілова кислота
Реакції окиснення використовують для ідентифікації аренів (одержуючи певну кислоту за її будовою встановлюють взаємне розміщення бокових ланцюгів у вихідному алкілбензені) і для промислового добування важливих продуктів. Наприклад, терефталеву кислоту піддають сополімеризації з багатоатомним спиртом, внаслідок чого утворюються важливі поліестери.
