
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •5. Классификация и изменение кислотно-основных свойств неорганических гидроксидов с позиции полярности химической связи, характера электролитической диссоциации и поляризации ионов.
- •6. Сила и термическая прочность неорганических соединений. Теорий кислот и оснований.
- •7 Вопрос
- •7. Типы и механизмы образования химической связи. Гибридизация атомных орбиталей. Полярность связи и молекул.
- •8 Вопрос
- •Вопрос9
- •10. Термодинамические функции и их значение. Понятие об энтальпии, энтропии, свободной энергии Гиббса. Возможность и направленность реакции.
- •13 Вопрос
- •14 Вопрос
- •Вопрос 15
- •16 Вопрос
- •Вопрос 17
- •Вопрос 18
- •19 Вопрос
- •20 Вопрос
13 Вопрос
Термодинамика процесса растворения
Образование раствора - это самопроизвольный термодинамический процесс (ΔG< 0). Термодинамика растворения позволяет объяснить, почему одни вещества в одном и том же растворителе растворяются ограниченно, а другие неограниченно. В первом случае, ΔG> 0 - затраты энергии на разрыв связей между молекулами компонентов большие и одного теплового движения (диффузии) недостаточно; во втором случае ΔG< 0 - запас энергии достаточен для полного смешения.
Например: анилин - вода при н.у. это система ограниченно смешивающихся жидкостей, при изменении условий (Т > 168 °С) и соотношения компонентов (48,6 % анилина и 51,4 % воды) переходит из гетерогенного в гомогенное состояние, образуя устойчивый раствор.
Рассмотрим
условия самопроизвольного образования
раствора. Учитывая, что ,
а
растворение это физико-химический
процесс, то тепловой эффект и энтропия
растворения будут равны соответственно:
,
а
растворение это физико-химический
процесс, то тепловой эффект и энтропия
растворения будут равны соответственно:
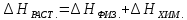 ,
,

При
растворении твердых тел физический
процесс связан с разрушением
кристаллической решетки, при этом
энергия затрачивается, т.е. протекает
эндо-термический процесс ( >
0); химический процесс связан с образованием
гидратов, при этом энергия выделяется,
т.е. протекает экзотермический процесс
(
>
0); химический процесс связан с образованием
гидратов, при этом энергия выделяется,
т.е. протекает экзотермический процесс
( <0).
Соотношением затраченной и выделенной
энергий и определяется тепловой эффект
растворения в целом. Так, при растворении
ацетатов, нитратов, карбонатов
<0).
Соотношением затраченной и выделенной
энергий и определяется тепловой эффект
растворения в целом. Так, при растворении
ацетатов, нитратов, карбонатов >
>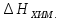 ,
поэтому
,
поэтому >
0, а для хлоридов, сульфатов, щелочей,
наоборот,
>
0, а для хлоридов, сульфатов, щелочей,
наоборот, <
< поэтому
поэтому <
0. Этим объясняется склонность
сульфатов к образованию кристаллогидратов.
<
0. Этим объясняется склонность
сульфатов к образованию кристаллогидратов.
При
растворении жидкостей и газов
кристаллическую решетку разрушать
не требуется, поэтому процесс растворения
жидкостей и газов, как правило,
экзотермический ( <
0). Энтропия растворения(ΔSраст)
в целом зависит от агрегатного состояния
и природы смешивающихся компонентов.
Для твердых тел
<
0). Энтропия растворения(ΔSраст)
в целом зависит от агрегатного состояния
и природы смешивающихся компонентов.
Для твердых тел
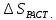 >
0, для газов
>
0, для газов <
0 (для газов), а для жидкостей может быть
<
0 (для газов), а для жидкостей может быть <или
> 0. Условия самопроизвольного
образования раствора отражены в
сводной таблице 8.1.
<или
> 0. Условия самопроизвольного
образования раствора отражены в
сводной таблице 8.1.
Таблица 8.1 - Термодинамика процесса растворения
|
Растворенное вещество |
|
|
|
Примеры |
Растворимость возрастает |
|
Твердые тела |
|
|
|
Na2CO3 NaOH |
при высо-кихТ при низких Т |
|
Газы |
|
|
|
CO2 |
при низких Т и высоких Р |
|
Жидкости |
|
|
|
HCl CH3COOH |
При низких Т |
Природа растворенного вещества и растворителя - полярные и ионные соединения, как правило, хорошо растворяются в полярных растворителях, а неполярные — в неполярных. Так, хлорид натрия хорошо растворяется в воде, но плохо - в бензоле; бензол практически нерастворимый в воде, смешивается в любых соотношениях с органическими растворителями.
Температура - повышение температуры увеличивает растворимость эндотермического процесса и уменьшает растворимость экзотермического процесса растворения. Растворимость твердых веществ в жидкостях зависит от знака теплового эффекта его растворения, растворимость жидкостей в жидкостях, как правило, с ростом температуры увеличивается, а растворимость газов в жидкостях, наоборот, уменьшается (поэтому кипячение растворов - один из способов удаления из них газов).
Давление —растворимость газа при постоянной температуре прямо пропорциональна его парциальному давлению (закон Генри: с = kР). Давление влияет только на растворимость газов.
Условия смещения химического равновесия
Обозначим, через ПК произведение неравновесных, а ПРравновесных молярные концентраций ионов малорастворимого соединения (мр.с.):
ПК = c(Km+)n·c(An-)m; ПР = [Km+]n·[An-]m
Условие гетерогенного равновесия:
ПК = ПРили с(Кm+)n • с(Аn-)m = [Кm+]n • [Аn-]m
При равновесии: vрастворения = vосаждения.
Образуется насыщенный раствор мр.с.
Условие образования осадка:
ПК>ПРилис(Кm+)n• с(Аn-)m>[Кm+]n• [Аn-]m
При осаждении мр.с. :vрастворения <vосаждения
Образуется пересыщенный раствор мр.с.
Условие растворения осадка:
ПК<ПРилиc(Km+)n• c(An-)m<[Km+]n•[Аn-]m
При растворении осадка мр.с.: vрастворения >vосаждения
Образуется ненасыщенный раствор мр.с.
Например: для системы: AgCl↔Ag+ + Сl–;ПP(AgCl) = 1,8·10-10
условие равновесия:c(Ag+) •с(Сl–)=[Ag+] • [Сl–] = 1,8·10-10
условие осаждения: c(Ag+ )•с(Сl– ) >1,8·10-10
условие растворения: c(Ag+) • с(Сl–) <1,8·10-10
Пути смещения химического равновесия
Пути образования осадка: согласно, принципу ЛeШателье, для смещения химического равновесия в сторону осаждения мр.с. необходимо увеличить концентрацию ионов мр.с. Это достигается при введении в насыщенный раствор сильных электролитов, содержащих однотипные ионы с ионами мр.с.
Например: увеличить концентрацию ионов мр.с. AgCl, можно введением AgNO3 при этом c(Ag+)tи КСl при этом с(Сl–)|. Получают пересыщенный раствор, и равновесие смещается в сторону образования осадка AgCl.
Пути растворения осадка: согласно, принципу ЛеШателье, для смещения химического равновесия в сторону растворения осадка мр.с., необходимо уменьшить концентрацию ионов мр.с. Это достигается путем введения в насыщенный раствор сильных электролитов, способных связать ионы мр.с. в более химически прочно связанное соединение.К ним относятся малодиссоциированные (мд.с), малорастворимые (мр.с), комплексные и летучие соединения (газы).
Например: уменьшить в насыщенном растворе концентрацию ионов мр.с. AgCl, можно путем введения KI, при этом c(Ag+)↓, так как ионы йода (I–) связывают ионы серебра (Ag+) в другое более прочное соединение AgI (ПРAgI= 1,5·10-16), по сравнению с AgCl (HPAgCl = 1,8·10-10). В результате осадок AgCl растворяется, так как образуется новый осадок AgI:
AgCl↓ + KI→AgI↓ +KC1
Следовательно, превращение одного малорастворимого соединения в другое малорастворимое соединение (мр.с.) возможно только при условии, если ПР первого мр.с. будет иметь большее значение, чем ПР второго мр.с., т.е. прочность первого мр.с. должна быть меньше прочности второго мр.с.
Многие реальные растворы являются многокомпонентными системами. Если в аналитических целях необходимо разделить компоненты раствора, то часто пользуются методом дробного осаждения ионов. Этот метод используется, когда прибавляемый реактив (осадитель) образует малорастворимое соединение не с одним, а с несколькими ионами, находящимися в растворе (образуется смесь осадков мр.с.).
В первую очередь выпадает в осадок то малорастворимое соединение, которое имеет меньшее значение произведения растворимости (ПР), т.е. имеет меньшую растворимость (Р).
Например: если к раствору двух солей КСl и NaIпостепенно добавлять раствор AgNO3, то в первую очередь выпадает в осадок AgIи только потом AgCl. Это связано с тем, что:
ПР(AgCl) > ПР (AgI), т.е. Р (AgCl) > Р (AgI).



 >
0
>
0 <
0.
<
0. >
0
>
0 <
0
<
0 <
0.
<
0.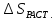 <
0
<
0 <
0
<
0 <
0.
<
0. <
0
<
0 >
0
>
0 <
0
<
0