
61.08 Фізична хімія
.pdf4.Охолоджують суміш та відмічають температуру гетерогенізації суміші, за якої рідина у пробірці знову стане каламутною. Якщо результати процесу охолодження співпадають з результатами процесу нагрівання, переходять до іншої пробірки з сумішшю і проводять аналогічний дослід.
5.Результати кожного досліду заносять до таблиці:
Таблиця 2.1
Номер пробірки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Масова частка |
|
|
|
|
|
|
|
|
речовини |
|
|
|
|
|
|
|
|
Температура |
|
|
|
|
|
|
|
|
гомогенізації |
|
|
|
|
|
|
|
|
Температура |
|
|
|
|
|
|
|
|
гетерогенізації |
|
|
|
|
|
|
|
|
6. На основі отриманих результатів будують діаграму температура змішування – склад. Розраховують ступені вільності та склад фаз для точок, вказаних викладачем на діаграмі температура розчинення – склад.
Опрацювання результатів
За допомогою правила важеля з діаграми можна визначити не лише число рівноважних фаз та їх склад, але й кількісні співвідношення між масами фаз: маси рівноважних фаз обернено пропорційні до відрізків, на які поділяє ноду фігуративна точка системи (рис. 2.1):
g1 |
|
Ob |
(2.2) |
|
g2 |
Oa |
|||
|
|
Ступені вільності системи (число змінних термодинамічних параметрів в системі) визначаються за правилом фаз Гіббса (2.1).
Оскільки досліди з визначення температури гомогенізації та розшарування шляхом нагрівання та охолодження двохкомпонентних систем проводять за сталого тиску, правило фаз Гіббса для двохкомпонентної системи можна записати:
С К Ф 1 3 Ф |
(2.3) |
Оскільки студент одержує системи фенол–вода |
та ізоаміловий |
спирт–гліцерин у запаяних ампулах, похибка проведення експерименту буде залежати тільки від вимірів температури розшарування, яка визначається за допомогою термометра на 100 С. Вимірювання температури проводиться з точністю до одного градуса. Тоді загальна похибка експерименту:
T |
|
1 |
100% 1% . |
|
T |
100 |
|||
|
|
Питання для самоперевірки
21
1.У чому суть фізико-хімічного аналізу?
2.Дайте визначення поняттям фаза, фазовий перехід, компонент, незалежний компонент, ступінь вільності?
3.Сформулюйте правило фаз Гіббса.
4.Застосуйте правило фаз до двокомпонентних систем за умови змінних тиску та температури. Розрахуйте максимальну кількість рівноважних фаз.
5.Дайте визначення поняттю «нода»?
6.Сформулюйте правило Алексєєва щодо визначення кількісного співвідношення між масами рівноважних фаз в даній точці за діаграмою стану.
7.Фізичний зміст критичної точки двокомпонентної рідкої системи.
8.Які системи називають системами з верхньою КТР? Накреслити, як приклад, діаграму стану.
9.Які системи називають системами з нижньою КТР? Накреслити, як приклад, діаграму стану.
22
Лабораторна робота № 3
КРІОМЕТРИЧНЕ ВИЗНАЧЕННЯ МОЛЯРНОЇ МАСИ РЕЧОВИНИ
Мета роботи ознайомитися з кріометричним методом визначення молярної маси розчиненої речовини.
Теоретичні відомості
Визначення молярної маси базується на властивості розчинів замерзати за температури, нижчої за температуру замерзання чистого розчинника. Залежність температури замерзання розчину від його концентрації кількісно описує фізична теорія розчинів. Ця теорія розглядає так звані ідеальні розчини, тобто такі, для яких відсутні явища асоціації, дисоціації, сольватації та ін. Близькими за властивостями до ідеальних є дуже розведені розчини.
Якщо до складу розчину входить леткий розчинник (вода, спирт, бензол та ін.), в якому розчинена якась нелетка речовина (сахароза, сіль та ін.), то чим вища концентрація розчину, тим нижчий тиск насиченої пари (пружність пари) розчинника над ним. Кількісну сторону цієї закономірності описує закон Рауля: відносне зниження тиску насиченої пари розчинника над розчином дорівнює молярній частці розчиненої речовини:
P |
|
P0 P |
N |
|
(3.1) |
|||
P |
0 |
P |
0 |
2 |
||||
|
|
|
||||||
|
|
|
|
|
|
|||
де Ρ – тиск насиченої пари розчинника над розчином; Ро – тиск насиченої пари над чистим розчинником; Ρ–Ρо – зниження тиску насиченої пари розчинника над розчином; N2 – молярна частка розчиненої речовини. Закон використовується тільки для ідеальних або для нескінченно розведених розчинів.
Молярною часткою i-го компонента розчину (Ni) є відношення кількості молів цього компонента до сумарної кількості молів всіх компонентів розчину:
Ni |
|
|
ni |
|
|
ni |
|
(3.2) |
n1 |
|
|
i |
|||||
|
|
n2 ... ni ... nk 1 nk |
i |
|
||||
|
|
|
|
|
|
ni |
|
|
|
|
|
|
|
|
1 |
|
|
Рівняння (3.1) можна |
використати |
для визначення |
молярної маси |
|||||
розчиненої речовини (М). Запишемо рівняння для двокомпонентного розчину:
|
|
N2 |
|
|
|
n2 |
, |
(3.3) |
|
|
|
n1 |
n2 |
||||||
|
|
|
|
|
|
|
|||
де n1 та n2 – кількість молів |
|
відповідно розчинника та |
розчиненої |
||||||
речовини. Тоді |
|
|
|
|
|
|
|
|
|
Р |
|
|
n2 |
|
|
|
(3.4) |
||
Р о |
n |
|
n |
|
|
|
|||
|
1 |
|
|
|
2 |
|
|
|
|
Оскільки розчин є дуже розведеним, значенням n2 можна знехтувати у порівнянні зі значенням n1 в знаменнику і рівняння буде мати вигляд
23

Р |
|
n2 |
(3.5) |
Р о |
n |
||
|
1 |
|
|
Позначимо g1 – масу наважки розчинника; g2 – масу наважки розчиненої речовини, a M1 та M2 – молярні маси відповідно розчинника і розчиненої речовини. Тоді n1=g1/M1 і n2=g2/M2. Підставимо значення n1 та n2 в (3.5) і одержимо:
|
Р |
|
|
g2 |
M1 |
(3.6) |
|||||
|
Ро |
|
g |
1 |
M |
2 |
|
||||
|
|
|
|
|
|
|
|
|
|||
Звідки |
|
|
|
|
|
|
|
|
|
|
|
M 2 |
|
|
|
g2 |
M1 |
(3.7) |
|||||
g |
1 |
( P / Po ) |
|||||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
Різниця у тиску насиченої пари над розчином і розчинником є малою та незручною для експериментального визначення з достатньою точністю. Набагато легше вимірювати інші величини, які залежать від зниження тиску насиченої пари. До них належить зміна температур кипіння та замерзання розчинів порівняно з відповідними значеннями для чистого розчинника.
Залежність між тиском насиченої пари і температурою розчинника і
розчинів різної концентрації зображено на рис. 3.1. |
|
|
|
|
|
|
Крива |
1 |
показує залежність |
||
|
тиску |
насиченої |
пари над |
||
|
розчинником |
від |
температури, |
||
|
крива 2 – залежність тиску |
||||
|
насиченої |
пари |
того самого |
||
|
розчинника від температури над |
||||
|
розчином з концентрацією C1; |
||||
|
крива 3 – те саме над розчином з |
||||
|
більшою концентрацією С2. |
||||
|
Крива ОВ2 |
дає зміну тиску пари |
|||
|
над твердою фазою розчинника |
||||
|
(у випадку водних розчинів – |
||||
Риc. 3.1. Залежність тиску насиченої |
над |
льодом |
за |
температур |
|
пари над розчинником і розчином від |
нижчих за нуль). |
|
|||
температури |
|
|
|
|
|
В точці 0 співіснують одночасно рідка фаза – вода та тверда фаза –лід з рівноважним тиском насиченої пари Ро. Цій точці відповідає температура замерзання води – Т 3о .
Розглянемо, як змінюється температура замерзання розчинів зі зміною їх концентрації і, відповідно, зі зміною тиску насиченої пари над ними.
При замерзанні розведеного розчину з нього кристалізується чистий розчинник. Замерзання розчину на відміну від чистої рідини йде в деякому інтервалі температур. Перші кристали розчинника виділяються за певної температури (при цьому концентрація розчину збільшується); подальше виділення кристалів з розчинів проходить при зниженні температури.
24
Температурою замерзання розчину певної концентрації називають температуру, за якої з'являються перші кристали розчинника.
Розглядаючи рис. 3.1, можна зробити висновок, що температура
замерзання відповідних розчинів Т 1 |
та Т 2 |
нижча за температуру замерзання |
3 |
3 |
|
чистого розчинника Т о . Різниця |
між температурою замерзання чистого |
|
3 |
|
|
розчинника і розчину називається зниженням температури замерзання ΔT3:
Т з Т з0 Т 1з (3.8)
З допомогою термодинамічних розрахунків можна показати, що між зниженням температури замерзання і концентрацією розчину існує
прямопропорційна залежність: |
|
|
Т з |
Кк С |
(3.9) |
де Т3 – зниження температури замерзання розчину; Кк – кріоскопічна стала; С – моляльна концентрація розчину, г/л.
Кріоскопічна стала чисельно дорівнює зниженню температури замерзання одномоляльного розчину за умови, що розчин цієї концентрації має властивості ідеального, а розчинена речовина не дисоціює на іони.
Кріоскопічна стала дорівнює:
|
|
R (T o )2 |
|
||
Kk |
3 |
|
(3.10) |
||
1000 |
l |
||||
|
|
|
|||
де R – універсальна газова стала; l – питома теплота кристалізації розчинника.
З (3.10) виходить, що кріоскопічна стала є величиною, що залежить тільки від природи розчинника.
Концентрація розчиненої речовини подається як кількість молів
розчиненої речовини у 1000 г розчинника. |
Тоді |
у формулі (3.9) цю |
концентрацію можна виразити через маси розчинника g1 |
і розчиненої речовини |
|
g2 міркуючи таким чином: якщо розчин вміщує g2 |
грамів розчиненої речовини, |
|
що становить g2/M моль (М – молярна маса розчиненої речовини) у g1 |
грамах |
|||||||
розчинника, на 1000 г розчинника припадає C моль розчиненої речовини: |
||||||||
С |
1000 g2 |
|
(3.11) |
|||||
|
|
M g1 |
||||||
|
|
|
|
|||||
Тоді рівняння (3.9) набирає вигляду |
|
|
|
|
|
|
|
|
ΔTз К |
|
|
1000 g2 |
|
(3.12) |
|||
к |
|
M g1 |
||||||
|
|
|
|
|
||||
Рівняння (3.12) вирішують відносно молярної маси розчиненої речовини: |
||||||||
М К к |
|
1000 g2 |
. |
(3.13) |
||||
|
|
|||||||
|
|
|
|
Т з g1 |
|
|||
Кріоскопічні сталі деяких розчинників наведені в табл. 3.1.
25
|
|
|
|
Таблиця 3.1 |
|
Кріоскопічні сталі деяких розчинників |
|
||
|
|
|
|
|
Розчинник |
|
Кк |
Розчинник |
Кк |
Вода |
|
1,86 |
Фенол |
7,80 |
Нітробензол |
|
5,90 |
Камфора |
49,00 |
Бензол |
|
5,10 |
|
|
|
|
|
|
|
Зниження тиску насиченої пари над розчином так само, як і зниження температури замерзання розчину залежить лише від кількості часток, молекул, іонів, асоціатів розчиненої речовини і не залежить від природи цих частинок. Зазначені властивості одержали назву колігативних властивостей розчинів. Відомо, що 1 моль речовини вміщує NА= 6,02 1023 молекул (стала Aвогадро). Однак, якщо утворення розчину супроводжується асоціюванням молекул розчиненої речовини, тобто утворенням часток, що складаються з груп молекул, при розчиненні 1 моль речовини, утворюється менша кількість часток у розчині (N NА), тобто концентрація виявиться меншою порівняно з тією, що була б за відсутності асоціації. Це призводить до того, що зменшення
температури замерзання розчину |
T |
T 0 |
T 1 |
виявиться замалим, а |
|
з |
з |
з |
|
розрахована молярна маса буде завеликою.
При розчиненні електроліту дисоціація його молекул призводить до збільшення кількості частинок у розчині залежно від природи електроліту і ступеня його дисоціації. В цьому випадку (N> NА) концентрація виявиться більшою за розраховану і зниження температури замерзання розчину буде завеликим, а розрахована молярна маса – замалою.
Одержані таким чином молярні маси називають "уявними".
Для слабкого електроліту відношення істинної молярної маси Міст до "уявної" Муяв показує в скільки разів збільшилась кількість частинок в розчині внаслідок дисоціації:
М іст М уяв і |
(3.14) |
||
Число і називається ізотонічним коефіцієнтом. Залежність між ізотонічним |
|||
коефіцієнтом і та ступенем дисоціації така: |
|
||
³ 1 1 |
(3.15) |
||
звідки |
|
||
|
i 1 |
|
(3.16) |
|
|||
1 |
|
||
де – кількість іонів, на які дисоціює молекула в розчині.
Якщо розчинення неелектроліту не супроводжується його асоціацією (наприклад, утворення водних розчинів невеликих концентрацій сахарози, сечовини), кріометричні вимірювання дають істині значення молярної маси. Таким чином, у водних розчинах істинна молярна маса визначається тільки у випадку неелектролітів (сахароза, глюкоза та ін.).
26

Молярна маса електролітів визначається кріоскопічним методом в органічних розчинниках, у яких розчинена речовина не дисоціює.
Якщо розчинена речовина – електроліт, що розпадається на два іони, використовують рівняння для розрахунку коефіцієнта активності розчиненої
речовини : |
|
|
|
|
|
lg 3 j |
(3.17) |
||||
де |
|
|
|
|
|
j 1 |
T3 |
|
|
(3.18) |
|
2 K |
k |
C |
|||
|
|
|
|
|
|
Якщо відомий коефіцієнт активності, можна обчислити активність |
|||||
розчиненої речовини а, моляльна концентрація якої С, г/л: |
|
||||
a C |
|
|
|
(3.19) |
|
Визначення температури замерзання чистого розчинника
Найчастіше охолодження рідини до температури замерзання не спричинює утворення твердої фази (льоду). Рідина, що має температуру нижчу за температуру її замерзання, називається переохолодженою. Іноді переохолодження може досягати кількох градусів, що призводить до нових ускладнень при визначенні температур замерзання. Переохолодження неоднаково впливає на визначення температур замерзання розчинника і розчину.
Якщо зміну температури води з часом подати в системі координат температура–час, одержимо криву (рис. 3.2). В початковий момент часу вода мала температуру оточуючого середовища T1 – точка а на кривій. До часу 2 вода досягла температури замерзання Т 3о – точка в, але не замерзла і до часу 3, в точці с зазнала переохолодження до Т2
|
На |
|
ділянці |
вс |
||
|
відбувалось |
|
|
|
||
|
переохолодження. В точці с |
|||||
|
почали |
швидко |
випадати |
|||
|
кристали льоду. Температура |
|||||
|
замерзаючої води за рахунок |
|||||
|
теплоти |
|
кристалізації |
|||
|
підвищилась |
|
і |
стала |
||
|
дорівнювати |
температурі |
||||
|
замерзання |
Т3о |
(точка d). |
|||
|
Різниця |
Т о –Т |
називається |
|||
|
|
3 |
2 |
|
|
|
|
температурою переохолод- |
|||||
|
ження. |
|
|
Подальше |
||
Рис. 3.2. Термографічна крива |
охолодження |
не |
веде до |
|||
зменшення |
температури, |
|||||
охолодження води |
||||||
|
|
|
|
о |
||
|
вона залишається сталою Т 3 , |
|||||
|
|
|
|
|
27 |
|

бо в рівновазі співіснують фази: пара–вода–лід. Температура залишається сталою доки в системі існують усі три фази, тобто поки не замерзла вся вода. Замерзання всієї води при охолодженні веде до подальшого зниження температури і, починаючи з точки f, йде охолодження льоду.
На практиці, спостерігаючи меніск у термометрі, при охолодженні рідини будемо бачити, що температура води постійно знижується, потім різко зростає і встановлюється на сталому значенні протягом значного часу. Це й буде температура замерзання води.
Температуру замерзання визначають не менше як два рази. Відхилення не повинно становити більше як 0,01 °С.
Температура переохолодження може бути більшою або меншою залежно від умов заморожування. При перемішуванні вона є набагато меншою, оскільки за цих умов легше виникають центри кристалізації. При визначенні Т3о води
переохолодження не збільшує похибку. Енергійне та рівномірне перемішування пришвидшує вимірювання.
Визначення температури замерзання розчину
При охолодженні розчину температура його знижується, він може охолодитись нижче температури замерзання – стати переохолодженим (рис.
3.3).
В момент часу τ1 розчин мав температуру Т1. З часом розчин охолоджується за прямою ас. У точці с розчин настільки переохолоджується, що починає замерзати і утворюються кристали розчинника (води). Виділення льоду підвищує температуру розчину за рахунок теплоти кристалізації і в точці d часу 3 розчин буде мати температуру
Рис. 3.3. Термографічна крива замерзання розчину Т31 . охолодження розчину
Різниця між величинами Т3о (температура замерзання розчинника) і Т31 (температура замерзання розчину) визначає величину Т.
Завдання на виконання роботи
1.За допомогою кріоскопа провести дослідження щодо замерзання розчинника при поступовому зниженні температури в часі.
2.Побудувати термографічну криву та визначити температуру замерзання розчинника.
28
3.Провести аналогічні експерименти з розчином певної концентрації.
4.Визначити зниження температури замерзання розчину в порівнянні з розчинником.
5.Визначити молярну масу розчиненої речовини.
Установки, прилади, лабораторний посуд, реактиви
Кріоскоп (мікрохолодильник), випрямлювач постійного струму, термометр Бекмана, пробірка, мішалка, вода, сіль.
Мікрохолодильник використовують для одержування низьких температур за допомогою термоелектричної батареї. Під час проходження постійного струму крізь контакт різнорідних провідників в залежності від напрямку струму виділяється або поглинається деяка кількість теплоти. В патрон мікрохолодильника вставляють пробірку з широким горлом, закривають її корком, в який вставлено термометр Бекмана та мішалку.
Термометр Бекмана використовують для визначення відносної температури, має ціну поділки 0,01 ºС. Він із великою точністю вимірює малі зміни температури. Лаборант налаштовує термометр для кріометричних вимірювань.
Порядок виконання роботи
1.В суху широкогорлу пробірку наливають таку кількість розчинника, щоб його рівень був вищий ртутної кульки термометра на 8–10 мм. Поміщений
впробірку з рідиною термометр Бекмана з мішалкою треба встановити так, щоб відстань між ртутною кулькою і стінками пробірки була приблизно однаковою знизу і з боків. Потім термометр витягують з пробірки і вимірюють об’єм цієї рідини мірним циліндром. Вважаючи, що густина води дорівнює одиниці, визначають масу розчинника g1.
2.Пробірку з розчинником, термометром Бекмана та мішалкою встановлюють в патрон мікрохолодильника і при постійному перемішуванні охолоджують розчинник, за термометром Бекмана визначають зниження температури з часом до встановлення рівноваги (до сталої температури, дослід повторюють двічі).
3.Будують термограму охолодження і визначають температуру замерзання розчинника Т30, тобто коли в рівновазі знаходяться три фази пара– вода–лід (рис. 3.2). Коли замерзне вся вода іде переохолодження льоду.
4.Виймають з пробірки термометр Бекмана. Отримують робочу сіль і в широкогорлу пробірку вносять речовину, що розчиняється шляхом висипання із попередньо зваженої на технічних терезах маленької пробірки. Потім маленьку пробірку знову зважують. За різницею визначають масу наважки розчиненої речовини g2.
5.При постійному перемішуванні охолоджують розчин і за термометром
Бекмана визначають зниження температури з часом до встановлення рівноваги (дослід повторюють двічі), фіксують температуру замерзання розчину Т31.
29
6. Будують термограму охолодження і визначають температуру замерзання розчину Т31 (рис. 3.3). Розбіжність між двома послідовними вимірами не повинна перевищувати 0,01 ºС.
Опрацювання результатів
1. Обчислюють зниження температури замерзання розчину за рівнянням
3.8.
2.При визначенні істинної молярної маси електролітів кріометричним методом, необхідно використовувати органічні розчинники, в яких розчинена речовина не дисоціює. Обчислюють молярну масу розчиненої речовини за рівнянням 3.13.
3.Порівнюють одержані значення молярної маси з довідковими значеннями, що знаходяться у лаборанта.
4.Якщо розчинена речовина неелектроліт, визначають похибку вимірювань і на цьому роботу закінчують.
5.Якщо розчинена речовина електроліт, визначена молярна маса буде ―уявною‖, тобто значно меншою за дійсне значення за рахунок процесу дисоціації розчиненої речовини. Тому знаходять відношення М іст 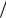 М уяв і .
М уяв і .
6.Знаючи і (ізотонічний коефіцієнт), можна визначити ступінь дисоціації за рівнянням 3.16.
7.Активність реальних розчинів менше їх концентрації. Обчислюють коефіцієнт активності та активність розчиненої речовини за рівняннями 3.17 і
3.19.
Питання для самоперевірки
1.Сформулюйте закон Рауля. Для яких розчинів справджується закон Рауля?
2.Властивості якого компоненту розчину (розчиненої речовини чи розчинника) визначають кріоскопічну сталу?
3.Поясніть взаємозв’язок між зниженням тиску насиченої пари розчинника над розчином та зниженням температури замерзання розчину.
4.Поясніть зміст поняття ―уявна‖ молярна маса розчиненої речовини.
5.Як практично визначити температуру замерзання розчину? Як визначити зниження температури замерзання розчину порівняно з розчинником?
6.Як визначити ступінь дисоціації слабкого електроліту за зниженням температури замерзання розчину?
7.Як обчислити молярну масу розчиненої речовини – неелектроліту за зниженням температури замерзання розчину?
8.Особливості термометра Бекмана. З якою точністю і в яких межах можна проводити виміри цим приладом?
9.Які величини можна розрахувати після експериментального визначення температури замерзання розчину?
30
